上海市嘉定区2023届高三一模化学试题
试卷更新日期:2023-03-20 类型:高考模拟
一、单选题
-
1. 中华文化源远流长,为人类文明的发展做出了巨大贡献。下列上海博物馆的镇馆之宝中,主要由合金材料制成的是A、
 大克鼎
B、
大克鼎
B、 朱克柔缂丝图
C、
朱克柔缂丝图
C、 苦笋帖
D、
苦笋帖
D、 清景德镇瓶
2. 元素周期表的第四周期为长周期,该周期中的副族元素共有A、32种 B、18种 C、10种 D、7种3. 《天工开物》中对“海水盐”有如下描述:“凡煎盐锅古谓之牢盆,……其下列灶燃薪,多者十二三眼,少者七八眼,共煎此盘,……火燃釜底,滚沸延及成盐。”文中没有涉及到的操作是A、加热 B、过滤 C、蒸发 D、结晶4. 下列气体的制备和性质实验中,由现象得出的结论错误的是( )
清景德镇瓶
2. 元素周期表的第四周期为长周期,该周期中的副族元素共有A、32种 B、18种 C、10种 D、7种3. 《天工开物》中对“海水盐”有如下描述:“凡煎盐锅古谓之牢盆,……其下列灶燃薪,多者十二三眼,少者七八眼,共煎此盘,……火燃釜底,滚沸延及成盐。”文中没有涉及到的操作是A、加热 B、过滤 C、蒸发 D、结晶4. 下列气体的制备和性质实验中,由现象得出的结论错误的是( )选项
试剂
试纸或试液
现象
结论
A
浓氨水、生石灰
红色石蕊试纸
变蓝
NH3为碱性气体
B
浓盐酸、浓硫酸
pH试纸
变红
HCl为酸性气体
C
浓盐酸、二氧化锰
淀粉碘化钾试液
变蓝
Cl2具有氧化性
D
亚硫酸钠、硫酸
品红试液
褪色
SO2具有还原性
A、A B、B C、C D、D5. 在“石蜡 →石蜡油 →石蜡气体→裂化气”的变化过程中,被破坏的作用力依次是A、范德华力、范德华力、范德华力 B、共价键、共价键、共价键 C、范德华力、共价键、共价键 D、范德华力、范德华力、共价键6. 下列有关物质性质的比较,结论正确的是A、溶解度:Na2CO3<NaHCO3 B、热稳定性:HCl<PH3 C、沸点:C2H6<C4H10 D、碱性:LiOH<Be(OH)27. 下列金属冶炼的反应原理,不恰当的是。A、2NaCl(熔融) B、 C、 D、8. 如图是四种常见有机物的比例模型示意图。下列说法正确的是( ) A、甲能使酸性高锰酸钾溶液褪色 B、乙可与溴水发生取代反应使溴水褪色 C、丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键 D、丁在稀硫酸作用下可与乙酸发生取代反应9. 下列各项物质使用一种试剂就能鉴别出来的是A、苯、甲苯、己烯 B、己烯、汽油、苯 C、甲苯、己烯、四氯化碳 D、苯、甲苯、二甲苯10. 反应A(g)+B(g)C(g)+D(g)+Q发生过程中能量变化如图。下列说法正确的是
A、甲能使酸性高锰酸钾溶液褪色 B、乙可与溴水发生取代反应使溴水褪色 C、丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键 D、丁在稀硫酸作用下可与乙酸发生取代反应9. 下列各项物质使用一种试剂就能鉴别出来的是A、苯、甲苯、己烯 B、己烯、汽油、苯 C、甲苯、己烯、四氯化碳 D、苯、甲苯、二甲苯10. 反应A(g)+B(g)C(g)+D(g)+Q发生过程中能量变化如图。下列说法正确的是 A、反应体系中加入催化剂,反应速率增大,E1减小,E2增大 B、反应体系中加入催化剂,反应速率增大,Q增大 C、Q<0,反应达到平衡时,升高温度,A的转化率减少 D、Q>0,反应达到平衡时,增大压强,A的转化率不变11. 食盐中的常用作补碘剂,通过碘单质和氯酸钾反应制备,该方法的第一步反应为 , 下列说法正确的是A、产生时,反应中转移 B、反应中氧化剂和还原剂的物质的量之比为 C、是还原产物 D、发生还原反应12. 苹果酸环二酯(OP)的结构简式如图所示,下列相关说法错误的是( )
A、反应体系中加入催化剂,反应速率增大,E1减小,E2增大 B、反应体系中加入催化剂,反应速率增大,Q增大 C、Q<0,反应达到平衡时,升高温度,A的转化率减少 D、Q>0,反应达到平衡时,增大压强,A的转化率不变11. 食盐中的常用作补碘剂,通过碘单质和氯酸钾反应制备,该方法的第一步反应为 , 下列说法正确的是A、产生时,反应中转移 B、反应中氧化剂和还原剂的物质的量之比为 C、是还原产物 D、发生还原反应12. 苹果酸环二酯(OP)的结构简式如图所示,下列相关说法错误的是( ) A、OP不能使酸性高锰酸钾溶液褪色 B、OP能在NaOH溶液中发生水解反应 C、OP能使Br2的CCl4溶液褪色 D、OP能与Na2CO3溶液发生反应13. 常温下,下列各组离子在给定溶液中能大量共存的是( )A、pH=1的溶液:Fe2+、Mg2+、 、 B、pH=12的溶液:K+、Na+、 、 C、pH=7的溶液:Na+、Cu2+、S2-、Cl- D、pH=7的溶液:Al3+、K+、Cl-、14. 球形干燥管是中学化学常用的一种玻璃仪器。下列有关球形干燥管的创新用途,错误的是
A、OP不能使酸性高锰酸钾溶液褪色 B、OP能在NaOH溶液中发生水解反应 C、OP能使Br2的CCl4溶液褪色 D、OP能与Na2CO3溶液发生反应13. 常温下,下列各组离子在给定溶液中能大量共存的是( )A、pH=1的溶液:Fe2+、Mg2+、 、 B、pH=12的溶液:K+、Na+、 、 C、pH=7的溶液:Na+、Cu2+、S2-、Cl- D、pH=7的溶液:Al3+、K+、Cl-、14. 球形干燥管是中学化学常用的一种玻璃仪器。下列有关球形干燥管的创新用途,错误的是选项
A
B
C
D
装置

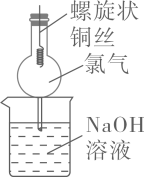


用途
用于尾气处理,防倒吸
用于铜丝与Cl2反应,防污染
简易的天 然水净化过滤器
用Na2CO3固体与稀硫酸反应制备CO2气体,可随制随停
A、A B、B C、C D、D15. 硫及其化合物的“价—类”二维图体现了化学变化之美。下列有关说法正确的是 A、硫在氧气中燃烧直接生成Y B、Z与Cu反应,体现了Z的酸性和强氧化性 C、硫化氢与X反应的氧化产物和还原产物的物质的量之比为1:2 D、N可由其相应单质直接化合生成16. 1-丁醇、溴化钠和的硫酸共热反应,经过回流、蒸馏、萃取分液制得1-溴丁烷粗产品,装置如图所示:
A、硫在氧气中燃烧直接生成Y B、Z与Cu反应,体现了Z的酸性和强氧化性 C、硫化氢与X反应的氧化产物和还原产物的物质的量之比为1:2 D、N可由其相应单质直接化合生成16. 1-丁醇、溴化钠和的硫酸共热反应,经过回流、蒸馏、萃取分液制得1-溴丁烷粗产品,装置如图所示: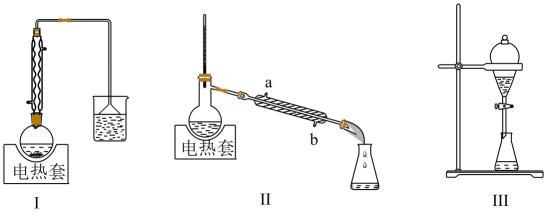
已知:CH3(CH2)3OH+NaBr+H2SO4CH3(CH2)3Br+NaHSO4+H2O,说法正确的是
A、装置I中回流的目的是为了减少物质的挥发,提高产率 B、装置II中a为进水口,b为出水口 C、用装置III萃取分液时,将分层的液体依次从下放出 D、蒸馏、过滤、分液、洗气四种分离物质的方法,均不可能发生化学变化17. 如图装置可以模拟铁的电化学防护,下列说法错误的是 A、若X为锌棒,开关K置于M处时,铁电极反应为:2H++2e-=H2↑ B、若X为锌棒,开关K置于M或N处均可减缓铁的腐蚀 C、若X为炭棒,开关K置于N处时,铁电极反应2H++2e-=H2↑ D、若X为炭棒,开关K置于N处可以减缓铁的腐蚀18. 我国化学家侯德榜创立了著名的“侯氏制碱法”(流程简图如图所示),促进了世界制碱技术的发展.下列有关说法正确的是( )
A、若X为锌棒,开关K置于M处时,铁电极反应为:2H++2e-=H2↑ B、若X为锌棒,开关K置于M或N处均可减缓铁的腐蚀 C、若X为炭棒,开关K置于N处时,铁电极反应2H++2e-=H2↑ D、若X为炭棒,开关K置于N处可以减缓铁的腐蚀18. 我国化学家侯德榜创立了著名的“侯氏制碱法”(流程简图如图所示),促进了世界制碱技术的发展.下列有关说法正确的是( ) A、沉淀池中的反应物共含有五种元素 B、过滤得到的“母液”中一定只含有两种溶质 C、图中X可能是氨气 D、通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀19. 常温下,用 0.1000 mol·LNaOH溶液滴定 20.00mL0.1000 mol·L溶液所得滴定曲线如图。下列说法正确的是
A、沉淀池中的反应物共含有五种元素 B、过滤得到的“母液”中一定只含有两种溶质 C、图中X可能是氨气 D、通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀19. 常温下,用 0.1000 mol·LNaOH溶液滴定 20.00mL0.1000 mol·L溶液所得滴定曲线如图。下列说法正确的是 A、点①所示溶液中: B、点②所示溶液中: C、点③所示溶液中: D、滴定过程中可能出现:20. 将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应:2 SO2(g)+ O2(g)
A、点①所示溶液中: B、点②所示溶液中: C、点③所示溶液中: D、滴定过程中可能出现:20. 将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应:2 SO2(g)+ O2(g) 2SO3(g) △H<0。得到如表中的两组数据:
2SO3(g) △H<0。得到如表中的两组数据:实验编号
温度/℃
平衡常数/mol-1·L
起始量/mol
平衡量/mol
达到平衡所需时间/min
SO2
O2
SO2
O2
1
T1
K1
4
2
x
0.8
6
2
T2
K2
4
2
0.4
y
t
下列说法错误的是
A、实验1在前6min的平均反应速率υ(SO2)=0.2 mol·L-1·min-1 B、T1、T2的关系:T1 > T2 C、K1、K2的关系:K2>K1 D、x= 1.6,y=0.2 ,t<6二、非选择题
-
21. 氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氯化碳,有下列反应:2Na[Al(OH)4]+CO2→2Al(OH)3↓+Na2CO3+H2O。(1)、上述五种物质中沸点最低物质的结构式为 , 由上述物质中的两种元素按原子个数比1:1形成的离子化合物的电子式为(写一例)。(2)、请将Na、Al、O的原子半径和简单离子的半径分别按由小到大的顺序排列:(用元素符号表示),(用离子符号表示)。(3)、①在上述混合物的组成元素中,与铝元素同周期的另一元素的原子共有种不同能级的电子,该元素的最高价氧化物对应水合物与铝单质反应的离子反应方程式为。
②已知AlN的熔点2200℃,AlCl3的熔点194℃,二者常温下均为固体,其熔点差异较大的原因是。
(4)、NaHCO3溶液中各含碳微粒按浓度由大到小的顺序排列。22. 某研究小组将2molNH3、3molNO和一定量的O2充入2L密闭容器中,在Ag2O催化剂表面发生4NH3(g)+6NO(g)5N2(g)+6H2O(l)+Q,NO的转化率随温度变化的情况如图1所示: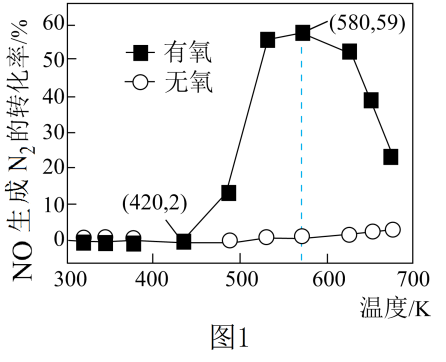 (1)、平衡常数表达式为K=;在5min内,温度从420K升高到580K,此时段内NO的平均反应速率v(NO)=。(2)、已知,298K时,相关物质的相对能量如图2所示,反应的Q=。
(1)、平衡常数表达式为K=;在5min内,温度从420K升高到580K,此时段内NO的平均反应速率v(NO)=。(2)、已知,298K时,相关物质的相对能量如图2所示,反应的Q=。 (3)、在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是。(4)、用NaClO氧化也可除去氨氮(溶液中以NH3或形式存在),已知:NH3+NaClO→N2+H2O+NaCl(未配平),NH3与NaClO反应时,氧化剂与还原剂物质的量之比为。(5)、请简述氨氮溶液中含有的检验方法:。23. 布洛芬可以缓解新冠病毒感染的症状,对新冠病毒感染有一定的治疗作用,其一种合成路线如图:
(3)、在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是。(4)、用NaClO氧化也可除去氨氮(溶液中以NH3或形式存在),已知:NH3+NaClO→N2+H2O+NaCl(未配平),NH3与NaClO反应时,氧化剂与还原剂物质的量之比为。(5)、请简述氨氮溶液中含有的检验方法:。23. 布洛芬可以缓解新冠病毒感染的症状,对新冠病毒感染有一定的治疗作用,其一种合成路线如图:
已知:
①RCHO+CH3CHO

②
 (1)、A的结构简式为 , 由A到B的反应类型是。(2)、试剂a是。(3)、根据布洛芬的结构特点,预测其性质(写一条即可)。(4)、已知E中含有两个六元环,C和D生成E的化学方程式为。(5)、布洛芬的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。
(1)、A的结构简式为 , 由A到B的反应类型是。(2)、试剂a是。(3)、根据布洛芬的结构特点,预测其性质(写一条即可)。(4)、已知E中含有两个六元环,C和D生成E的化学方程式为。(5)、布洛芬的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。①苯环上有三个取代基,苯环上的一氯代物有两种
②能发生水解反应
③能发生银镜反应,且有五种化学环境的氢原子
(6)、根据本题布洛芬的合成信息,完成以甲苯为原料,制备 的合成路线(其他试剂任选)。 24. 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:(1)、I.测定绿矾中结晶水含量
的合成路线(其他试剂任选)。 24. 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:(1)、I.测定绿矾中结晶水含量为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。

将下列实验操作步骤正确排序→→→→c→e(填字母);重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2 , 缓缓通入N2
e.称量A
f.冷却到室温
(2)、根据实验记录,计算绿矾化学式中结晶水数目x=(列式表示)。(3)、II.探究绿矾的热分解产物该小组用如图所示装置进行实验(夹持仪器略)。

在实验过程中,观察到A中固体变红棕色,B中的现象:;C中试纸的颜色变化是。
(4)、D中有白色沉淀生成,该沉淀的化学式为。有同学认为还应该增加一个实验,取D中沉淀,加入一定量的盐酸以确定其组成,从而确定FeSO4·xH2O的分解产物,你认为是否必要?(填“是”或者“否”)请说明你的理由:。(5)、III.测定绿矾热分解时的温度与剩余固体质量关系将8.34gFeSO4∙7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示。已知M(FeSO4∙7H2O)=278g∙mol-1 , 在100℃时,M的化学式为。
