陕西省宝鸡市2023届高三下学期模拟检测(二)模理综化学试题
试卷更新日期:2023-03-20 类型:高考模拟
一、单选题
-
1. 化学与生活、生产、环境、材料密切相关。下列说法正确的是A、包装用的材料聚乙烯和聚氯乙烯都属于烃 B、豆浆、牛奶的彻底水解产物中含有氨基酸 C、纳米铁粉通过物理吸附可除去污水中的Pb2+、Hg2+ D、合成纤维和光导纤维均属于新型的无机非金属材料2. 下列方程式与所给事实相符的是A、用Na2CO3溶液处理锅炉水垢中CaSO4:Ca2++=CaCO3↓ B、自然界正常雨水的pH=5.6:CO2+H2OH2CO3 , H2CO32H++ C、用氢氟酸在玻璃表面刻蚀花纹:SiO2+4HF=SiF4↑+2H2O D、铝溶于NaOH溶液产生气泡:Al+2OH-=+H2↑3. 下表是元素周期表的一部分,W、X、Y、Z、Q为短周期主族元素,W与X的最高化合价之和为8。下列说法正确的是
W
Q
X
Y
Z
A、简单离子半径:Q<W<X B、最简单氢化物的沸点:Q>Z C、X、Y分别与Q可形成离子化合物 D、Y、Z、W的氧化物均为酸性氧化物4. 某实验小组利用下图装置探究浓硫酸与葡萄糖反应生成的气体成分。下列说法正确的是 A、使反应发生的操作是将a中的Y形管向右倾斜 B、装置b中出现白色沉淀,可能是BaCO3或BaSO3 C、装置d中出现浑浊,证明产生的气体中含有CO2 D、装置e中可以盛放NaOH溶液,f的作用为防倒吸5. 2022年诺贝尔化学奖授予在“点击化学和生物正交化学”领域做出贡献的三位科学家。点击化学经典反应之一是:一价铜[Cu]催化的叠氮化物-端炔烃环加成反应,反应机理示意如下。
A、使反应发生的操作是将a中的Y形管向右倾斜 B、装置b中出现白色沉淀,可能是BaCO3或BaSO3 C、装置d中出现浑浊,证明产生的气体中含有CO2 D、装置e中可以盛放NaOH溶液,f的作用为防倒吸5. 2022年诺贝尔化学奖授予在“点击化学和生物正交化学”领域做出贡献的三位科学家。点击化学经典反应之一是:一价铜[Cu]催化的叠氮化物-端炔烃环加成反应,反应机理示意如下。
下列说法正确的是
A、一价铜[Cu]能有效降低总反应的焓变,加快反应速率 B、反应③过程中,涉及极性键和非极性键的断裂和形成 C、总反应为 D、反应过程中共生成4种中间产物
6. 海泥细菌通过消耗海底沉积层中的有机物获得营养,同时产生电子。科学家利用这一原理设计了海泥细菌电池,该技术可在海底加速石油污染物降解速率,其中海泥代谢产物显酸性,电池工作原理如图所示。下列说法错误的是
D、反应过程中共生成4种中间产物
6. 海泥细菌通过消耗海底沉积层中的有机物获得营养,同时产生电子。科学家利用这一原理设计了海泥细菌电池,该技术可在海底加速石油污染物降解速率,其中海泥代谢产物显酸性,电池工作原理如图所示。下列说法错误的是 A、负极的电极反应式为:CH2O-4e-+H2O=CO2+4H+ B、工作时B电极附近溶液pH减小 C、海水和海泥含有电解质,导电性高,有利于输出电能 D、A电极消耗标况下O25.6L,有1mol质子通过海底沉积层和海水层交接面7. 氯化亚铜(CuCl)是一种难溶于水的白色固体,常温下,CuCl(s)Cu+(aq)+Cl-(aq) Ksp=1.2×10-6。在氯离子浓度较大的体系中,氯化亚铜发生溶解,生成两种配合物离子:CuCl(s)+Cl-(aq)=(aq) K1=0.36;(aq)+Cl-(aq)(aq) K2。用盐酸溶解时,溶液中含铜粒子分布分数(δ)与c(Cl-)的关系如图所示。下列说法错误的是
A、负极的电极反应式为:CH2O-4e-+H2O=CO2+4H+ B、工作时B电极附近溶液pH减小 C、海水和海泥含有电解质,导电性高,有利于输出电能 D、A电极消耗标况下O25.6L,有1mol质子通过海底沉积层和海水层交接面7. 氯化亚铜(CuCl)是一种难溶于水的白色固体,常温下,CuCl(s)Cu+(aq)+Cl-(aq) Ksp=1.2×10-6。在氯离子浓度较大的体系中,氯化亚铜发生溶解,生成两种配合物离子:CuCl(s)+Cl-(aq)=(aq) K1=0.36;(aq)+Cl-(aq)(aq) K2。用盐酸溶解时,溶液中含铜粒子分布分数(δ)与c(Cl-)的关系如图所示。下列说法错误的是 A、常温下,反应的平衡常数K1>K2 B、图中交点处溶液中:c(H+)-c(OH-)>2c(Cl-) C、Cu+(aq)+2Cl-(aq)(aq)的平衡常数K=3.0×105 D、常温下,若溶液中几乎不含Cu+ , 则c(Cl-)至少大于0.12mol·L-1
A、常温下,反应的平衡常数K1>K2 B、图中交点处溶液中:c(H+)-c(OH-)>2c(Cl-) C、Cu+(aq)+2Cl-(aq)(aq)的平衡常数K=3.0×105 D、常温下,若溶液中几乎不含Cu+ , 则c(Cl-)至少大于0.12mol·L-1二、非选择题
-
8. 三氯化六氨合钴[Co(NH3)6]Cl3是一种橙黄色、微溶于水的配合物,常用于合成其他含钴的配合物。利用含钴废料(含少量Fe、Al等杂质)制取[Co(NH3)6]Cl3的工艺流程如图所示:

已知:①浸出液中含有的金属离子主要有Co2+、Fe2+、Fe3+、Al3+。
②氧化性H2O2>Co3+>>Fe3+。
③该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表:
沉淀物
Fe(OH)3
Co(OH)3
Co(OH)2
Al(OH)3
开始沉淀
2.7
\
7.6
4.0
完全沉淀
3.7
1.1
9.2
5.2
(1)、如图是用盐酸酸浸时钴的浸出率与温度的关系,则酸浸时合适的浸出温度是℃,若酸浸时将温度控制在80℃左右会生成一定量的 , 其可能的原因。 (2)、“浸出液”中加入时发生反应的离子方程式为。(3)、“滤渣”的主要成分是和 , “调pH”的范围。(4)、“滤液”中主要含 , 经“操作I”可获得较纯净的晶体,“操作I”包括向溶液加入调节pH,蒸发浓缩、、过滤等过程。(5)、流程中除作反应物外,还可防止加氨水时过大生成杂质,其原理是。(6)、“氧化”时应先加入氨水生成配离子后再加 , 若生成晶体,则理论上消耗的质量为g。(7)、通过碘量法可测定产品中钴的含量。称取0.10g的产品,将其转化成后,加入过量KI和2~3滴淀粉溶液,再用标准液。滴定,达到滴定终点时消耗溶液20mL,则产品中钴的含量。反应原理:。9. 乙二胺四乙酸(简称EDTA,结构简式为
(2)、“浸出液”中加入时发生反应的离子方程式为。(3)、“滤渣”的主要成分是和 , “调pH”的范围。(4)、“滤液”中主要含 , 经“操作I”可获得较纯净的晶体,“操作I”包括向溶液加入调节pH,蒸发浓缩、、过滤等过程。(5)、流程中除作反应物外,还可防止加氨水时过大生成杂质,其原理是。(6)、“氧化”时应先加入氨水生成配离子后再加 , 若生成晶体,则理论上消耗的质量为g。(7)、通过碘量法可测定产品中钴的含量。称取0.10g的产品,将其转化成后,加入过量KI和2~3滴淀粉溶液,再用标准液。滴定,达到滴定终点时消耗溶液20mL,则产品中钴的含量。反应原理:。9. 乙二胺四乙酸(简称EDTA,结构简式为 , 白色粉末,微溶于冷水)是一种能与Ca2+、Mg2+等结合的螯合剂,可用其测定地下水的硬度。某实验室用氯乙酸(ClCH2COOH)、乙二胺(H2NCH2CH2NH2)、NaOH为原料制备EDTA步骤如下:
, 白色粉末,微溶于冷水)是一种能与Ca2+、Mg2+等结合的螯合剂,可用其测定地下水的硬度。某实验室用氯乙酸(ClCH2COOH)、乙二胺(H2NCH2CH2NH2)、NaOH为原料制备EDTA步骤如下:
步骤1:称取94.5g氯乙酸于1000mL的仪器A中(如图1),慢慢加入50%NaHCO3溶液,至不再产生无色气泡。
步骤2:加入15.6g乙二胺,摇匀后放置片刻,加入2.0mol·L-1NaOH溶液90mL,加水至总体积为600mL左右,温度计控温50℃加热2h。
步骤3:冷却液体后倒入烧杯中,加入活性炭脱色,搅拌、静置、过滤。用盐酸调节滤液至pH=1.2,有白色沉淀生成。
步骤4:将该沉淀置于图2装置的布氏漏斗中抽滤,干燥,制得EDTA。

回答下列问题:
(1)、“步骤1”中制备氯乙酸钠反应的化学方程式。(2)、制备EDTA所使用的装置(加热及夹持仪器省略)如图1所示,仪器A的名称为 , 仪器Q的进水口是(填“a”或“b”),滴液漏斗中具支管的作用为。(3)、4ClCH2COONa+H2NCH2CH2NH2⇌ +4HCl是“步骤2”中的发生反应,该步骤中使用NaOH的作用为 , 对A采用的加热方式(选填“酒精灯”“热水浴”或“油浴”)加热。配制该NaOH溶液需要称量NaOH固体的质量为g。 (4)、“步骤3”中混合液的pH可用精密pH试纸测量,简述其测定溶液pH的方法。使用活性炭脱色时一般加入活性炭的量为粗产品质量的1%~5%,加入量过多造成的影响是。(5)、与普通过滤比较,“步骤4”中用图2抽滤分离EDTA的优点是。10. 实现碳中和方法之一是二氧化碳捕捉再利用,研究CO2转化为CH4、CH3OH、HCOOH的重整技术是科学家研究的热点课题,回答下列问题。
+4HCl是“步骤2”中的发生反应,该步骤中使用NaOH的作用为 , 对A采用的加热方式(选填“酒精灯”“热水浴”或“油浴”)加热。配制该NaOH溶液需要称量NaOH固体的质量为g。 (4)、“步骤3”中混合液的pH可用精密pH试纸测量,简述其测定溶液pH的方法。使用活性炭脱色时一般加入活性炭的量为粗产品质量的1%~5%,加入量过多造成的影响是。(5)、与普通过滤比较,“步骤4”中用图2抽滤分离EDTA的优点是。10. 实现碳中和方法之一是二氧化碳捕捉再利用,研究CO2转化为CH4、CH3OH、HCOOH的重整技术是科学家研究的热点课题,回答下列问题。反应i:CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH1
反应ii:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH2=-49kJ·mol-1
(1)、已知下表中断裂1mol化学键所吸收的能量数据,则ΔH1=kJ·mol-1。化学键
H-H
O-H
C-H
C=O
能量/kJ
436
463
413
803
(2)、在573K时,体积为2L的刚性容器中投入2molCO2和6molH2发生反应ii达到平衡。①为了提高CH3OH产率可以采取的措施有(任写两项措施)。
②图1中能表示该反应的平衡常数的对数lnK与(T表示温度)之间的变化关系的曲线是(选填“m”或“n”)。

③测得在相同时间内,不同温度下的H2转化率如图2所示,v(a)逆v(c)逆(选填“>”“<”或“=”);T2温度下该反应的平衡常数K值为(保留两位小数)。
 (3)、在恒容密闭容器中,反应i按进料浓度比c(CO2):c(H2)分别等于1:2、1:5、1:7时,CO2的平衡转化率随条件X的变化关系如图3所示:
(3)、在恒容密闭容器中,反应i按进料浓度比c(CO2):c(H2)分别等于1:2、1:5、1:7时,CO2的平衡转化率随条件X的变化关系如图3所示:
①曲线a的进料浓度比c(CO2):c(H2)为。
②条件X是(选填“温度”或“压强”),依据是。
(4)、我国学者探究了BiIn合金催化剂电化学还原CO2生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图4所示(带“*”表示物质处于吸附态)。
①阴极的电极反应为。
②试从图4分析,采用BiIn合金催化剂既优于单金属Bi催化剂,又优于单金属In催化剂的原因。
11. 配合物顺铂[Pt(NH3)2Cl2]是临床使用的第一代铂类抗癌药物,其抗癌机理是在Cu转运蛋白的作用下,顺铂进入人体细胞发生水解,生成的Pt(NH3)2(OH)Cl与DNA结合,破坏DNA的结构阻止癌细胞增殖,如图1所示: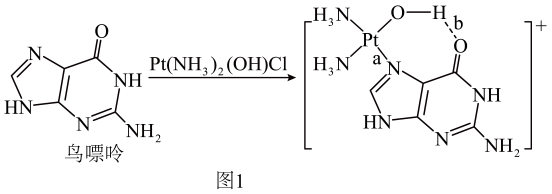 (1)、基态Cu原子价层电子的电子排布图为 , Cu属于区元素。(2)、①鸟嘌呤分子中所含第二周期元素第一电离能由大到小的顺序为。
(1)、基态Cu原子价层电子的电子排布图为 , Cu属于区元素。(2)、①鸟嘌呤分子中所含第二周期元素第一电离能由大到小的顺序为。②在Pt(NH3)2Cl2中,配体与铂(II)的结合能力:ClNH3(选填“>”或“<”)。
③与NH3互为等电子体的分子和离子有、(各举一例)。
(3)、碳铂是1,1-环丁二羧酸二氨合铂(II)的简称,属第二代铂族抗癌药物,其毒副作用低于顺铂。碳铂的结构如图2所示: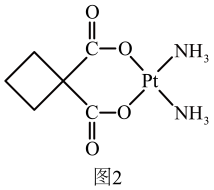
①碳铂中含有的作用力有(填字母)。
A.极性共价键 B.非极性共价键|C.配位键 D.离子键 E.金属键 F.σ键 G.π键
②碳铂分子中采用sp3和sp2杂化的原子个数比。
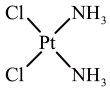
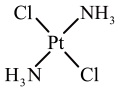
(4)、已知顺铂和反铂互为同分异构体,两者的结构和性质如下表。顺铂
反铂
结构
25℃时溶解度/g
0.2577
0.0366
①推测Pt( NH3) 2Cl2中Pt的杂化轨道类型不是sp3 , 依据是。
②顺铂在水中的溶解度大于反铂的原因是。
(5)、铂晶胞为正方体,晶胞参数为apm,晶胞结构如图3所示。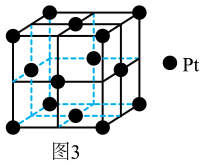
①晶胞中铂(Pt) 原子的配位数为 。
②紧邻的两个Pt原子的距离为 pm, 晶体的摩尔体积Vm =cm3·mol-1(用含a的代数式表示,阿伏加德罗常数为NA , 单位物质的量的物质所具有的体积叫做摩尔体积)。
12. 高聚物G是一种合成纤维,由A与E为原料制备J和G的一种合成路线如下:
已知:①酯能被LiAlH4还原为醇;
②

回答下列问题:
(1)、A的结构简式为。(2)、C的名称是 , J的分子式。(3)、B生成C和D生成H的反应类型分别为、。(4)、写出F+D→G的化学方程式。(5)、芳香化合物M是C的同分异构体,符合下列要求的M有种(不考虑立体异构)①与碳酸钠溶液反应产生气体;
②只有1种官能团;
③苯环上有2个取代基。
其中核磁共振氢谱显示有4种不同化学环境的氢,峰面积之比1 :1:1 :2的结构简式为。
(6)、参照上述合成路线,写出用 为原料制备化合物
为原料制备化合物 的合成路线(其他无机试剂任选) 。
的合成路线(其他无机试剂任选) 。