山东省泰安市2023届一模考试化学试题
试卷更新日期:2023-03-20 类型:高考模拟
一、单选题
-
1. 国际纯粹与应用化学联合会(IUPAC)公布了“2022年度化学领域十大新兴技术”名单,包括钠离子电池、球形核酸、纳米酶和纤维电池等。下列有关说法中错误的是A、钠比锂储量丰富,价格低廉是钠离子电池的显著优势 B、通过红外光谱仪可检测球形核酸结构中是否存在磷酸基等官能团 C、纳米酶分散到水中形成的分散系的本质特征是丁达尔效应 D、柔性纤维电池中正极发生还原反应2. 下列有关物质类别的说法正确的是A、属于酸性氧化物 B、油脂属于高分子化合物 C、棉花、麻和蚕丝均为碳水化合物 D、氮化硼纤维属于有机高分子材料3. 下列有关化学药品的配制和保存的说法中正确的是A、将盛有与乙醇的试剂瓶保存于同一个药品橱中 B、配制溶液时加入少量防止水解 C、纯碱溶液保存在玻璃塞的试剂瓶中 D、白磷浸泡在冷水中,用广口试剂瓶贮存4. M、W、X、Y、Z是原子序数依次增大的同周期主族元素,基态X原子2p能级上有2个未成对电子,Y元素原子的价电子数是W的两倍,由五种元素组成某电极材料的结构如图所示。下列说法错误的是
 A、电极材料的结构中存在配位键 B、简单氢化物沸点:X<Y C、第一电离能:W<X<Y D、单质的氧化性:Z<Y5. 下列实验设计所得结论均正确的是A、将氯水密闭放置一段时间,氯水的颜色变浅,说明氯气能与水反应 B、将制备乙酸乙酯后剩余的反应液加入碳酸钠溶液,有气泡产生,说明乙酸有剩余 C、将酸性高锰酸钾溶液分别加入到苯和甲苯溶液中并振荡,证明甲苯中的甲基可活化苯环 D、向蔗糖溶液中滴加稀硫酸,水浴加热,加入新制的悬浊液,无砖红色沉淀,说明蔗糖未发生水解6. 为阿伏加德罗常数的值,下列说法正确的是。A、25℃,下,乙烯分子中键的数目为2.5 B、浓硝酸热分解生成、共时,转移电子数为0.5 C、
A、电极材料的结构中存在配位键 B、简单氢化物沸点:X<Y C、第一电离能:W<X<Y D、单质的氧化性:Z<Y5. 下列实验设计所得结论均正确的是A、将氯水密闭放置一段时间,氯水的颜色变浅,说明氯气能与水反应 B、将制备乙酸乙酯后剩余的反应液加入碳酸钠溶液,有气泡产生,说明乙酸有剩余 C、将酸性高锰酸钾溶液分别加入到苯和甲苯溶液中并振荡,证明甲苯中的甲基可活化苯环 D、向蔗糖溶液中滴加稀硫酸,水浴加热,加入新制的悬浊液,无砖红色沉淀,说明蔗糖未发生水解6. 为阿伏加德罗常数的值,下列说法正确的是。A、25℃,下,乙烯分子中键的数目为2.5 B、浓硝酸热分解生成、共时,转移电子数为0.5 C、 溶液中,
溶液中, 和
和 的离子数目之和为0.01
D、铁完全发生吸氧腐蚀生成铁锈 , 在电化学过程中转移的电子数为0.3
7. 布洛芬具有消炎、镇痛、解热作用,但口服该药对胃、肠道有刺激性,可以对该分子进行如图所示的分子修饰。下列说法错误的是
的离子数目之和为0.01
D、铁完全发生吸氧腐蚀生成铁锈 , 在电化学过程中转移的电子数为0.3
7. 布洛芬具有消炎、镇痛、解热作用,但口服该药对胃、肠道有刺激性,可以对该分子进行如图所示的分子修饰。下列说法错误的是 A、甲、乙中不对称碳原子数目相同 B、甲分子中最多有10个碳原子共平面 C、甲和乙都能与氢氧化钠溶液发生反应 D、乙中氮原子为杂化8. 某化工厂的废液含有乙醇、苯酚、乙酸和二氯甲烷,该工厂设计回收方案如下:
A、甲、乙中不对称碳原子数目相同 B、甲分子中最多有10个碳原子共平面 C、甲和乙都能与氢氧化钠溶液发生反应 D、乙中氮原子为杂化8. 某化工厂的废液含有乙醇、苯酚、乙酸和二氯甲烷,该工厂设计回收方案如下:
下列说法错误的是
A、试剂a选择溶液比溶液更合适 B、回收物1、2分别是二氯甲烷、乙醇 C、试剂b为 , 试剂c为稀硫酸 D、操作Ⅰ、Ⅱ、Ⅲ均为蒸馏9. 一种汽车玻璃采用了电致变色技术,其工作原理如下图所示:在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节,下列有关说法错误的是
已知:和均无色透明;和均为蓝色;
A、当A接电源正极时,脱离离子储存层 B、当A接电源负极时,电致变色层发生反应为: C、当B接电源正极时,膜的透射率降低,可以有效阻挡阳光 D、该凝胶电解质聚环氧乙烷的结构简式为 , 可以与水分子之间形成氢键,为水溶性聚合物10. 已知Na2SO3 +S= Na2S2O3 , 实验室用下述方法制备固体:①铜和浓硫酸加热产生;②将通入含和的混合溶液,溶液先变浑浊,后逐渐澄清,反应结束;③将溶液经浓缩结晶、过滤洗涤等操作得到产品。下列说法错误的是A、①中消耗转移 B、②中溶液先变浑浊的原因:2Na2S+3SO2= 2Na2SO3+3S↓ C、为提高产品的纯度,混合液中的最佳比例为1∶2 D、用适量溶液吸收②中选出的、气体,吸收液可直接返回到步骤②11. 某同学按图示装置进行实验,向抽滤瓶溶液中通入足量a气体获得a的饱和溶液,再通入足量的b气体,抽滤瓶中最终一定得到沉淀。下列物质组合符合要求的是
a
b
c
A
饱和食盐水
B
溶液
C
溶液
D
溶液
A、A B、B C、C D、D12. 乙炔能在催化下与水反应生成 , 反应历程及相对能垒如图所示。下列说法正确的是 A、过程①中,水分子中的氧原子向的空轨道提供孤对电子 B、本反应历程涉及的物质中,最稳定 C、转化为的过程涉及消去反应 D、其他条件不变时,更换其他催化剂可改变由乙炔和水制备乙醛的焓变13. 乙酸正丁酯是重要的化工原料。实验室将乙酸、正丁醇、浓硫酸加入圆底烧瓶中,加热条件下制备乙酸正丁酯的装置(加热和夹持装置已省略)和有关信息如下:
A、过程①中,水分子中的氧原子向的空轨道提供孤对电子 B、本反应历程涉及的物质中,最稳定 C、转化为的过程涉及消去反应 D、其他条件不变时,更换其他催化剂可改变由乙炔和水制备乙醛的焓变13. 乙酸正丁酯是重要的化工原料。实验室将乙酸、正丁醇、浓硫酸加入圆底烧瓶中,加热条件下制备乙酸正丁酯的装置(加热和夹持装置已省略)和有关信息如下:
乙酸
正丁醇
乙酸正丁酯
熔点/℃
16.6
-89.5
-73.5
沸点/℃
117.9
117
126.0
密度(g/cm3)
1.1
0.80
0.88
下列说法错误的是
A、实验开始时应先加热装置C,再由装置A的b口通入冷凝水 B、装置B的作用是不断分离出产生的水,使反应向正向移动,提高产率 C、当B中水层高度不再变化时,说明反应完全,这时可以停止加热 D、提纯乙酸正丁酯可采取水洗、氢氧化钠溶液洗、无水氯化钙干燥、过滤一系列操作14. 双膜碱性多硫化物空气液流二次电池可用于再生能源储能和智能电网的备用电源等,电极I为掺杂Na2S2的电极,电极II为碳电极。电池工作原理如下图所示。下列说法错误的是 A、离子交换膜a为阳离子交换膜,离子交换膜b为阴离子交换膜 B、放电时,中间储液器中NaOH的浓度不断减小 C、充电时,电极I的电极反应式为:2-2e-= D、充电时,电路中每通过1mol电子,阳极室溶液质量理论上增加9g15. 25℃时,用溶液滴定同浓度的溶液,被滴定分数、及微粒分布分数[ , X表示、或]的关系如图所示:
A、离子交换膜a为阳离子交换膜,离子交换膜b为阴离子交换膜 B、放电时,中间储液器中NaOH的浓度不断减小 C、充电时,电极I的电极反应式为:2-2e-= D、充电时,电路中每通过1mol电子,阳极室溶液质量理论上增加9g15. 25℃时,用溶液滴定同浓度的溶液,被滴定分数、及微粒分布分数[ , X表示、或]的关系如图所示:
下列说法错误的是
A、25℃时,第一步电离平衡常数 B、c点溶液中: C、a、b、c、d四点溶液中水的电离程度:c>d>b>a D、b点溶液中:二、非选择题
-
16. 非金属及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:(1)、基态氟原子的核外电子有种空间运动状态,下列电子排布中属于氟原子且能量较高的是(填序号)。
a. b.
c. d.
(2)、图a、b、c分别表示C、N、O和F的逐级电离能Ⅰ变化趋势(纵坐标的标度不同),以上元素第三电离能的变化图是(填序号)。 (3)、在催化作用下,呋喃(
(3)、在催化作用下,呋喃( )可与氨反应转化为吡咯(
)可与氨反应转化为吡咯( )。二者均存在与苯类似的大键,表示方法为 , n为成环原子个数,m为形成大键电子个数,则
)。二者均存在与苯类似的大键,表示方法为 , n为成环原子个数,m为形成大键电子个数,则 的大键可以表示为。二者的熔、沸点关系为呋喃吡咯(填“高于”或“低于”),原因是。 (4)、晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。属于正交晶系(长方体形)。晶胞参数为、、。如图为沿z轴投影的晶胞中所有氯原子的分布图和原子分数坐标。
的大键可以表示为。二者的熔、沸点关系为呋喃吡咯(填“高于”或“低于”),原因是。 (4)、晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。属于正交晶系(长方体形)。晶胞参数为、、。如图为沿z轴投影的晶胞中所有氯原子的分布图和原子分数坐标。
①据此推断该晶胞中氯原子数目为。的摩尔质量为 , 晶胞密度为 , 则阿伏加德罗常数的值为(列出计算表达式,后同)。
②图中A、B两原子的核间距为nm。
17. 磷酸二氢铵和草酸亚铁晶体可用于制备电池正极材料。(1)、Ⅰ.某研究小组用磷酸吸收氨气制 , 装置如图1所示(夹持和搅拌装置已省略)。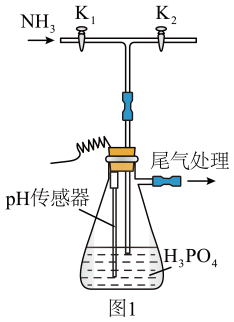
实验过程中,当出现倒吸现象时,(填写实验操作,下同),当上述现象消失后, , 继续通入氨气。
(2)、常温下,磷酸盐溶液中含磷物种的分布系数与的关系如图2所示,据图示分析,若本实验不选用传感器,还可选用作指示剂,当溶液颜色发生相应变化时,停止通 , 即可制得溶液。若此时继续向溶液中通入少量氨气,发生反应的离子方程式为。 (3)、Ⅱ.利用草酸制备草酸亚铁晶体的流程如图所示:
(3)、Ⅱ.利用草酸制备草酸亚铁晶体的流程如图所示: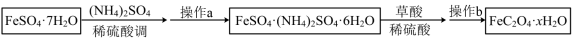
已知:ⅰ.时,易被氧气氧化;
ⅱ.几种物质的溶解度如表:
20℃
48
75
37
60℃
101
88
38
第一次加稀硫酸调溶液至1~2的目的是。
(4)、操作a是蒸发浓缩,(填操作)。(5)、为测定草酸亚铁晶体中结晶水含量,将石英玻璃管(带两端开关和 , 设为装置A)称重,记为。将样品装入石英玻璃管中,再次将装置A称重,记为。按图3所示连接好装置进行实验。
下列实验操作的正确顺序为(填序号)。
①点燃酒精灯,小火加热 ②停止通入氮气,关闭、
③打开、 ④熄灭酒精灯,冷却至室温
⑤缓缓通入氮气 ⑥称重A
重复上述操作步骤,直至A恒重,记为。假设此过程中不分解,根据实验记录,计算草酸亚铁晶体中结晶水数目(列式表示)。
18. 氧化钪可提高计算机记忆元件性能,利用钪精矿为原料(主要成分为 , 还含有、等杂质)生产氧化钪的一种工艺流程如下:
已知:钪与铝类似,其氢氧化物具有两性;是钪元素的萃取剂,萃取发生的反应为。
(1)、加入氨水调节 , 过滤,滤渣主要成分是。(2)、上述洗脱剂X最好选择(选填“酸性”、“碱性”或“中性”)溶液。(3)、过程中生成的离子方程式。(4)、“沉钪”前先加入稀盐酸调节溶液至酸性,然后用草酸“沉钪”。25℃时的草酸溶液中。(25℃时,草酸电离平衡常数为 , )。(5)、“沉钪”后所得到的草酸钪晶体的化学式为 , 灼烧发生分解反应的化学方程式为 , 写出固体产物溶于溶液的离子方程式。19. 一种药物的关键中间体部分合成路线如下: (1)、反应①的反应类型为 , 反应③参加反应的官能团名称为。(2)、反应②要加入 , 目的是。(3)、反应⑤的化学方程式为。(4)、化合物(
(1)、反应①的反应类型为 , 反应③参加反应的官能团名称为。(2)、反应②要加入 , 目的是。(3)、反应⑤的化学方程式为。(4)、化合物( )经过水解和氧化可得到化学式为的化合物Ⅰ,写出同时符合下列条件的Ⅰ的所有同分异构体的结构简式。
)经过水解和氧化可得到化学式为的化合物Ⅰ,写出同时符合下列条件的Ⅰ的所有同分异构体的结构简式。①分子结构中有一个六元环;
②谱显示分子中有3种氢原子。
(5)、设计以甲苯和乙烯为原料制备X( )的合成路线(无机试剂任选,用流程图表示)。 20. 烯腈(
)的合成路线(无机试剂任选,用流程图表示)。 20. 烯腈( )是一种重要的化工原料,以
)是一种重要的化工原料,以 为原料通过脱水、腈化合成丙烯腈的主要反应如下:
为原料通过脱水、腈化合成丙烯腈的主要反应如下: (1)、
(1)、 的名称为。 (2)、某科研小组在盛有催化剂、压强为的恒压密闭容器中按体积比充入和 , 通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如图所示(例如A的物质的量分数w%%)。
的名称为。 (2)、某科研小组在盛有催化剂、压强为的恒压密闭容器中按体积比充入和 , 通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如图所示(例如A的物质的量分数w%%)。
①随着温度的升高,平衡的物质的量分数先增大后减小的原因是。
②a点对应反应的压强平衡常数(保留两位有效数字)。
③在实际生产中,充入一定量(不参与反应)可以提高丙烯腈的平衡产率,原因是。
(3)、家研究腈化反应的机理,通过DFT计算发现反应分2步进行:反应ⅰ:


反应ⅱ:

恒温恒容条件下,向密闭容器中加入一定量
 和 , 图甲为该体系中B、M、C浓度随时间变化的曲线,图乙为反应ⅰ和ⅱ的曲线( , k为速率常数,为反应活化能,R、C为常数)。
和 , 图甲为该体系中B、M、C浓度随时间变化的曲线,图乙为反应ⅰ和ⅱ的曲线( , k为速率常数,为反应活化能,R、C为常数)。
①在时刻之后,反应速率、、的定量关系为。
②结合图乙,反应ⅰ、ⅱ正反应的活化能、的大小关系为(填序号,下同),反应ⅰ、ⅱ的、的大小关系为。
a.前者大于后者|b.前者小于后者| c.无法比较