辽宁省教研联盟2023届高三下学期第一次调研测试(一模)化学试题
试卷更新日期:2023-03-20 类型:高考模拟
一、单选题
-
1. 中国画中以墨色为主,以丹青色彩为辅,这样的水墨丹青画一般画在绢、纸上。下列说法错误的是A、丹指朱砂,也叫辰砂,是的天然矿石 B、青指石青,即蓝铜矿,主要成分 , 该物质属于盐 C、墨的主要原料是炭黑、松烟、胶等,通过砚用水研磨可以产生用于毛笔书写的墨汁,墨汁属于胶体 D、常见绢、纸的主要成分都是纤维素,纤维素属于天然高分子2. 下列化学用语正确的是A、碳化硅的分子式为 B、球棍模型
 可以确定表示的是甲烷
C、乙酸的实验式为
D、分子的空间结构为V形
3. 北京冬奥会被称为“绿色冬奥”“科技冬奥”,下列关于冬奥会所使用高科技的说法中正确的是A、使用了碲化镉发电玻璃,碲元素位于元素周期表中的第四周期第ⅥA族 B、已知镉与锌位于同一族,则镉位于元素周期表的ds区 C、应用了跨临界制冷制冰技术,的形成过程可表示为:
可以确定表示的是甲烷
C、乙酸的实验式为
D、分子的空间结构为V形
3. 北京冬奥会被称为“绿色冬奥”“科技冬奥”,下列关于冬奥会所使用高科技的说法中正确的是A、使用了碲化镉发电玻璃,碲元素位于元素周期表中的第四周期第ⅥA族 B、已知镉与锌位于同一族,则镉位于元素周期表的ds区 C、应用了跨临界制冷制冰技术,的形成过程可表示为: D、使用了氢能大巴,氢气的同素异形体有H、D、T
4. 下列说法正确的是A、分子由两条多聚核苷酸链组成,每条链中的脱氧核糖与磷酸之间以及两条链上的碱基之间都通过氢键而连接 B、葡萄糖有链状结构和环状结构,水溶液中的单糖主要以环状结构的形式存在 C、结构片段为
D、使用了氢能大巴,氢气的同素异形体有H、D、T
4. 下列说法正确的是A、分子由两条多聚核苷酸链组成,每条链中的脱氧核糖与磷酸之间以及两条链上的碱基之间都通过氢键而连接 B、葡萄糖有链状结构和环状结构,水溶液中的单糖主要以环状结构的形式存在 C、结构片段为 的高聚物,是由单体苯酚和甲醛经加聚反应而得
D、
的高聚物,是由单体苯酚和甲醛经加聚反应而得
D、 与
与 都是-氨基酸且互为同系物
5. 下列叙述错误的是A、探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏高 B、取浓度均为的草酸钠和溶液,草酸钠溶液较大,表明草酸是弱酸 C、蒸馏完毕后,应先停止加热,待装置冷却后,停止通冷却水,再拆卸蒸馏装置 D、向酸性溶液中加入粉末,紫色褪去,证明中含(II)6. 氮元素的“价-类”二维关系如图所示。下列说法正确的是
都是-氨基酸且互为同系物
5. 下列叙述错误的是A、探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏高 B、取浓度均为的草酸钠和溶液,草酸钠溶液较大,表明草酸是弱酸 C、蒸馏完毕后,应先停止加热,待装置冷却后,停止通冷却水,再拆卸蒸馏装置 D、向酸性溶液中加入粉末,紫色褪去,证明中含(II)6. 氮元素的“价-类”二维关系如图所示。下列说法正确的是 A、基态氮原子核外电子空间运动状态有7种 B、图中a→b→c→d是工业制硝酸的转化路线 C、图中化合价所对应的氮的含氧酸均为强酸 D、离子中的化学键形成方式不同,但成键后的化学键相同7. 下列离子组中加(或通)入相应试剂后,判断和分析均正确的是( )
A、基态氮原子核外电子空间运动状态有7种 B、图中a→b→c→d是工业制硝酸的转化路线 C、图中化合价所对应的氮的含氧酸均为强酸 D、离子中的化学键形成方式不同,但成键后的化学键相同7. 下列离子组中加(或通)入相应试剂后,判断和分析均正确的是( )选项
离子组
加(或通)入试剂
判断和分析
A
足量
能大量共存
B
足量溶液
不能大量共存,只发生下列反应
C
足量溶液
不能大量共存,因和之间会发生完全双水解生成气体和沉淀
D
少量
不能大量共存,只发生下列氧化还原反应
A、A B、B C、C D、D8. 短周期主族元素X、Y、Z、W的原子序数依次增大,X是植物所需三大营养素之一,基态Y原子的电子总数是其最高能级电子数的2倍,Z与Y形成的物质可用作潜水艇的供氧剂,Y、W最外层电子数相同。下列说法错误的是A、简单氢化物形成的晶体中,一个分子周围紧邻的分子数: B、简单离子的半径: C、第一电离能: D、简单氢化物沸点:9. 水杨酸存在于自然界的柳树皮、白珠树叶及甜桦树中,具有解热镇痛作用,也可用于A、B两种药物成分的制备。
下列说法错误的是
A、由水杨酸转化成A和B的反应类型都是取代反应 B、、分别与溶液反应,消耗物质的量: C、水杨酸与溶液反应,消耗 D、与水杨酸分子式相同、物质类别相同的有机物共有2种10. 叠氮化合物是重要的有机合成试剂,化学兴趣小组的同学在实验室制备了一种叠氮化合物 , 结构如图,下列说法正确的是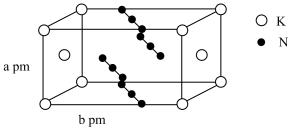 A、该晶体中每个周围离最近且相等的共有8个 B、测定该晶体结构的方法是红外光谱法 C、与相比,的熔点低于的熔点 D、该叠氮化合物的密度为11. 已知反-2-丁烯转化为顺-2-丁烯反应如下, , 和随温度变化的曲线如图。下列有关该反应的说法正确的是( )
A、该晶体中每个周围离最近且相等的共有8个 B、测定该晶体结构的方法是红外光谱法 C、与相比,的熔点低于的熔点 D、该叠氮化合物的密度为11. 已知反-2-丁烯转化为顺-2-丁烯反应如下, , 和随温度变化的曲线如图。下列有关该反应的说法正确的是( )
 A、反-2-丁烯与顺-2-丁烯互为位置异构体 B、温度变化对的影响程度小于对的影响程度 C、正反应的活化能大于逆反应的活化能 D、顺-2-丁烯比反-2-丁烯稳定12. 《X-MOL》报道了一种两相无膜锌/吩噻嗪电池,其放电时的工作原理如图所示(在水系/非水系电解液界面上来回穿梭,维持电荷守恒)。
A、反-2-丁烯与顺-2-丁烯互为位置异构体 B、温度变化对的影响程度小于对的影响程度 C、正反应的活化能大于逆反应的活化能 D、顺-2-丁烯比反-2-丁烯稳定12. 《X-MOL》报道了一种两相无膜锌/吩噻嗪电池,其放电时的工作原理如图所示(在水系/非水系电解液界面上来回穿梭,维持电荷守恒)。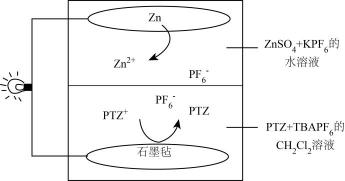
已知:的密度为 , 难溶于水。下列说法错误的是( )
A、电池使用时不能倒置 B、充电时,石墨毡上的电极反应式为 C、放电时,由层移向水层 D、放电时,Zn板每减轻6.5g,水层增重29g13. 根据下列实验操作及现象一定能推出相应结论的是选项
实验操作
现象
结论
A
向某盐溶液中滴加几滴甲基橙溶液
溶液变红
该盐为强酸弱碱盐
B
向NaCl、的混合稀溶液中滴入少量稀溶液
有黑色沉淀生成
C
向酸性溶液中加入足量溶液
溶液紫色褪去
具有还原性
D
向浓硝酸中加入红热木炭
有红棕色气体生成
浓硝酸可与木炭发生反应
A、A B、B C、C D、D14. 如图是苯与卤素发生取代反应进程中的势能变化图,下列说法正确的是 A、该反应的总活化能为 B、该反应的决速步骤为第Ⅲ步 C、第III步转化中失去了一个质子 D、是常用碘化剂,根据电性和反应进程判断,比更易发生碘化反应15. 常温下,向20 mL 0.10 mol/L甲胺的溶液中滴加0.10 mol/L盐酸时混合溶液的pH与相关微粒的浓度关系如图所示。已知:甲胺(CH3NH2)类似于氨,但碱性稍强于氨。下列说法错误的是
A、该反应的总活化能为 B、该反应的决速步骤为第Ⅲ步 C、第III步转化中失去了一个质子 D、是常用碘化剂,根据电性和反应进程判断,比更易发生碘化反应15. 常温下,向20 mL 0.10 mol/L甲胺的溶液中滴加0.10 mol/L盐酸时混合溶液的pH与相关微粒的浓度关系如图所示。已知:甲胺(CH3NH2)类似于氨,但碱性稍强于氨。下列说法错误的是 A、甲胺在水中的电离方程式CH3NH2+H2OCH3NH3++OH- B、b点对应的加入盐酸的体积小于20mL C、将等物质的量的CH3NH2和CH3NH3Cl一起溶于蒸馏水,得到对应a点的溶液 D、常温下,甲胺的电离常数为Kb , 则pKb=-lgKb=3.4
A、甲胺在水中的电离方程式CH3NH2+H2OCH3NH3++OH- B、b点对应的加入盐酸的体积小于20mL C、将等物质的量的CH3NH2和CH3NH3Cl一起溶于蒸馏水,得到对应a点的溶液 D、常温下,甲胺的电离常数为Kb , 则pKb=-lgKb=3.4二、非选择题
-
16. 高铁酸钾是一种紫黑色固体,在碱性、低温条件下较稳定,在中性或酸性溶液中易发生反应,能释放大量的氧气,同时自身被还原产生一种絮凝剂,因此成为一种集氧化、吸附、杀菌、脱色、除臭为一体的高效绿色水处理剂。
I.制备
 (1)、写出高铁酸钾溶于水中发生反应的离子方程式。(2)、①中合成的离子方程式是。(3)、①中合成时,相同时间内产率受温度影响记录如图,产率曲线产生如图变化的可能原因是。
(1)、写出高铁酸钾溶于水中发生反应的离子方程式。(2)、①中合成的离子方程式是。(3)、①中合成时,相同时间内产率受温度影响记录如图,产率曲线产生如图变化的可能原因是。 (4)、操作②的目的是。(5)、已知高铁酸根在苛性钠溶液中的溶解度大于在苛性钾溶液中,则步骤⑤、⑥选择的试剂分别可能是____。A、饱和溶液、一定浓度的溶液 B、一定浓度的溶液、饱和溶液 C、饱和溶液、饱和溶液 D、一定浓度的溶液、饱和溶液(6)、II.产品纯度测定,可采用亚铬酸盐滴定法,滴定时有关反应的离子方程式为:
(4)、操作②的目的是。(5)、已知高铁酸根在苛性钠溶液中的溶解度大于在苛性钾溶液中,则步骤⑤、⑥选择的试剂分别可能是____。A、饱和溶液、一定浓度的溶液 B、一定浓度的溶液、饱和溶液 C、饱和溶液、饱和溶液 D、一定浓度的溶液、饱和溶液(6)、II.产品纯度测定,可采用亚铬酸盐滴定法,滴定时有关反应的离子方程式为:①
②
③
写出基态的价电子排布式。
(7)、现称取(摩尔质量为)粗产品溶于过量的碱性亚铬酸盐溶液中,充分反应后过滤,滤液在容量瓶中定容。每次取于锥形瓶中加入稀硫酸酸化,用标准溶液滴定至终点,消耗标准溶液。该粗产品中的质量分数为(用含a、c、V、M的代数式表示)。若滴定管只用蒸馏水洗涤而未用标准液润洗,则测得的结果(填“偏高”偏低”或“无影响”)。17. 可燃冰是一种高效清洁能源,中国已勘探的可燃冰储量居世界第一,持续安全开采量创下了世界纪录,有望2030年实现产业化开采。科学家也对进行了重点研究。I.与重整的工艺过程中涉及如下反应:
反应①
反应②
反应③
(1)、已知:反应④ , 则。(2)、一定条件下,向体积为的密闭容器中通入各及少量 , 测得不同温度下反应平衡时各产物产量如图所示。
①图中a和c分别代表产生和。由图中信息判断后产生的主要反应并说明理由。
②平衡时,与的转化率分别为95%和90%,体系内余 , 反应③的平衡常数(写出计算式)。
③密闭恒容条件下,反应②达到平衡的标志是
A.每消耗的同时消耗
B.的分压不再发生变化
C.气体平均分子量不再发生变化
D.气体密度不再发生变化
E.比值不再发生变化
(3)、Ⅱ.将与一种产生温室效应的气体利用电解装置进行耦合转化,原理示意如图。
电池工作时,向电极移动。
(4)、若消耗和产生温室效应气体的体积比为3∶2,则生成乙烷和乙烯的体积比为。18. 叠氮化钾能促进难以萌发的种子发育,在新作物育种中应用广泛,实验室制备流程如下。回答下列问题:(1)、I.制备: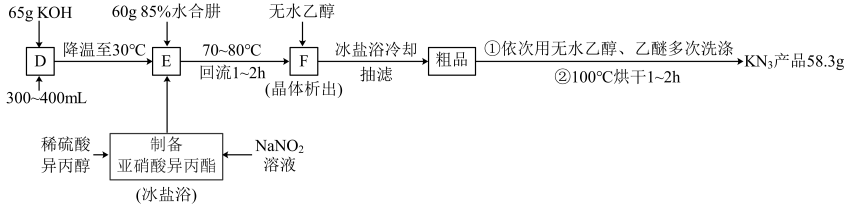
已知:
①制备亚硝酸异丙酯在烧杯中进行;
②制备的D、E和F阶段均在图甲装置中完成。
属于(填“离子化合物”或“共价化合物”)。
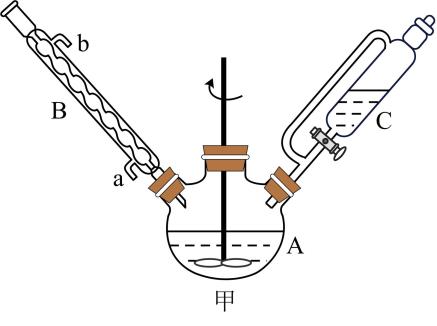
(2)、仪器A的名称为 , 仪器B的作用是。(3)、仪器A中发生反应时,与水合肼在碱性条件下,重新生成(异丙醇),该反应的化学方程式为。(4)、关于上述流程中各步骤的说法,错误的是____(填标号)。A、步骤D还需要的仪器是容量瓶和胶头滴管 B、制备亚硝酸异丙酯时用冰盐浴的目的是防止反应过于剧烈 C、步骤F加入无水乙醇的目的是促进的溶解(5)、II.纯度检测——“分光光度法”:与反应灵敏,生成红色配合物,在一定波长下测量红色溶液的吸光度,利用“—吸光度”曲线确定样品溶液中的。查阅文献可知:不同浓度的5.0mL标准溶液,分别加入5.0mL(足量)溶液,摇匀后测量吸光度,可绘制标准溶液的与吸光度的关系曲线如图乙所示。

纯度检测步骤如下:
①准确称取晶体,配制100mL标准液(与文献浓度一致)。
②准确称取0.36g样品,配制成100mL溶液,取5.0mL待测溶液,向其中加入V mL(足量)标准液,摇匀后测得吸光度为0.6。
配制100mL溶液需要用到下列操作:
a.打开容量瓶玻璃塞,加入适量水,塞紧塞子,倒立
b.将塞子反转180°,倒立
c.洗涤烧杯内壁和玻璃棒2~3次
d.冷却至室温
e.轻轻振荡容量瓶
f.称取0.36g试样置于烧杯中,加入适量水充分溶解
g.将溶液转移到容量瓶中
h.定容,摇匀
上述给出操作的正确顺序:a→→h(操作可重复)。
(6)、步骤②中取用标准液V =mL,样品的质量分数为。19. 某化合物M为含有苯环(用“”表示)和三元环的羧酸,是一种重要的药物合成中间体,合成路线如下:
已知:①D→E,E→M两步均发生氧化反应
②二卤甲烷与反应可生成有机锌化合物 , 它与烯烃反应时生成环丙烷衍生物,例如:

回答下列问题:
(1)、合成过程中使用的物质 名称为。 (2)、A中一定在同一平面上的碳原子最多有个,碳原子的杂化方式有种。(3)、B中不含氧的官能团名称为。(4)、完成C→D的反应方程式。(5)、写出M的分子式。(6)、B的同分异构体中,满足下列条件的芳香族化合物(不考虑立体异构)有种。
名称为。 (2)、A中一定在同一平面上的碳原子最多有个,碳原子的杂化方式有种。(3)、B中不含氧的官能团名称为。(4)、完成C→D的反应方程式。(5)、写出M的分子式。(6)、B的同分异构体中,满足下列条件的芳香族化合物(不考虑立体异构)有种。①能发生银镜反应②只有一个环状结构③核磁共振氢谱有5组峰
(7)、根据题目所给信息,设计以乙烯为原料制备一种环醇( )的合成路线(其它无机试剂任选)。
)的合成路线(其它无机试剂任选)。