江西省赣州市2023届高三一模理综化学试题
试卷更新日期:2023-03-20 类型:高考模拟
一、单选题
-
1. 化学让世界更美好,生活中处处有化学,下列叙述错误的是A、加热能杀死流感病毒是因为蛋白质受热变性 B、泡沫灭火器可用于木质材料的起火,也适用于电器起火 C、电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法 D、绿色化学要求从源头上消除或减少生产活动对环境的污染2. 中医药是中华民族的瑰宝,我国科研人员发现中药成分黄苓素能明显抑制新冠病毒的活性。下列说法正确的是
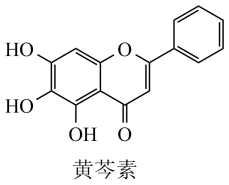 A、黄芩素的分子式为C15H12O5 B、黄芩素分子中含有五种类型的官能团 C、黄芩素分子中所有碳原子不可能共平面 D、黄芩素可发生取代反应、加成反应和氧化反应3. 工业上在催化剂的作用下CO可以合成甲醇,用计算机模拟单个CO分子合成甲醇的反应历程如图。下列说法正确的是。
A、黄芩素的分子式为C15H12O5 B、黄芩素分子中含有五种类型的官能团 C、黄芩素分子中所有碳原子不可能共平面 D、黄芩素可发生取代反应、加成反应和氧化反应3. 工业上在催化剂的作用下CO可以合成甲醇,用计算机模拟单个CO分子合成甲醇的反应历程如图。下列说法正确的是。 A、反应过程中有极性键的断裂和生成 B、反应的决速步骤为III→IV C、使用催化剂降低了反应的 D、反应的热化学方程式为4. 下列实验操作、现象和结论或解释均正确的是
A、反应过程中有极性键的断裂和生成 B、反应的决速步骤为III→IV C、使用催化剂降低了反应的 D、反应的热化学方程式为4. 下列实验操作、现象和结论或解释均正确的是选项
实验操作
现象
结论或解释
A
取5mL0.1mol/LFeCl3溶液,滴加5~6滴0.1mol/LKI溶液,充分反应后,再滴加KSCN溶液
溶液变红
FeCl3和KI的反应是可逆反应
B
将足量SO2通入Na2CO3溶液中逸出的气体通入足量的酸性KMnO4溶液,再通入澄清石灰水中
酸性KMnO4溶液颜色变浅,澄清石灰水变浑浊
Ka1(H2SO3)>Ka1(H2CO3)
C
将脱脂棉放入试管中,加入浓硫酸后搅成糊状,微热得到亮棕色溶液,加入新制Cu(OH)2悬浊液,加热
有砖红色沉淀生成
说明水解产物含有葡萄糖
D
将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中
溶液变黄色
氧化性:H2O2>Fe3+
A、A B、B C、C D、D5. 一种新型的电解质的结构如图所示(箭头指向表示共用电子对由W提供),W、X、Y、Z是同周期四种主族元素,Y原子的最外层电子数是X原子次外层电子数的3倍,下列说法错误的是 A、该物质中含离子键、极性键和非极性键 B、该物质中X原子满足8电子稳定结构 C、W的非金属性比Y的弱 D、W、X、Y、Z四种元素中,X的原子半径最大6. 我国科学家研发了一种水系可逆Zn-CO2电池,将两组阴离子、阳离子复合膜反向放置分隔两室电解液,充电、放电时,复合膜层间的H2O解离成H+和OH— , 工作原理如图所示,下列说法正确的是
A、该物质中含离子键、极性键和非极性键 B、该物质中X原子满足8电子稳定结构 C、W的非金属性比Y的弱 D、W、X、Y、Z四种元素中,X的原子半径最大6. 我国科学家研发了一种水系可逆Zn-CO2电池,将两组阴离子、阳离子复合膜反向放置分隔两室电解液,充电、放电时,复合膜层间的H2O解离成H+和OH— , 工作原理如图所示,下列说法正确的是 A、a膜是阴离子膜,b膜是阳离子膜 B、充电时Zn电极反应式为Zn+4OH--2e-= C、放电时多孔Pd纳米片附近pH升高 D、当放电时,复合膜层间有1molH2O解离时,正极区溶液增重23g7. 化学上常用AG表示溶液中的。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.100mol·L-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法错误的是
A、a膜是阴离子膜,b膜是阳离子膜 B、充电时Zn电极反应式为Zn+4OH--2e-= C、放电时多孔Pd纳米片附近pH升高 D、当放电时,复合膜层间有1molH2O解离时,正极区溶液增重23g7. 化学上常用AG表示溶液中的。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.100mol·L-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法错误的是 A、随着NaOH溶液的加入,减小 B、25℃时,HNO2的电离常数Ka的数量级为10-6 C、b点溶液中存在:2c(H+)-2c(OH-)=c()-c(HNO2) D、a、b、c、d、e五点的溶液中,水的电离程度最大的点是d
A、随着NaOH溶液的加入,减小 B、25℃时,HNO2的电离常数Ka的数量级为10-6 C、b点溶液中存在:2c(H+)-2c(OH-)=c()-c(HNO2) D、a、b、c、d、e五点的溶液中,水的电离程度最大的点是d二、非选择题
-
8. 镍及其化合物在化工生产中有广泛应用。某实验室用工业废弃的NiO催化剂(含有Fe2O3、CaO、CuO、BaO等杂质)为原料制备Ni2O3的实验流程如下:

已知:常温时Ksp(CaF2)=2.7×10-11 , Ksp(CuS)=1.0×10-36;Fe3+不能氧化Ni2+。有关氢氧化物开始沉淀的pH和完全沉淀的pH如下表所示:
氢氧化物
Fe(OH)3
Fe(OH)2
Ni(OH)2
开始沉淀的pH
1.5
6.5
7.7
完全沉淀的pH
3.7
9.7
9.2
(1)、Fe的原子结构示意图为。(2)、滤渣的主要成分为。(3)、实验室中操作A除去不溶性杂质用到的玻璃仪器有。(4)、加入H2O2的目的是;调pH的范围是。(5)、加入NaF的目的是进一步除去Ca2+ , 当c(F-)=0.001mol·L-1 , c(Ca2+)=mol·L-1.(6)、“氧化”过程中加入的试剂X可以是NaClO、K2S2O8、KMnO4等,写出加入K2S2O8反应生成NiOOH的离子方程式。9. FTO导电玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等,实验室可用无水四氯化锡(SnCl4)制作FTO,制备SnCl4的装置如图所示。
有关信息如下表:
化学式
Sn
SnCl2
SnCl4
熔点/℃
232
246
-33
沸点/℃
2260
652
114
其他性质
银白色固体金属
无色晶体,Sn2+易被Fe3+、I2等氧化为Sn4+
无色液体,易水解生成SnO2
(1)、仪器A的名称为 , 甲中发生反应的还原产物和氧化产物的物质的量之比为。(2)、将如图装置连接好,先检查装置的气密性,再慢慢滴入浓盐酸,待观察到现象后,开始加热装置丁。(3)、Cl2和Sn的反应产物可能会有SnCl4和SnCl2 , 为加快反应速率并防止产品中带入SnCl2 , 除了通入过量氯气外,应控制的最佳温度在(填序号)范围内。A.652~2260℃B.232~652℃C.114~246℃D.114~232℃(4)、若将制得的SnCl4少许溶于水中得到白色沉淀SnO2 , 其反应的化学方程式为。(5)、为测定产品中某些成分的含量,甲、乙两位同学设计了如下实验方案:①实际制备的产品往往含有SnCl2 , 甲同学设计实验测定Sn2+的含量:准确称取mg产品于锥形瓶中,用蒸馏水溶解,用amol/L酸性高锰酸钾标准溶液滴定,滴定终点时消耗酸性高锰酸钾标准溶液V1mL。由此可计算产品中Sn2+的质量分数。乙同学认为甲同学的方案明显不合理,会导致测得的Sn2+的质量分数严重偏高,理由是。
②乙同学设计实验测定产品中Cl-的含量:准确称取mg产品于锥形瓶中,用蒸馏水溶解,X溶液作指示剂,用bmol/L硝酸银标准溶液滴定,滴定终点时消耗硝酸银溶液V2mL。硝酸银溶液最好盛放在(填序号)滴定管中。
A.无色酸式滴定管B.棕色酸式滴定管C.无色碱式滴定管D.棕色碱式滴定管
参考表中的数据,X溶液最好选用的是(填序号)。
难溶物
AgCl
AgBr
AgCN
Ag2CrO4
颜色
白
浅黄
白
砖红
Ksp
1.77×10-10
5.4×10-14
2.7×10-16
1.12×10-12
A.NaCl溶液B.NaBr溶液C.NaCN溶液D.Na2CrO4溶液
10. 将CO2转化为高附加值碳基燃料,可有效减少碳的排放。在催化剂作用下CO2甲烷化的总反应为:CO2(g)+2H2(g)CH4(g)+H2O(g),ΔH总Kp总 , 该反应分两步完成,反应过程如下:
①CO2(g)+H2(g)CO(g)+H2O(g),ΔH1Kp1
②CO(g)+H2(g)CO2(g)+CH4(g),ΔH2Kp2
回答下列问题:
(1)、催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度的变化如图所示。
对比上述两种催化剂的催化性能,工业上应选择的催化剂是 , 使用的合适温度为。
(2)、在某温度下,向恒容容器中充入7molCO2和12molH2 , 初始压强为19kPa,反应经10min达到平衡,此时p(H2O)=5kPa,p(CO)=4kPa,则总反应的v(H2)=kPa·min-1。试计算该温度下反应①的Kp1(用平衡分压代替平衡浓度);在该平衡体系,若保持温度不变压缩容器的体积,CH4的物质的量(填“增加”“减小”或“不变”),反应①的平衡将(填“正向”“逆向”或“不”)移动。(3)、为研究反应过程的热效应,一定温度范围内对上述反应的平衡常数Kp进行计算,得lgKp-T的线性关系如图:
则T1温度下Kp1= , 从图像分析反应①的ΔH10(填“>”“<”或“=”)。
11. 碳元素是形成化合物最多的元素,碳及其化合物构成了丰富多彩的物质世界。回答下列问题:(1)、基态碳原子的电子占据的最高能级电子云形状为 , 与碳元素同主族的第四周期元素基态原子外围电子排布式为。(2)、是常见的含碳化合物,其构成元素电负性从大到小的顺序为 , 该分子中具有孤对电子的原子是。(3)、碳酸盐是构成岩石、土壤等的主要成分,其阴离子的立体构型为。已知碳酸镁的热分解温度(402℃)比碳酸钙(900℃)低,试解释原因。(4)、在碳酸氢盐中,存在阴离子的多聚链状结构(其结构单元如图),连接结构单元的主要作用力是氢键,请在下图中前后各链接一个结构单元:该结构中,碳原子杂化方式为。 (5)、一种碳化钨的晶体结构如图,若晶胞的高为bpm,阿伏加德罗常数值为 , 晶体的密度为 , 则晶胞底面六边形的边长为pm(列出计算式)。
(5)、一种碳化钨的晶体结构如图,若晶胞的高为bpm,阿伏加德罗常数值为 , 晶体的密度为 , 则晶胞底面六边形的边长为pm(列出计算式)。 12. 酮基布洛芬片是用于治疗各种关节炎、强直性脊柱炎引起的关节肿痛以及痛经、牙痛、术后痛和癌性痛等的非处方药。其合成路线如下图所示:
12. 酮基布洛芬片是用于治疗各种关节炎、强直性脊柱炎引起的关节肿痛以及痛经、牙痛、术后痛和癌性痛等的非处方药。其合成路线如下图所示: (1)、A的化学名称为。(2)、B中官能团的名称为 , B→C的反应类型为。(3)、写出E的结构简式:。(4)、写出B与NaOH水溶液加热时的化学反应方程式。(5)、H为C的同分异构体,则符合下列条件的H有种(同一个碳上连有两个碳碳双键的结构不稳定)。
(1)、A的化学名称为。(2)、B中官能团的名称为 , B→C的反应类型为。(3)、写出E的结构简式:。(4)、写出B与NaOH水溶液加热时的化学反应方程式。(5)、H为C的同分异构体,则符合下列条件的H有种(同一个碳上连有两个碳碳双键的结构不稳定)。①除苯环外不含其他环状结构
②含有硝基,且直接连在苯环上
其中核磁共振氢谱有四组峰,且峰面积之比为2:2:2:1的结构简式为。
(6)、以乙烷和碳酸二甲酯( )为原料(无机试剂任选),设计制备2-甲基丙酸的一种合成路线。。
)为原料(无机试剂任选),设计制备2-甲基丙酸的一种合成路线。。