湖南省邵阳市2023届高三下学期第二次联考(二模)化学试题
试卷更新日期:2023-03-20 类型:高考模拟
一、单选题
-
1. 化学与生活、生产及环境密切相关,下列说法错误的是A、“北溪”管道输送的天然气主要成分是烷烃,其中己烷占绝大多数 B、用人工合成淀粉,有利于减少农药、化肥污染和促进“碳中和” C、“自古书契多编以竹简,其用缣帛者(丝织品)谓之为纸”,文中“纸”的主要成分是蛋白质 D、我国气象探测气球可飞入3万米以上高空,气球内充有氦气,含2个中子的氦原子可表示为2. 下列化学用语或图示表达错误的是A、NaOH的电子式为
 B、HClO的结构式为H-O-Cl
C、乙醇的分子式为
D、氯离子的结构示意图为
B、HClO的结构式为H-O-Cl
C、乙醇的分子式为
D、氯离子的结构示意图为 3. 实验室制取少量 , 下列方法不能达到目的的是A、加热分解氯化铵固体 B、加热分解浓氨水 C、将浓氨水滴入到碱石灰上 D、加热氯化铵和氢氧化钙的固体混合物4. 下列有关说法正确的是A、中S原子价层电子对数为2 B、基态的核外电子排布式为 C、2−丁烯的结构简式为 D、基态氧原子核外电子轨道表达式为
3. 实验室制取少量 , 下列方法不能达到目的的是A、加热分解氯化铵固体 B、加热分解浓氨水 C、将浓氨水滴入到碱石灰上 D、加热氯化铵和氢氧化钙的固体混合物4. 下列有关说法正确的是A、中S原子价层电子对数为2 B、基态的核外电子排布式为 C、2−丁烯的结构简式为 D、基态氧原子核外电子轨道表达式为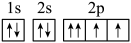 5. 短周期主族元素R、X、Y、M原子序数依次增大,Y为地壳中含量最高的元素,M与Y元素不同周期且M原子的核外未成对电子数为1,由R、X、Y、M组成的物质结构式如图所示,下列说法错误的是
5. 短周期主族元素R、X、Y、M原子序数依次增大,Y为地壳中含量最高的元素,M与Y元素不同周期且M原子的核外未成对电子数为1,由R、X、Y、M组成的物质结构式如图所示,下列说法错误的是 A、的空间结构为平面三角形 B、M的最高价氧化物对应的水化物为强酸 C、该化合物中X原子最外层均满足结构 D、Y元素所在周期中,第一电离能大于Y的元素有2种6. 下列方程式与所给事实相符的一项是A、吸收气体: B、明矾水溶液中加溶液至沉淀的质量最大时: C、溶液中通入 , 生成黄色沉淀: D、在稀硝酸中加入过量铁粉:7. 利用电化学原理,可将、转化为 , 其工作原理如图所示。下列说法正确的是
A、的空间结构为平面三角形 B、M的最高价氧化物对应的水化物为强酸 C、该化合物中X原子最外层均满足结构 D、Y元素所在周期中,第一电离能大于Y的元素有2种6. 下列方程式与所给事实相符的一项是A、吸收气体: B、明矾水溶液中加溶液至沉淀的质量最大时: C、溶液中通入 , 生成黄色沉淀: D、在稀硝酸中加入过量铁粉:7. 利用电化学原理,可将、转化为 , 其工作原理如图所示。下列说法正确的是 A、电极1的电势低于电极2 B、由左侧通过质子膜移向右侧 C、该装置工作时电能转化为化学能 D、电极1上电极反应式为8. 联氨()可用于处理水中的溶解氧,其反应机理如下图所示。
A、电极1的电势低于电极2 B、由左侧通过质子膜移向右侧 C、该装置工作时电能转化为化学能 D、电极1上电极反应式为8. 联氨()可用于处理水中的溶解氧,其反应机理如下图所示。
下列说法错误的是
A、分子的共价键只有键 B、具有还原性,在一定条件下可被氧化 C、过程②发生的是非氧化还原反应 D、③中发生反应:9. 某化学兴趣小组设计一种从硫矿石(主要成分为硫黄及少量FeS2)中提取硫黄的方法如下:
查阅资料:S的熔点为115.2℃;的沸点为46.2℃。
下列说法错误的是
A、单质硫是分子晶体 B、过程①中可用乙醇代替 C、过程③的目的是使挥发,同时使硫从水中析出 D、将趁热过滤所得滤渣煅烧: , 反应中每生成1 mol , 转移电子的物质的量为5.5 mol10. 下列实验方案不能达到探究目的的是选项
实验方案
探究目的
A
两个封有和混合气体的圆底烧瓶分别浸泡在热水和冷水中,比较两个烧瓶里气体的颜色
探究温度对化学平衡移动的影响
B
向两支盛有溶液的试管中分别加入的溶液和的溶液,比较产生气泡速率
探究、对分解速率的影响
C
向苯酚浊液中加入溶液,观察溶液变化
探究苯酚、酸性强弱
D
向盛有溶液的试管中滴加2滴的溶液,振荡,再向其中滴加4滴的溶液,观察沉淀及颜色变化
探究与的大小
A、A B、B C、C D、D11. 分子结构修饰在有机合成中有广泛的应用,我国高分子科学家对聚乙烯进行胺化修饰,并进一步制备新材料,合成路线如下图:
下列说法正确的是
A、a分子的核磁共振氢谱有4组峰 B、生成高分子b的反应为加聚反应 C、a分子中含有2个手性碳原子 D、高分子c的水溶性比聚乙烯的水溶性好12. T ℃时,在体积为2 L的恒温恒容密闭容器中充入4 mol CO和4 mol , 发生反应 , 测得和的物质的量随时间的变化如图所示。该反应的正、逆反应速率分别可表示为 , , 、分别为正、逆反应速率常数,只受温度影响。下列说法正确的是 A、从反应开始至达到平衡时,以表示的平均反应速率为 B、该反应在A、B两点的正反应速率之比为 C、当容器中混合气体的密度不随时间变化时,该反应达到平衡状态 D、T ℃时,该反应的平衡常数为13. 金刚石硬度大,熔点高,用途非常广泛。工业上利用反应人工合成金刚石。已知:氯化钠晶胞结构如图1所示,相邻的与的距离为a cm,设为阿伏加德罗常数的值,下列说法错误的是
A、从反应开始至达到平衡时,以表示的平均反应速率为 B、该反应在A、B两点的正反应速率之比为 C、当容器中混合气体的密度不随时间变化时,该反应达到平衡状态 D、T ℃时,该反应的平衡常数为13. 金刚石硬度大,熔点高,用途非常广泛。工业上利用反应人工合成金刚石。已知:氯化钠晶胞结构如图1所示,相邻的与的距离为a cm,设为阿伏加德罗常数的值,下列说法错误的是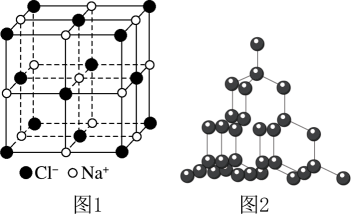 A、Ni、Co均属于元素周期表中的d区元素 B、、NaCl、金刚石三种物质的熔点依次升高 C、若NaCl晶体密度为 , 则 D、12 g金刚石(晶体结构如图2所示)中含有C-C键的数目为14. 电位滴定法是靠电极电位的突跃来指示滴定终点。在滴定过程中,计算机对数据自动采集、处理,并利用滴定反应化学计量点前后电位突变的特性,自动寻找滴定终点。室温时,用的NaOH标准溶液滴定同浓度的溶液,计算机呈现的滴定曲线如图所示(稀溶液中不考虑氨水的分解导致氨的逸出)。已知。下列说法错误的是
A、Ni、Co均属于元素周期表中的d区元素 B、、NaCl、金刚石三种物质的熔点依次升高 C、若NaCl晶体密度为 , 则 D、12 g金刚石(晶体结构如图2所示)中含有C-C键的数目为14. 电位滴定法是靠电极电位的突跃来指示滴定终点。在滴定过程中,计算机对数据自动采集、处理,并利用滴定反应化学计量点前后电位突变的特性,自动寻找滴定终点。室温时,用的NaOH标准溶液滴定同浓度的溶液,计算机呈现的滴定曲线如图所示(稀溶液中不考虑氨水的分解导致氨的逸出)。已知。下列说法错误的是 A、a点溶液中 B、b点溶液中 C、常温时,c点溶液中 D、b、d点水的电离程度:
A、a点溶液中 B、b点溶液中 C、常温时,c点溶液中 D、b、d点水的电离程度:二、非选择题
-
15. 四氯化钛( , 熔点:-25℃,沸点:136 ℃)是制备海绵钛和钛白的主要原料,其实验室制备原理是 , 某同学利用如下装置制备并验证产物CO。
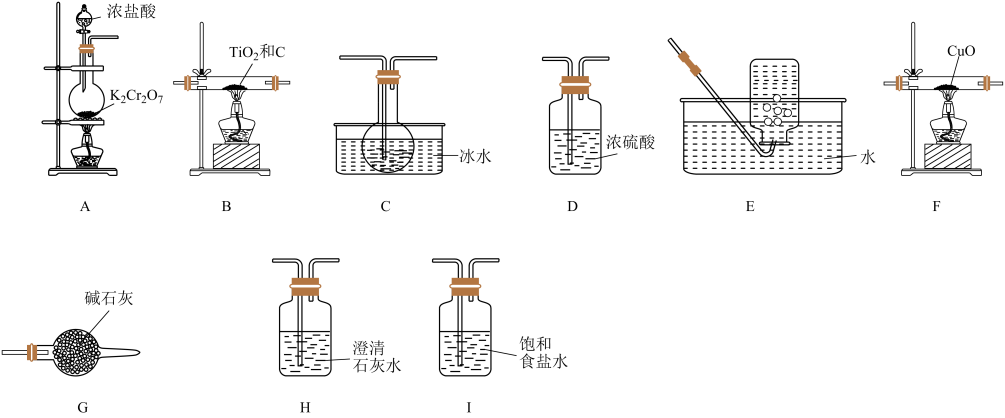
已知:遇潮湿空气会发生反应:。
回答下列问题:
(1)、写出装置A中制备的化学反应方程式(注:反应中被还原为)。(2)、按气流方向从左至右,上述装置的连接顺序为A, , G,F,H,E。(3)、装置A中盛放浓盐酸的仪器名称为 , 装置G中盛放的碱石灰的作用是。(4)、能证明有CO生成的实验现象是。(5)、产品中含量测定:取10.0 g 产品于烧瓶中,向安全漏斗(如下图所示)中加入足量蒸馏水后,立即夹紧弹簧夹,充分反应后将安全漏斗及烧瓶中混合物中液体转移到容量瓶中配成500 mL溶液,取20 mL所配溶液放入锥形瓶中,滴加几滴的溶液作指示剂,用的溶液滴定至终点,消耗溶液32.00 mL。已知:是一种深红色固体;常温下, , 。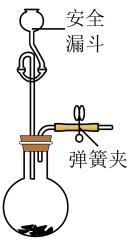
①安全漏斗中的水在本实验中的作用除加水外,还有;
②该沉淀滴定终点的判断方法是;
③该产品纯度为%。
16. 某废镍催化剂的主要成分是合金,还含有少量Cr、Fe及不溶于酸碱的有机物。采用如下工艺流程回收其中的镍,制备镍的氧化物()。
回答下列问题:
(1)、“碱浸”时发生的主要反应离子方程式为。(2)、“溶解”后的溶液中,所含金属离子有、、、、。(3)、在空气中煅烧 , 其热重曲线如图1所示,300~400 ℃时转化为 , 反应的化学方程式为;400~450℃生成的固体产物的化学式为。 (4)、工业上可用电解法制取。用NaOH溶液调节溶液pH至7.5,加入适量硫酸钠后采用惰性电极进行电解。电解过程中产生的有80%在弱碱性条件下生成 , 再把二价镍氧化为三价镍。写出氧化生成的离子方程式 , a mol二价镍全部转化为三价镍时,外电路中通过的电子的物质的量为mol(假设电解时阳极只考虑放电)。(5)、金属镍的配合物的中心原子的价电子数与配体提供的成键电子总数之和为18,则n=;CO与结构相似,CO分子内键与键个数之比为。(6)、NiO的晶胞结构如图2所示,其中离子坐标参数A为(0,0,0),C为(1, , ),则B的离子坐标参数为。
(4)、工业上可用电解法制取。用NaOH溶液调节溶液pH至7.5,加入适量硫酸钠后采用惰性电极进行电解。电解过程中产生的有80%在弱碱性条件下生成 , 再把二价镍氧化为三价镍。写出氧化生成的离子方程式 , a mol二价镍全部转化为三价镍时,外电路中通过的电子的物质的量为mol(假设电解时阳极只考虑放电)。(5)、金属镍的配合物的中心原子的价电子数与配体提供的成键电子总数之和为18,则n=;CO与结构相似,CO分子内键与键个数之比为。(6)、NiO的晶胞结构如图2所示,其中离子坐标参数A为(0,0,0),C为(1, , ),则B的离子坐标参数为。 (7)、原子中运动的电子有两种相反的自旋状态,若一种自旋状态用表示,与之相反的用表示,称为电子的自旋磁量子数。对于基态铁原子,其自旋磁量子数的代数和为。17. 如今的综合应用越来越成熟。回答下列问题:(1)、催化加氢合成涉及如下反应:
(7)、原子中运动的电子有两种相反的自旋状态,若一种自旋状态用表示,与之相反的用表示,称为电子的自旋磁量子数。对于基态铁原子,其自旋磁量子数的代数和为。17. 如今的综合应用越来越成熟。回答下列问题:(1)、催化加氢合成涉及如下反应:反应Ⅰ: ;
反应Ⅱ: ;
反应Ⅲ: 。
则反应Ⅰ的 , 该反应在(填“高温”“低温”或“任意温度”)下能自发进行。
(2)、和都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图1所示:若生成的乙烯和乙烷的物质的量之比为1∶1,写出阳极的电极反应式:;当消耗和的物质的量之比为10∶9时,则乙烯和乙烷的体积(相同条件下)比为。 (3)、与可合成 , 涉及的主要反应如下:
(3)、与可合成 , 涉及的主要反应如下:反应1:
反应2:
起始按投料,测得的平衡转化率()和的选择性()随温度、压强的变化如图2所示:

[已知]
①(填“>”或“<”);
②温度高于350 ℃后,压强和下,的平衡转化率几乎交于一点的原因是;
③250 ℃、压强下,用各物质的平衡分压代替物质的量浓度表示反应2的平衡常数(结果保留2位有效数字)。
18. 一种治疗糖尿病药物的合成路线如下(部分反应条件已省略)。
回答下列问题:
(1)、有机物I中含氧官能团的名称为、。(2)、反应③、反应⑤的反应类型分别是、。(3)、反应②的化学方程式为。(4)、H是一种氨基酸,其结构简式为 , 其本身发生聚合反应,所得高分子化合物的结构简式为。(5)、符合下列条件的E的同分异构体有种,其中核磁共振氢谱有5组峰,且峰面积之比为6∶2∶2∶1∶1的结构简式为。①属于芳香族化合物且苯环上有3个取代基;
②既可发生银镜反应,又可发生水解反应。
(6)、设计以甲醛、甲苯为起始原料制备 的合成路线:(无机试剂任用)。
的合成路线:(无机试剂任用)。