河北省石家庄市2023届高中毕业年级教学质量检测(一)化学试题
试卷更新日期:2023-03-20 类型:高考模拟
一、单选题
-
1. 兔年春晚《满庭芳·国色》以中国传统色为切入点,使得桃红、凝脂、群青等有着优美名字的“中国色”扑而而来。其中“桃红”可从红花、铅丹、朱砂或赫石等原料中提取。下列说法错误的是A、提取红花中的有效成分红花素时,可使用萃取操作 B、铅丹中价与价的个数比为 C、以朱砂(主要成分为)为原料提取的“桃红”不宜用于制作化妆品 D、赭石(主要成分为)可用于制作磁性物质2. 材料在生产、生活中发挥着重要作用,下列说法正确的是A、聚氯乙烯可用作不粘锅的耐热涂层材料 B、硬铝密度小、强度高,可用于制造飞机外壳 C、硅是良好的半导体材料,可用于制作光导纤维 D、纺织行业常用的棉花、麻、蚕丝等材料均属于碳水化合物3. 设为阿伏加德罗常数的值,下列说法正确的是A、25℃时,的溶液中含有的数目为 B、白磷和硅晶体中含有共价键的数目均为 C、(标准状况)通入水中充分反应,转移电子的数目为 D、和混合后的分子数目为4. 下列离子方程式正确的是A、硅酸钠溶液中通入: B、向烧碱溶液中加入一小段铝片: C、溴与冷的溶液反应: D、过量铁粉加入稀硝酸中:5. 下列说法错误的是A、基态铬原子的电子排布式为 B、晶体中存在配位键 C、所有元素中,氟的第一电离能最大 D、光气分子中,所有原子均满足8电子稳定结构6. 下列选项中,陈述Ⅰ、Ⅱ的化学原理相同的是
陈述Ⅰ
陈述Ⅱ
A
不能用浓硫酸干燥NH3
不能用浓硫酸干燥H2S
B
高温时用Na与TiCl4反应制Ti
高温时用Na与KCl反应制K
C
用FeS处理含Cu2+的废水
用含氟牙膏预防龋齿
D
向NaHCO3溶液中滴加AlCl3溶液,产生白色沉淀
向NaHCO3溶液中滴加CaCl2溶液,产生白色沉淀
A、A B、B C、C D、D7. 4-溴甲基肉桂酸甲酯是合成抗肿瘤药物帕比司他的重要中间体,其结构简式如下:
关于4-溴甲基肉桂酸甲酯的说法正确的是
A、最多有18个原子共平面 B、不能发生消去反应 C、与 互为顺反异构体
D、最多可消耗
8. 下列装置能达到相应实验目的的是
互为顺反异构体
D、最多可消耗
8. 下列装置能达到相应实验目的的是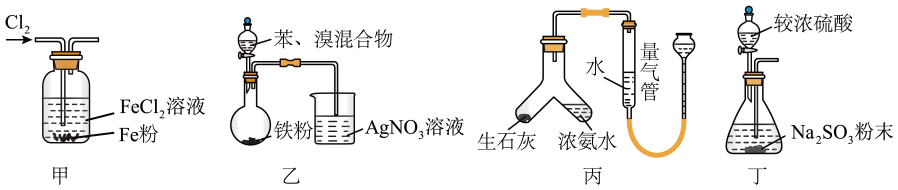 A、利用甲装置可使粉最终消失得到澄清溶液 B、利用乙装置可制备溴苯并验证有生成 C、利用丙装置可制备并测量其体积 D、利用丁装置可制备9. 电化学合成具有反应条件温和、反应试剂纯净和生产效率高等优点,利用下图所示装置可合成己二腈。充电时生成己二睛,放电时生成 , 其中a、b是互为反置的双极膜,双极膜中的会解离出和向两极移动。下列说法正确的是
A、利用甲装置可使粉最终消失得到澄清溶液 B、利用乙装置可制备溴苯并验证有生成 C、利用丙装置可制备并测量其体积 D、利用丁装置可制备9. 电化学合成具有反应条件温和、反应试剂纯净和生产效率高等优点,利用下图所示装置可合成己二腈。充电时生成己二睛,放电时生成 , 其中a、b是互为反置的双极膜,双极膜中的会解离出和向两极移动。下列说法正确的是 A、N极的电势高于M极的电势 B、放电时,双极膜中向M极移动 C、充电时,阴极的电极反应式为 D、若充电时制得 , 则放电时需生成 , 才能使左室溶液恢复至初始状态10. 某碳-碳成键反应的催化剂由R3+和结构如图所示的阴离子组成,X、Y、Z、Q为原子序数依次增大的短周期主族元素,R3+与Ar具有相同的核外电子排布。下列说法正确的是
A、N极的电势高于M极的电势 B、放电时,双极膜中向M极移动 C、充电时,阴极的电极反应式为 D、若充电时制得 , 则放电时需生成 , 才能使左室溶液恢复至初始状态10. 某碳-碳成键反应的催化剂由R3+和结构如图所示的阴离子组成,X、Y、Z、Q为原子序数依次增大的短周期主族元素,R3+与Ar具有相同的核外电子排布。下列说法正确的是 A、R位于第四周期ⅢA族 B、X、Y、Z的简单氢化物的沸点依次升高 C、XQ2和QY2的空间结构相同 D、基团-XZ3与碘原子形成的化合物可水解为XZ3H和HIO11. 向起始温度相同、体积相等的甲、乙两个恒容密闭容器中分别充入和发生反应: , ;其中一个为绝热容器,另一个为恒温容器。若测得两容器中除0时刻外,任意时刻的正反应速率始终满足 , 则下列说法错误的是A、甲为绝热容器 B、的平衡转化率:甲>乙 C、除0时刻外,任意时刻的压强始终满足 D、该反应正反应的活化能小于逆反应的活化能12. 下列实验操作和现象所得到的结论正确的是
A、R位于第四周期ⅢA族 B、X、Y、Z的简单氢化物的沸点依次升高 C、XQ2和QY2的空间结构相同 D、基团-XZ3与碘原子形成的化合物可水解为XZ3H和HIO11. 向起始温度相同、体积相等的甲、乙两个恒容密闭容器中分别充入和发生反应: , ;其中一个为绝热容器,另一个为恒温容器。若测得两容器中除0时刻外,任意时刻的正反应速率始终满足 , 则下列说法错误的是A、甲为绝热容器 B、的平衡转化率:甲>乙 C、除0时刻外,任意时刻的压强始终满足 D、该反应正反应的活化能小于逆反应的活化能12. 下列实验操作和现象所得到的结论正确的是选项
实验操作和现象
结论
A
向淀粉溶液中加入适量20%溶液,加热,冷却后加溶液至中性,再滴加少量碘水,溶液变蓝
淀粉未水解
B
将盐酸酸化的溶液加水稀释,溶液的颜色由黄绿色变为绿色,最终变为蓝色
溶液中浓度减小,浓度增大
C
将铁锈溶于浓盐酸,滴入溶液,紫色褪去
铁锈中含有二价铁
D
向溶液中滴加溶液,变红褐色;再滴加溶液,产生蓝色沉淀
既发生了水解反应,又发生了还原反应
A、A B、B C、C D、D13. 利用如下流程可从废光盘的金属层中回收其中的银(金属层中其他金属含量过低,对实验影响可忽略):
已知:溶液在加热时易分解产生和;“溶解”工序发生的反应为可逆反应。下列说法错误的是
A、“氧化”时,适宜选择水浴加热方式 B、若省略第一次过滤,会使氨水的用量增加 C、滤渣Ⅱ洗涤后的滤液可送入“还原”工序利用 D、“还原”时,每生成 , 理论上消耗14. 25℃时,已知的氨水中存在如下平衡:① ,
② ,
③ ,
下列说法正确的是
A、反应①和②互为可逆反应 B、该氨水中存在 C、若该氨水中 , 则 D、向该氨水中加入硫酸,当时,溶液呈中性二、非选择题
-
15. 苯甲酸乙酯可用于配制香水香精和人造精油,也可用于食品中。某实验小组以苯甲酸和乙醇为原料,利用如图装置合成苯甲酸乙酯,步骤如下:

Ⅰ.反应回流:向圆底烧瓶中加入磁搅拌子,然后依次加入苯甲酸、95%乙醇、环己烷,搅拌均匀后再加入浓硫酸。按如图组装好仪器后,水浴加热回流1.5小时。实验过程中分水器中得到的液体会分层,需多次开启分水器活塞放出下层液体。
Ⅱ.产物蒸馏提纯:继续水浴加热,从圆底烧瓶中蒸出环己烷和剩余的乙醇,经分水器放出。将圆底烧瓶中残留物倒入盛有冷水的烧杯中,再经一系列除杂操作后,最后蒸馏收集210~213℃的馏分,得到产品。
可能用到的数据如下:
相对分子质量
密度
沸点/℃
水中溶解性
苯甲酸
122
1.266
249
微溶
乙醇
46
0.789
78
溶
苯甲酸乙酯
150
1.045
213
难溶
环己烷
84
0.779
80.8*
难溶
*环己烷、乙醇和水可形成共沸物,其沸点为62.1℃。
回答下列问题:
(1)、若用标记乙醇,则所得产品苯甲酸乙酯的结构简式为。(2)、如果步骤Ⅰ中加热一段时间后发现忘记加入磁搅拌子,应采取的正确操作为。(3)、步骤Ⅰ中“多次开启分水器活塞放出下层液体”的目的为。(4)、步骤Ⅱ中“一系列除杂操作”用到的试剂包括a.无水氯化钙b.碳酸钠c.食盐。按照操作先后顺序,应依次加入(填试剂的字母编号)。操作过程中,当观察到现象时,即可停止加入碳酸钠;加入食盐的目的为。(5)、步骤Ⅱ中蒸馏收集产物时,所需用到的玻璃仪器有酒精灯、蒸馏烧瓶、尾接管、接收瓶和(填仪器名称)。(6)、本实验的产率为%(保留两位有效数字)。(7)、下列仪器不能为产品结构分析提供有效信息的是(填选项字母)。A元素分析仪 B.质谱仪 C.红外光谱仪 D.核磁共振仪 E.X射线衍射仪
16. 湿法炼锌综合回收系统产出的萃余液中含有Na2SO4、ZnSO4、H2SO4 , 还含有Mn2+、Co2+、Ni2+、Cd2+、Fe2+、Al3+等,一种将萃余液中有价离子分步分离、富集回收的工艺流程如下:
回答下列问题:
(1)、“氧化”时,Mn2+、Fe2+均发生反应。后者发生反应时,氧化剂与还原剂的物质的量之比为。(2)、“调pH”时,所得“滤渣1”中除含有MnO2和Fe(OH)3外,还有。(3)、“除镉”时,发生反应的类型为。(4)、“除钴镍”时,有机净化剂的基本组分为大分子立体网格结构的聚合物。其净化原理可表示为:
反应时,接受电子对的一方是;Co2+、Ni2+能发生上述转化而Zn2+不能,推测可能的原因为。
(5)、“沉锌”时有气体生成,则生成碱式碳酸锌的离子方程式为。(6)、“沉锌”时,所得滤液经硫酸酸化后,用惰性电极电解可制备Na2S2O8 , 从而实现原料的循环利用,该电解过程中总反应的化学方程式为。(7)、氧化锌有多种晶体结构,其中一种晶胞结构及晶胞参数如图所示。已知阿伏加德罗常数的值为NA , 则该氧化锌晶体的密度为 g∙cm-3 (列出计算式即可)。 17. 二甲醚是重要的有机合成原料:工业上常用合成气(主要成分为、)制备二甲醚,其主要反应如下:
17. 二甲醚是重要的有机合成原料:工业上常用合成气(主要成分为、)制备二甲醚,其主要反应如下:反应ⅰ: ,
反应ⅱ: ,
反应ⅲ: ,
(1)、已知时,由稳定态单质生成化合物的焓变称为该物质的标准摩尔生成焓。几种物质的标准摩尔生成焓如下表所示,据此计算。物质
0.0
(2)、已知 , 随温度变化的三种趋势如下图中线条所示。能用来表示反应ⅰ的线条是(填线条字母)。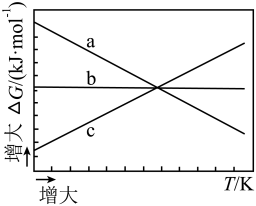 (3)、在催化剂的作用下发生反应ⅰ,其可能反应机理如下图所示。
(3)、在催化剂的作用下发生反应ⅰ,其可能反应机理如下图所示。
①根据元素电负性的变化规律,图中反应步骤Ⅲ可描述为。
②在合成甲醇过程中,需要不断分离出甲醇的原因为(填选项字母)。
a.有利于平衡正向移动b.防止催化剂中毒c.提高正反应速率
(4)、一定温度下,在体积为的刚性容器中充入和制备二甲醚,时达到平衡,平衡时的转化率为80%, , 且。①内,。
②反应ⅲ的平衡常数(保留三位有效数字)。
(5)、实际工业生产中,需要在260℃、压强恒为的反应釜中进行上述反应。初始时向反应釜中加入和 , 为确保反应的连续性,需向反应釜中以、进气流量持续通入原料,同时控制出气流量。①需控制出气流量小于进气流量的原因为。
②已知出气流量为 , 单位时间内的转化率为60%,则流出气体中的百分含量为。
18. 布洛芬(N)是一种家中常备退烧药,转位重排法是合成布洛芬的主要方法,其合成路线见下图所示。
已知:①

②

回答下列问题:
(1)、F的名称为 , 其易溶于水的原因为。(2)、A→B的反应类型为 , M中含有的官能团名称为。(3)、E+F→G的化学方程式为。(4)、手性分子在生命科学和药物生产方面有广泛应用。对于手性药物,一个异构体可能有效,另一个异构体可能无效甚至有害。布洛芬分子(N)中存在的手性碳原子个数为个。(5)、苯环上的一氯取代物有两种的D的同分异构体有种(不含立体异构),写出其中核磁共振氢谱显示四组峰,且峰面积之比为的结构简式。(6)、对甲基苯丙酮( )为常用化工原料。结合上述流程,以甲苯和丙烯为原料制备对甲基苯丙酮的合成路线为(无机试剂任选)。
)为常用化工原料。结合上述流程,以甲苯和丙烯为原料制备对甲基苯丙酮的合成路线为(无机试剂任选)。