广西来宾市2023届高三下学期第二次联合调研考试理综化学试题
试卷更新日期:2023-03-20 类型:高考模拟
一、单选题
-
1. 化学与生产、生活息息相关,下列说法正确的是A、75%的乙醇与84消毒液的消毒原理相同 B、钢铁在潮湿的空气中生锈主要发生电化学腐蚀 C、石油的分馏、裂化和煤的干馏都是化学变化 D、2022 年北京冬奥会比赛雪橇所使用的碳纤维材料属于有机高分子材料2. 设NA为阿伏加德罗常数的值,下列说法正确的是A、1mol苯分子中含碳碳双键的数目为3NA B、14gCO和N2的混合物中含有的质子数为7NA C、标准状况下,22.4L CHCl3分子中所含Cl原子数为3NA D、0.1mol H2和0.1mol I2于密闭容器中充分反应,转移的电子总数为0.2NA3. 2022 年卡塔尔世界杯期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结构如图,下列关于该分子说法正确的是
 A、S-诱抗素的分子式为C13H18O5 B、S-诱抗素分子中含有5种官能团 C、1mol S-诱抗素最多能与1mol NaOH反应 D、S-诱抗素在一定条件下能发生缩聚反应和氧化反应4. 甲~丁均为短周期主族元素,在元素周期表中的相对位置如图所示。丁的最高价氧化物对应的水化物在同周期中酸性最强,下列说法正确的是
A、S-诱抗素的分子式为C13H18O5 B、S-诱抗素分子中含有5种官能团 C、1mol S-诱抗素最多能与1mol NaOH反应 D、S-诱抗素在一定条件下能发生缩聚反应和氧化反应4. 甲~丁均为短周期主族元素,在元素周期表中的相对位置如图所示。丁的最高价氧化物对应的水化物在同周期中酸性最强,下列说法正确的是甲
乙
丙
丁
A、非金属性:丁>丙>甲 B、原子半径:甲>乙>丙 C、最简单氢化物的沸点:乙>甲 D、丙与乙形成的二元化合物易溶于水和强碱溶液5. 下列与实验相关的叙述正确的是A、除去乙酸乙酯中的少量乙酸,可加入饱和碳酸钠溶液洗涤分液 B、在陶瓷坩埚中加强热,可除去碳酸钠晶体中的结晶水 C、实验室制取氢氧化铁胶体时,为了使胶体均匀应不断搅拌 D、用洁净的铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有Na+ , 无K+6. 一种NO-空气燃料电池的工作原理如图所示,该电池工作时,下列说法正确的是 A、电子的流动方向:负极→电解质溶液→正极 B、H+通过质子交换膜向左侧多孔石墨棒移动 C、若产生1molHNO3 , 则通入O2的体积应大于16.8L D、放电过程中负极的电极反应式为NO-3e-+2H2O=+4H+7. 常温下,向10mL0.10mol/LCuCl2溶液中滴加0.10mol/LNa2S溶液,滴加过程中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,已知Ksp(ZnS)>Ksp(CuS)。下列说法错误的是
A、电子的流动方向:负极→电解质溶液→正极 B、H+通过质子交换膜向左侧多孔石墨棒移动 C、若产生1molHNO3 , 则通入O2的体积应大于16.8L D、放电过程中负极的电极反应式为NO-3e-+2H2O=+4H+7. 常温下,向10mL0.10mol/LCuCl2溶液中滴加0.10mol/LNa2S溶液,滴加过程中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,已知Ksp(ZnS)>Ksp(CuS)。下列说法错误的是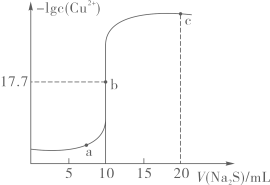 A、a、b两点CuS的溶度积Ksp相等 B、常温下,CuS的溶度积Ksp的数量级为10-36 C、c点溶液中:c(Cl-)>c(Na+)>c(S2-)>c(OH-)>c(H+) D、闪锌矿(ZnS)遇到硫酸铜溶液可转变为铜蓝(CuS)
A、a、b两点CuS的溶度积Ksp相等 B、常温下,CuS的溶度积Ksp的数量级为10-36 C、c点溶液中:c(Cl-)>c(Na+)>c(S2-)>c(OH-)>c(H+) D、闪锌矿(ZnS)遇到硫酸铜溶液可转变为铜蓝(CuS)二、非选择题
-
8. 二氧化氯(ClO2)是一种高效消毒剂,易溶于水,沸点为11.0℃,浓度高时极易爆炸。某研究小组在实验室按如图所示的装置,用干燥的氯气与固体亚氯酸钠制备二氧化氯,请回答下列问题:
 (1)、B装置使用的试液X为 , 其作用是。(2)、仪器a的名称为 , 装置E的作用是。(3)、装置D中冰水的主要作用是 , 往D中通入氯气的同时还通入干燥的空气,其主要目的是。(4)、装置D内发生反应的化学方程式为。(5)、已知NaClO2饱和溶液在不同温度时析出的晶体情况如下表:
(1)、B装置使用的试液X为 , 其作用是。(2)、仪器a的名称为 , 装置E的作用是。(3)、装置D中冰水的主要作用是 , 往D中通入氯气的同时还通入干燥的空气,其主要目的是。(4)、装置D内发生反应的化学方程式为。(5)、已知NaClO2饱和溶液在不同温度时析出的晶体情况如下表:温度
<38℃
38℃~60℃
>60℃
析出晶体
NaClO2·3H2O
NaClO2
分解成NaClO3和NaCl
利用NaClO2溶液制NaClO2晶体的过程中,需使用38℃~60℃的温水洗涤。控制水温在“38℃~60℃”之间的原因是。
(6)、工业上可在酸性条件下用双氧水与NaClO3反应制备ClO2 , 该反应的离子方程式为。9. 某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物和少量其它不溶性物质。现采用以下工艺流程制备硫酸镍晶体(NiSO4·7H2O):
室温下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子
Ni2+
Al3+
Fe3+
Fe2+
开始沉淀时(c=0.01mol·L-1)的pH
7.2
3.7
2.2
7.5
沉淀完全时(c=1.0×10-5mol·L-1)的pH
8.7
4.7
3.2
9.0
回答下列问题:
(1)、“碱浸”中NaOH溶液除了溶解铝及其氧化物之外,还起到的作用是。(2)、“滤液②”中除含有Fe2+外,还可能含的金属离子有(填离子符号)。(3)、结合流程分析,“转化”中选用H2O2的主要优点是。滤渣③的化学式是。(4)、反应结束后,将滤液③控制pH,经蒸发浓缩、、、洗涤、干燥后可得到硫酸镍晶体。(5)、硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式。(6)、利用上述表格数据,计算室温下Ni(OH)2的Ksp=。若“转化”后的溶液中Ni2+浓度为0.1mol·L-1 , 则“调pH”应控制的pH范围是。10. 我国力争实现2030年前碳达峰、2060年前碳中和的目标,研究碳的化合物对减少CO2在大气中累积及实现可再生能源的有效利用具有重要意义。(1)、已知CO2和H2在一定条件下能发生反应 , 反应物与生成物的能量与活化能的关系如图所示,该反应的ΔH=kJ/mol(用含Ea1和Ea2的代数式表示)。 (2)、恒温恒容条件下,为了提高反应中CO2的平衡转化率,可采取的措施为(任写一项)。下列不能说明该反应达到平衡状态的是(填字母)。
(2)、恒温恒容条件下,为了提高反应中CO2的平衡转化率,可采取的措施为(任写一项)。下列不能说明该反应达到平衡状态的是(填字母)。A.v(CO2)正=v(H2)逆
B.HCOOH的体积分数不再变化
C.混合气体的密度不再变化
D.c(CO2):c(H2):c(HCOOH)=1:1:1
(3)、一定温度下,在一刚性密闭容器中,充入等物质的量的CO2和H2此时容器的压强为48kPa,发生反应 , 6min时达到平衡,此时容器压强为36kPa,则0~6min内用H2分压表示的化学反应速率为kPa/min。相同温度下,该反应的逆反应平衡常数Kp=kPa(Kp是平衡分压代替平衡浓度计算的平衡常数)。(4)、除合成甲酸(HCOOH)外,有科学家以CO2、H2为原料合成CH3OH达到有效降低空气中二氧化碳含量的目的,其中涉及的主要反应如下:I.CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-49.5kJ·mol-1
II.CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=+41.5kJ·mol-1
不同条件下,按照n(CO2):n(H2)=1:3投料,CO2的平衡转化率如图所示:

压强p1、P2、P3由小到大的顺序是。压强为P1时,温度高于300℃后,CO2的平衡转化率随温度升高而升高的原因是。
(5)、近年来,有研究人员用CO2通过电催化生成多种燃料,实现CO2的回收利用,其工作原理如图所示:
请写出Cu电极上产生HCOOH的电极反应式。
11. 在科研和工农业生产中,碳、氮、砷(As)、铜等元素形成的单质及其化合物有着广泛的应用。回答下列问题:(1)、As和N同族,基态砷原子的价电子排布式为。(2)、基态Cu原子的核外电子有种运动状态,未成对电子占据的原子轨道形状为。(3)、中C原子的杂化轨道类型为 , 其空间构型为。(4)、CuO在高温时分解为O2和Cu2O,请结合阳离子的结构分析,高温时Cu2O比CuO更稳定的原因。(5)、向盛有CuSO4溶液的试管中滴加少量氨水,产生蓝色沉淀,继续滴加氨水至过量得到深蓝色溶液。经测定,溶液呈深蓝色是因为存在[Cu(NH3)4]SO4 , 1mol[Cu(NH3)4]2+含σ键的数目为。(6)、金属晶体铜的晶胞如图所示,其堆积方式是 , 铜晶胞的密度为ρg∙cm−3 , NA为阿伏加德罗常数的值,则铜晶胞的边长为pm(用含ρ、NA的式子表示,写出计算式即可)。 12. 化合物G是一种药物合成中间体,其合成路线如下:
12. 化合物G是一种药物合成中间体,其合成路线如下:
回答下列问题:
(1)、C中官能团名称是。(2)、①的反应类型为。(3)、D的结构简式为。(4)、反应④所需的条件为。(5)、写出由B生成C反应的化学方程式。(6)、与B互为同分异构体,且具有六元环结构、并能发生银镜反应的有机物有种(不考虑立体异构),其中有6种不同化学环境氢原子的同分异构体的结构简式为。(7)、参照上述合成路线,设计用苯甲醛( )和丙酮(
)和丙酮(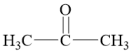 )合成重要的有机合成中间体
)合成重要的有机合成中间体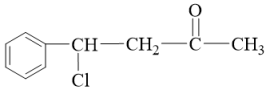 的途径如下:
的途径如下: →中间体1→中间体2→
→中间体1→中间体2→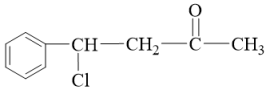 。则中间体1和中间体2的结构简式分别为、。
。则中间体1和中间体2的结构简式分别为、。