甘肃省兰州市2023届高三诊断考试理综化学试题
试卷更新日期:2023-03-20 类型:高考模拟
一、单选题
-
1. 2022年6月17日,中国第三艘航空母舰一 “福建舰”正式下水,它是目前世界上最大的常规动力航母,配置了先进的电磁弹射和阻拦装置。下列说法正确的是A、用于雷达系统的氮化镓属于金属材料 B、舰体材料低磁合金钢的熔点和强度均高于纯铁 C、航母燃料重油的主要成分为烃 D、防腐涂料中使用的石墨烯与乙烯互为同系物2. 阿比多尔为抗病毒药,用于治疗流感病毒引起的上呼吸道感染。如图所示的是合成阿比多尔的中间体的结构。下列关于该物质说法错误的是
 A、分子式为C13H15NO3 B、分子中所有碳原子可能共平面 C、该物质能发生加成、水解反应,也能被酸性高锰酸钾溶液氧化 D、该物质中苯环上羟基邻位连接-C4H9的同分异构体共有8种3. 某固体样品可能含有NaNO3、NaHCO3、Na2SO3和Na2SO4。取少量样品进行如下实验:步骤①:将样品溶于水,得到澄清溶液;步骤②:向①的溶液中滴加过量稀盐酸,有气泡产生;步骤③:取②的上层清液,向其中滴加BaCl2溶液,有沉淀生成。下列说法中正确的是A、该固体样品中一定含有Na2SO4 B、该固体样品中一定含有NaHCO3 C、该固体样品不可能只含有Na2SO3 D、步骤②的试管口产生的气体一定是无色的4. 2022年9月9日,中国科学家首次在月球上发现的新矿物被命名为“嫦娥石”。该矿物除了含钙、铁(26Fe)、钇(39Y)三种长周期元素外,还含有X、R、Z、W四种原子序数依次增大的短周期主族元素。X、R、Z、W质子数之和为46,X、 R、Z最外层电子数分别为x、y、z,x+y+z=9, x=2(y+z)。下列叙述正确的是A、铁(26Fe)位于第四周期VIIIB族 B、简单离子半径: X>R>Z C、W的简单氢化物热稳定性比X的简单氢化物强 D、X与R形成的化合物为离子化合物且只含有离子键5. H2O2作为绿色氧化剂应用广泛。氢醌法制备H2O2的原理为:H2+O2H2O2 , 装置如图所示。
A、分子式为C13H15NO3 B、分子中所有碳原子可能共平面 C、该物质能发生加成、水解反应,也能被酸性高锰酸钾溶液氧化 D、该物质中苯环上羟基邻位连接-C4H9的同分异构体共有8种3. 某固体样品可能含有NaNO3、NaHCO3、Na2SO3和Na2SO4。取少量样品进行如下实验:步骤①:将样品溶于水,得到澄清溶液;步骤②:向①的溶液中滴加过量稀盐酸,有气泡产生;步骤③:取②的上层清液,向其中滴加BaCl2溶液,有沉淀生成。下列说法中正确的是A、该固体样品中一定含有Na2SO4 B、该固体样品中一定含有NaHCO3 C、该固体样品不可能只含有Na2SO3 D、步骤②的试管口产生的气体一定是无色的4. 2022年9月9日,中国科学家首次在月球上发现的新矿物被命名为“嫦娥石”。该矿物除了含钙、铁(26Fe)、钇(39Y)三种长周期元素外,还含有X、R、Z、W四种原子序数依次增大的短周期主族元素。X、R、Z、W质子数之和为46,X、 R、Z最外层电子数分别为x、y、z,x+y+z=9, x=2(y+z)。下列叙述正确的是A、铁(26Fe)位于第四周期VIIIB族 B、简单离子半径: X>R>Z C、W的简单氢化物热稳定性比X的简单氢化物强 D、X与R形成的化合物为离子化合物且只含有离子键5. H2O2作为绿色氧化剂应用广泛。氢醌法制备H2O2的原理为:H2+O2H2O2 , 装置如图所示。
已知:①H2O、卤化氢等杂质易使Ni催化剂中毒;②催化剂乙基蒽醌难溶于水,易溶于有机溶剂,熔点107-111℃。下列说法中正确的是
A、装置B可选择①或② B、装好试剂后的操作为:打开活塞a、d,关闭活塞b、c C、提纯产品的操作依次为过滤,加水萃取,分液,常压蒸馏 D、若没有F装置三颈烧瓶中的反应速率会减慢6. 科技工作者将废旧锂离子电池中的LiCoO2 (s)作为正极材料通过下列装置转化为Co2+ , 进而回收金属钴。已知:电极材料均为石墨材质,工作时需要保持厌氧、细菌所在环境pH稳定,借助细菌降解乙酸盐生成CO2。下列说法错误的是 A、甲室中的石墨电极为阴极,将Co2+转化为金属钴 B、乙室的电极反应式为: LiCoO2+4H++e- =Li++Co2+ + 2H2O C、装置工作时,甲室溶液pH逐渐减小 D、电路中通过8 mol电子的过程中,乙酸盐溶液所在的电极室内质量均减小88 g7. K2Cr2O7溶液中存在多个平衡。在考虑平衡:① (aq) +H2O(l)2(aq) K1=3.0× 10-2(25℃);②(aq)(aq) +H+(aq) K2=3.3× 10-7(25℃)的条件下,25℃时,向0.10 mol/L K2Cr2O7溶液中加入NaOH,溶液中 , 随pH的变化关系如图所示,溶液体积变化可忽略。下列说法中正确的是
A、甲室中的石墨电极为阴极,将Co2+转化为金属钴 B、乙室的电极反应式为: LiCoO2+4H++e- =Li++Co2+ + 2H2O C、装置工作时,甲室溶液pH逐渐减小 D、电路中通过8 mol电子的过程中,乙酸盐溶液所在的电极室内质量均减小88 g7. K2Cr2O7溶液中存在多个平衡。在考虑平衡:① (aq) +H2O(l)2(aq) K1=3.0× 10-2(25℃);②(aq)(aq) +H+(aq) K2=3.3× 10-7(25℃)的条件下,25℃时,向0.10 mol/L K2Cr2O7溶液中加入NaOH,溶液中 , 随pH的变化关系如图所示,溶液体积变化可忽略。下列说法中正确的是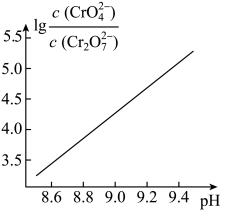 A、已知Ka1(H2SO3) = 1.29× 10-2 , 由②可知向K2CrO4溶液中通SO2可制得KHCrO4 B、的值随溶液 pH的增大逐渐减小 C、当溶液pH=9时,溶液中的平衡浓度约为6 × 10-4mol/L D、当溶液pH=7时,c(K+) =c ( ) +c( ) +2c ()
A、已知Ka1(H2SO3) = 1.29× 10-2 , 由②可知向K2CrO4溶液中通SO2可制得KHCrO4 B、的值随溶液 pH的增大逐渐减小 C、当溶液pH=9时,溶液中的平衡浓度约为6 × 10-4mol/L D、当溶液pH=7时,c(K+) =c ( ) +c( ) +2c ()二、非选择题
-
8. 碳酸锶( SrCO3)主要用于制造磁性材料、电子元件等。利用锶渣(主要成分SrSO4 , 含少量CaCO3、Fe2O3、 Al2O3、MgCO3杂质),工业上制备超细碳酸锶的工艺如图所示:

已知:①25℃时溶液中金属离子物质的量浓度c与溶液pH的关系如图所示:

②Sr (OH)2、 Ca (OH) 2在不同温度下的溶解度表
温度/℃
0
20
40
60
80
90
100
Ca(OH)2/g
0.19
0.17
0.14
0.12
0.09
0.08
0.07
Sr(OH)2/g
0.91
1.77
3.95
8.42
20.20
44.50
91.20
回答下列问题:
(1)、“高温煅烧”得到的主要产物为锶的硫化物和一种可燃性气体。 则“高温煅烧”的主要反应化学方程式为。(2)、气体2的主要成分为(填化学式)。(3)、不设置步骤1的后果是。(4)、“除铁铝” 后溶液温度降至室温(25℃) ,溶液中c(Fe3+) 为mol/L。(5)、“除镁钙”过程温度控制在95℃~100℃的目的是。(6)、“沉锶” 的离子反应方程式为。(7)、“沉锶”过程中反应温度对锶转化率的影 响如图所示,温度高于60℃时,锶转化率降低的原因为。 (8)、从平衡移动的角度分析“沉锶”过程中控制pH≥10的原因。9. 四水甲酸铜[Cu ( HCOO)2·4H2O]是一种重要的化工原料, 为蓝色晶体,易溶于水,难溶于醇及大多数有机物。实验室可以用碱式碳酸铜[Cu (OH)2 ·CuCO3]与甲酸反应来制备。
(8)、从平衡移动的角度分析“沉锶”过程中控制pH≥10的原因。9. 四水甲酸铜[Cu ( HCOO)2·4H2O]是一种重要的化工原料, 为蓝色晶体,易溶于水,难溶于醇及大多数有机物。实验室可以用碱式碳酸铜[Cu (OH)2 ·CuCO3]与甲酸反应来制备。已知:①碱式碳酸铜的组成与溶液pH有关;
②碱式碳酸铜和碳酸氢钠在水溶液中比固态时更易分解。
实验室制备四水甲酸铜的步骤如下:
I.称取12.5 g CuSO4·5H2O和9.5 g NaHCO3 , 充分研细并混合均匀。
II.将I中所得混合物加入到100 mL接近沸腾的蒸馏水中,加完混合物后继续加热至接近沸腾状态数分钟。
III.静置溶液澄清后,用倾析法分离得到沉淀,用蒸馏水洗涤,干燥。
IV.将III中所得的产品放入如图装置中的三颈烧瓶,加入约20 mL蒸馏水,加热搅拌至50℃左右。

V.向三颈烧瓶中加入甲酸,反应结束后趁热过滤。
VI.经过一系列操作得到Cu (HCOO) 2·4H2O 7.91 g。
回答下列问题:
(1)、步骤I中研细过程所用的主要仪器是。(2)、步骤II中发生反应的离子方程式为。实际取用的硫酸铜和碳酸氢钠的物质的量之比小于1:2,这样操作的原因是。
(3)、步骤II温度不宜过高,若观察到( 填实验现象) ,则说明温度过高。(4)、步骤III中检验沉淀已洗净的方法是 。(5)、步骤V中过滤必须趁热的原因是。(6)、步骤VI中用无水乙醇洗涤的目的是。(7)、该实验中产品的产率是。10. 我国科学家在淀粉人工光合成方面取得重大突破性进展,该实验方法首先将CO2催化还原为CH3OH。已知CO2催化加氢的主要反应有:反应I: CO2(g) +3H2(g)CH3OH(g) +H2O(g) ΔH1 = -49.6 kJ·mol-1
反应: II.CO2(g) +H2(g)CO(g) +H2O(g) ΔH2= + 41.2 kJ·mol-1
当原料组成为n(CO2):n(H2)=1:3时,上述反应体系在一定条件下建立平衡后,含碳产物中CH3OH的物质的量分数(Y)及CO2的转化率(Q )与反应温度的关系曲线如图所示。
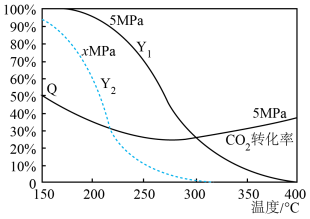 (1)、反应CO(g) +2H2(g)CH3OH (g)的焓变ΔH =。(2)、据如图判断x5(选填 “大于”“小于”或“等于”),理由是。(3)、下列说法正确的有 。A、升高温度,CO2转化速率减慢 B、恒温恒容条件下,体系密度不变表明反应达到平衡状态 C、5MPa、温度高于300℃后,含碳产物以CO为主 D、5MPa、300~ 400℃范围内, H2O的平衡产量随反应体系温度升高而增大(4)、在一定温度下,向体积固定的密闭容器中加入1 mol CO2 (g)和3molH2 (g),起始压强为4MPa,发生反应I和II。平衡时,CO2(g) 的转化率为40%, CO (g)的物质的量为0.1 mol。反应I的分压平衡常数Kp=(气体分压 =总压 ×该组分的物质的量分数)。(5)、反应II的正反应速率方程为v正=k正·c(CO2)·c(H2),逆反应速率方程为v逆=k逆·c (CO)·c(H2O),其中k正、k逆分别为正、逆反应的速率常数,只受温度影响。lgk(速率常数的对数)与1/T (温度的倒数)的关系符合如图中的两条线,其中表示lg k逆的是 , 理由是。
(1)、反应CO(g) +2H2(g)CH3OH (g)的焓变ΔH =。(2)、据如图判断x5(选填 “大于”“小于”或“等于”),理由是。(3)、下列说法正确的有 。A、升高温度,CO2转化速率减慢 B、恒温恒容条件下,体系密度不变表明反应达到平衡状态 C、5MPa、温度高于300℃后,含碳产物以CO为主 D、5MPa、300~ 400℃范围内, H2O的平衡产量随反应体系温度升高而增大(4)、在一定温度下,向体积固定的密闭容器中加入1 mol CO2 (g)和3molH2 (g),起始压强为4MPa,发生反应I和II。平衡时,CO2(g) 的转化率为40%, CO (g)的物质的量为0.1 mol。反应I的分压平衡常数Kp=(气体分压 =总压 ×该组分的物质的量分数)。(5)、反应II的正反应速率方程为v正=k正·c(CO2)·c(H2),逆反应速率方程为v逆=k逆·c (CO)·c(H2O),其中k正、k逆分别为正、逆反应的速率常数,只受温度影响。lgk(速率常数的对数)与1/T (温度的倒数)的关系符合如图中的两条线,其中表示lg k逆的是 , 理由是。图中A,B,C,D点的纵坐标分别为a+2、a+1、a-1、a-2,则温度为T1时,反应II的化学平衡常数K=。
 11. 硒(Se)是人体必需微量元素之一 ,含硒化合物在材料和药物领城具有重要应用。(1)、I.自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子X的结构如图所示:
11. 硒(Se)是人体必需微量元素之一 ,含硒化合物在材料和药物领城具有重要应用。(1)、I.自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子X的结构如图所示:
基态硒原子的价层电子轨道表示式为。
(2)、分子X中电负性最大的元素是(填元素符号,下同),杂化轨道类型为sp3的中心原子是。(3)、H2O、H2S和H2Se的沸点由高到低顺序为。(4)、比较SeO3分子和 离子的键角大小,并说明理由。(5)、II. Cu2-xSe是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。
每个Cu2-xSe晶胞中含有个Cu2+(用含x的表达式作答)。
(6)、立方Na2Se晶胞的晶胞参数为a pm,位于面心的Se2-所围成的空间结构为 , 该晶胞的密度为g·cm-3(用NA表示阿伏加德罗常数的值)。12. 抗肿瘤药物博舒替尼(J)的一种合成路线如下:
已知:

请回答:
(1)、A中官能团的名称为。(2)、反应②的化学方程式是 。(3)、E→F的反应可以看作两步反应发生,这两步反应的类型依次为加成反应、 , 中间体的结构简式为。(4)、反应⑥的化学方程式为。(5)、H的结构简式为。(6)、I的分子式为。(7)、K是A的同分异构体,满足下列条件的K的结构有种 (不考虑立体异构)。a.分子结构中含有苯环,不含有甲基
B.苯环上只有两个取代基
C.1molK分别能与3molNa、2molNaOH、1molNaHCO3反应