甘肃省酒泉市2023届高三下学期第一次诊断考试理综化学试题
试卷更新日期:2023-03-20 类型:高考模拟
一、单选题
-
1. 化学与人类生产、生活、社会可持续发展密切相关,下列说法正确的是A、喷油器、涂油脂、电镀或金属表面钝化,都是金属防护的物理方法 B、“化干戈为玉帛”中“帛”的主要成分是蛋白质,在一定条件下水解会生成氨基酸 C、无定型碳酸钙水通道技术将CaCO3·H2O转化为CaCO3 , 此过程为物理变化 D、海水稻大米中含有淀粉、蛋白质、脂肪等,上述物质都是高分子化合物2. 酚酞是一种常用酸碱指示剂,广泛应用于酸碱滴定过程中,其结构简式如图所示。下列说法正确的是
 A、该有机物的分子式为C20H16O4 B、该分子中所有碳原子可能共平面 C、1 mol该有机物与H2反应时最多可消耗10 mol H2 D、该有机物在一定条件下能发生加成反应和取代反应3. 下列实验装置及现象正确的是
A、该有机物的分子式为C20H16O4 B、该分子中所有碳原子可能共平面 C、1 mol该有机物与H2反应时最多可消耗10 mol H2 D、该有机物在一定条件下能发生加成反应和取代反应3. 下列实验装置及现象正确的是选项
A
B
C
D
实验装置




实验现象或目的
分离I2和KMnO4固体
浓氨水与浓硫酸反应
制备Fe(OH)2 , 并观察其颜色
检验乙炔气体可使酸性高锰酸钾溶液褪色
A、A B、B C、C D、D4. 短周期主族元素X、Y、Z、R、W的原子序数依次增大,X、Y、Z位于同一周期,Y和R位于同一主族,这五种元素构成的一种分子的结构如图所示。下列说法正确的是 A、离子半径: B、X的氢化物常温下一定为气体 C、氧化物对应水化物的酸性: D、分子中每个原子都符合8电子稳定结构5. 在一定条件下,取一定量的X和Y在恒容密闭容器中发生反应:aX(g)+bY(s)⇌mM(g)+nN(g) ΔH=Q kJ·mol-1 , 达到平衡时,M的浓度与温度和容器容积的关系如图所示。下列有关判断一定正确的是
A、离子半径: B、X的氢化物常温下一定为气体 C、氧化物对应水化物的酸性: D、分子中每个原子都符合8电子稳定结构5. 在一定条件下,取一定量的X和Y在恒容密闭容器中发生反应:aX(g)+bY(s)⇌mM(g)+nN(g) ΔH=Q kJ·mol-1 , 达到平衡时,M的浓度与温度和容器容积的关系如图所示。下列有关判断一定正确的是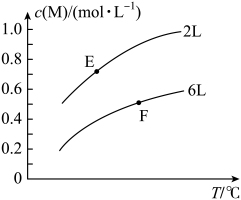 A、a> m十n B、Q>0 C、E点的平衡常数大于F点的平衡常数 D、达到平衡后,增大Y的量将会提高X的转化率6. 锂电池在航空航天领域应用广泛,Li- CO2电池供电的反应机理如图所示,下列说法正确的是
A、a> m十n B、Q>0 C、E点的平衡常数大于F点的平衡常数 D、达到平衡后,增大Y的量将会提高X的转化率6. 锂电池在航空航天领域应用广泛,Li- CO2电池供电的反应机理如图所示,下列说法正确的是 A、X方向为电流方向 B、交换膜M为阴离子交换膜 C、正极的电极反应式:4Li+ +4e-+3CO2=2Li2CO3+C D、可采用LiNO3水溶液作为电解质溶液7. 常温下,将NaOH溶液滴加到20mL等浓度的某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如下图所示[已知:p=-lg]。下列叙述错误的是
A、X方向为电流方向 B、交换膜M为阴离子交换膜 C、正极的电极反应式:4Li+ +4e-+3CO2=2Li2CO3+C D、可采用LiNO3水溶液作为电解质溶液7. 常温下,将NaOH溶液滴加到20mL等浓度的某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如下图所示[已知:p=-lg]。下列叙述错误的是 A、m点对应的NaOH溶液体积小于10 mL B、Ka(HA)为10-4.76 C、l点所示溶液中:c(Na+)<c(A-)+c(HA) D、各点水的电离程度关系:n>m>l
A、m点对应的NaOH溶液体积小于10 mL B、Ka(HA)为10-4.76 C、l点所示溶液中:c(Na+)<c(A-)+c(HA) D、各点水的电离程度关系:n>m>l二、综合题
-
8. 亚硝酰氯(Cl-N=O)是有机合成中的重要试剂,熔点为-64. 5℃,沸点为- 5.5℃,遇水易水解。实验室用Cl2与NO反应制备ClNO并测定其纯度的实验装置如图所示(夹持装置略去)。

回答下列问题:
(1)、仪器a的名称为。a中发生反应的离子方程式为。(2)、装置C中长颈漏斗的作用是。(3)、实验室一般将浓硝酸保存在棕色试剂瓶中,并放置在阴凉处,原因是(用化学方程式表示)。(4)、装置D中将三颈烧瓶浸在- 10℃冰盐水中的目的是。(5)、若去掉装置D中的干燥管,对实验的影响是(用化学方程式表示)。(6)、通过以下实验测定亚硝酰氯样品的纯度。取D中所得液体100 g溶于适量的NaOH溶液中,配制成250 mL溶液;取出25. 00 mL样品溶于锥形瓶中,用a mol·L-1 AgNO3标准溶液滴定,滴定终点时消耗标准溶液的体积为20. 00 mL。则亚硝酰氯样品的纯度为。9. 回收钴废料能有效缓解金属资源浪费、环境污染等问题。一种以含钴催化剂废料(主要含Co、Fe,还含有少量的CoO、FeO、Fe2O3、CaO、SiO2)制备氧化钴(Co2O3)的工艺流程如下图所示:
已知:①有关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子
Fe2+
Fe3+
Co2+
开始沉淀的pH
7.5
2.2
6.7
完全沉淀的pH
9.5
3.0
8.7
②在pH为4~6时,Fe3+水解生成含Fe(OH)3·nFe3+·(n-x) 胶粒的胶体;
③金属钴与铁具有相似的化学性质;
④氧化性:Co3+>ClO-。
回答下列问题:
(1)、酸浸后,“滤渣”的主要成分有和(填化学式)。(2)、“除铁”时加入NaClO,主要反应的离子方程式为 , 再加入Na2CO3溶液调节pH,已知溶液pH对除铁率和钴回收率影响如图所示,则该步骤应控制pH范围为 , 图中钴回收率骤降的可能原因是。 (3)、“滤液2”中主要溶质的常见用途为。(4)、“沉钴2”中加入(NH4)2C2O4使Co2+沉淀完全[c(Co2+)<10-5mol·L-1],控制的浓度不小于mol·L-1[已知:Ksp(CoC2O4)=6.3×10-8]10. 氮及其化合物在工农业生产和生命活动中起着重要的作用,但同时又是造成环境污染的主要物质,其转化规律一直是科学家们研究的热点问题。回答下列问题:
(3)、“滤液2”中主要溶质的常见用途为。(4)、“沉钴2”中加入(NH4)2C2O4使Co2+沉淀完全[c(Co2+)<10-5mol·L-1],控制的浓度不小于mol·L-1[已知:Ksp(CoC2O4)=6.3×10-8]10. 氮及其化合物在工农业生产和生命活动中起着重要的作用,但同时又是造成环境污染的主要物质,其转化规律一直是科学家们研究的热点问题。回答下列问题: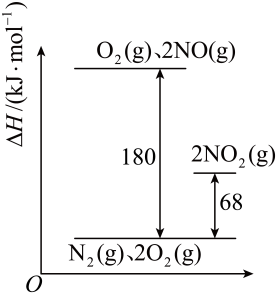 (1)、已知氮氧化物转化过程中的能量变化如图所示(图中表示生成2 mol NO2的能量变化)。则2NO(g) +O2(g)=2NO2(g) ΔH=。(2)、某温度下,反应的平衡常数如下:
(1)、已知氮氧化物转化过程中的能量变化如图所示(图中表示生成2 mol NO2的能量变化)。则2NO(g) +O2(g)=2NO2(g) ΔH=。(2)、某温度下,反应的平衡常数如下:I.2NO(g)+O2(g)⇌2NO2(g) K1=3. 3×1013
II.2NO(g)⇌N2(g)+O2(g) K2=2. 2× 1030
则该温度下,反应III:2NO2(g)⇌N2(g)+2O2(g) K3= (计算结果保留一位小数),反应II与反应III相比分解趋势较大的反应是(填“反应II”或“反应III ”)。
(3)、已知反应2NO(g)+2H2(g)⇌N2(g)+2H2O(g) ΔH =- 148 kJ ·mol-1 , 正反应速率方程式可以表示为v正=k正cm(NO)·cn(H2)(k正为正反应速率常数,只与温度有关。m和n为反应级数,取最简单正整数)。为了探究一定温度下NO、H2的浓度对反应速率的影响,测得实验数据如下:序号
c(NO)/(mol·L-1)
c(H2)/ (mol·L-1)
v正/(mol·L-1·min-1)
I
0.10
0.10
0.414k正
II
0.10
0.20
0.828k正
III
0.30
0.10
3.726k正
①v正 =k正cm(NO)·cn(H2)中,m=、n=。
②经研究,有人提出上述反应分两步进行: I. 2NO(g)+ H2 (g)=N2 (g) + H2O2(g);II. H2(g)+H2O2(g)=2H2O(g)。化学总反应由较慢的一步反应决定。上述反应中II反应较快,则反应I正反应活化能 (填“大于”“小于”或“等于”)反应II正反应活化能。
(4)、在恒温条件下,将2 mol Cl2和1 mol NH3充入某密闭容器中发生反应:2Cl2(g) + NH3(g)⇌NHCl2(l) + 2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示。则A、B、C三点中NH3转化率由大到小的顺序是;计算 C点时该反应的压强平衡常数Kp(C)=MPa -1(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。 11. CuO在化学链(如气相烃类)燃烧和催化CO氧化过程中均展现出良好的性能,同时具有成本低廉的优势,有望成为贵金属催化剂的替代品。中国科学院工程热物理研究所的科研人员初步揭示了CO在CuO表面的催化机理,并深入研究了CO在铜基氧化物表面的反应机制,并提出了对应的反应动力学模型。(1)、基态铜原子的价电子排布式为 , 其核外电子的空间运动状态有种。(2)、N与C、O同周期,H、C、N三种元素的电负性从小到大的顺序为;C、N、O 的第一电离能从大到小的顺序为。(3)、NH3具有还原性,能被CuO氧化,NH3分子中N原子的杂化方式为 , NH3的沸点高于PH3的原因是。(4)、已知Cu2O的熔点高于Cu2S的熔点,其原因是。(5)、铜的某种氧化物的晶胞结构如图所示,若该晶胞中Cu原子与O原子之间的最近距离为apm,设阿伏加德罗常数的值为NA , 则该晶胞的密度为g· cm-3(填含a、NA的代数式)。
11. CuO在化学链(如气相烃类)燃烧和催化CO氧化过程中均展现出良好的性能,同时具有成本低廉的优势,有望成为贵金属催化剂的替代品。中国科学院工程热物理研究所的科研人员初步揭示了CO在CuO表面的催化机理,并深入研究了CO在铜基氧化物表面的反应机制,并提出了对应的反应动力学模型。(1)、基态铜原子的价电子排布式为 , 其核外电子的空间运动状态有种。(2)、N与C、O同周期,H、C、N三种元素的电负性从小到大的顺序为;C、N、O 的第一电离能从大到小的顺序为。(3)、NH3具有还原性,能被CuO氧化,NH3分子中N原子的杂化方式为 , NH3的沸点高于PH3的原因是。(4)、已知Cu2O的熔点高于Cu2S的熔点,其原因是。(5)、铜的某种氧化物的晶胞结构如图所示,若该晶胞中Cu原子与O原子之间的最近距离为apm,设阿伏加德罗常数的值为NA , 则该晶胞的密度为g· cm-3(填含a、NA的代数式)。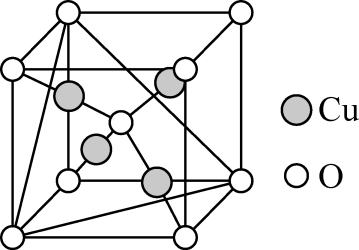 12. 布洛芬是医疗上常用的抗炎药,其一种合成路线如下。
12. 布洛芬是医疗上常用的抗炎药,其一种合成路线如下。
回答下列问题:
已知:
 (1)、C中所含官能团的名称为。(2)、D的名称为。(3)、B→C的反应方程式为。(4)、E→F的反应类型是。(5)、已知G中含有两个六元环,G的结构简式为。(6)、满足下列条件的布洛芬的同分异构体有种。
(1)、C中所含官能团的名称为。(2)、D的名称为。(3)、B→C的反应方程式为。(4)、E→F的反应类型是。(5)、已知G中含有两个六元环,G的结构简式为。(6)、满足下列条件的布洛芬的同分异构体有种。①苯环上有三个取代基,苯环上的一氯代物有两种;
②能发生水解反应,且水解产物之一能与FeCl3溶液发生显色反应;
③能发生银镜反应。
其中核磁共振氢谱有五组峰,峰面积之比为12:2:2: 1: 1的结构简式为、。