北京市平谷区2022-2023学年高三下学期质量监控(零模)化学试题
试卷更新日期:2023-03-20 类型:高考模拟
一、单选题
-
1. 化学与科学、技术、社会与环境发展息息相关。下列说法错误的是A、神舟十三号载人飞船使用的高强度材料碳纤维属于新型有机高分子材料 B、中国科学家实现了二氧化碳人工合成淀粉,该成果有利于碳中和又可助力太空探索 C、“世界铜像之王”三星堆青铜大立人属于合金,其深埋于地下生锈是发生了吸氧腐蚀 D、北京冬奥会火炬在出火口格栅喷涂碱金属,目的是利用焰色反应让火焰可视化2. 下列图示或化学用语表达错误的是A、乙烷的空间填充模型:
 B、二氧化碳的电子式:
B、二氧化碳的电子式: C、反-2-丁烯的结构简式:
C、反-2-丁烯的结构简式: D、基态Cr原子的价层电子轨道表示式:
D、基态Cr原子的价层电子轨道表示式: 3. 据报道,近期中国科研团队在“人造太阳”国际科研合作项目研发中取得实质性工程突破,为该项目提供了重要的“中国智慧”和“中国方案”,“人造太阳”的工作原理是 , 下列有关说法错误的是A、会释放出大量的能量 B、、的中子数相同 C、与化学性质基本相同 D、属于化学变化4. 下列方程式不能准确解释相应反应事实的是A、Na加入滴有酚酞的水中,溶液变红: B、用醋酸溶液除去水垢: C、和浓盐酸共热制取氯气: D、加热蓝色的溶液,溶液变绿:5. 根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( )A、
3. 据报道,近期中国科研团队在“人造太阳”国际科研合作项目研发中取得实质性工程突破,为该项目提供了重要的“中国智慧”和“中国方案”,“人造太阳”的工作原理是 , 下列有关说法错误的是A、会释放出大量的能量 B、、的中子数相同 C、与化学性质基本相同 D、属于化学变化4. 下列方程式不能准确解释相应反应事实的是A、Na加入滴有酚酞的水中,溶液变红: B、用醋酸溶液除去水垢: C、和浓盐酸共热制取氯气: D、加热蓝色的溶液,溶液变绿:5. 根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( )A、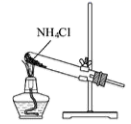 制取氨气
B、
制取氨气
B、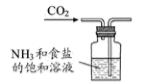 制取碳酸氢钠
C、
制取碳酸氢钠
C、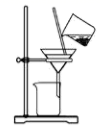 分离碳酸氢钠
D、
分离碳酸氢钠
D、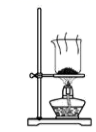 干燥碳酸氢钠
6. 采用强还原剂硼氢化钾液相还原法制备纳米零价铁的化学反应如下: , 其中B元素化合价不变。下列说法正确的是A、纳米铁颗粒直径约为60nm,因此纳米铁是胶体 B、该反应的氧化剂是 , 氧化产物是 C、若有3mol 参加反应,则反应中转移电子的物质的量为4mol D、的酸性比强7. 设为阿伏加德罗常数的值,下列叙述错误的是A、1mol金刚石中的C-C键的数目为4 B、18g重水()中含有的质子数为9 C、标准状况下,11.2L乙烷与乙烯的混合气体中含有的碳原子数约为 D、6.4g Cu与足量反应,电子转移数目为0.28. 某药物的合成中间体结构如图所示,有关该有机物的说法错误的是
干燥碳酸氢钠
6. 采用强还原剂硼氢化钾液相还原法制备纳米零价铁的化学反应如下: , 其中B元素化合价不变。下列说法正确的是A、纳米铁颗粒直径约为60nm,因此纳米铁是胶体 B、该反应的氧化剂是 , 氧化产物是 C、若有3mol 参加反应,则反应中转移电子的物质的量为4mol D、的酸性比强7. 设为阿伏加德罗常数的值,下列叙述错误的是A、1mol金刚石中的C-C键的数目为4 B、18g重水()中含有的质子数为9 C、标准状况下,11.2L乙烷与乙烯的混合气体中含有的碳原子数约为 D、6.4g Cu与足量反应,电子转移数目为0.28. 某药物的合成中间体结构如图所示,有关该有机物的说法错误的是 A、该物质分子中含有四种官能团 B、该物质中的碳原子有和两种杂化方式 C、1mol该有机物和氢气加成最多消耗5mol D、该物质能发生银镜反应,还能使酸性高锰酸钾溶液褪色9. 某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列说法正确的是( )
A、该物质分子中含有四种官能团 B、该物质中的碳原子有和两种杂化方式 C、1mol该有机物和氢气加成最多消耗5mol D、该物质能发生银镜反应,还能使酸性高锰酸钾溶液褪色9. 某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列说法正确的是( ) A、氢化物沸点: B、原子半径: C、第一电离能: D、阴、阳离子中均有配位键10. 室温下,下列实验探究方案不能达到探究目的的是
A、氢化物沸点: B、原子半径: C、第一电离能: D、阴、阳离子中均有配位键10. 室温下,下列实验探究方案不能达到探究目的的是选项
探究方案
探究目的
A
用pH计测量浓度均为0.1mol/L的醋酸和盐酸,比较两溶液pH大小
是弱电解质
B
向2mL 1mol/L NaOH溶液中滴加2滴0.1mol/L 溶液,再滴加4滴0.1mol/L 溶液,观察沉淀的变化
C
向盛有水溶液的试管中滴加几滴品红溶液,振荡,加热试管,观察溶液颜色变化
具有漂白性
D
向盛有淀粉-KI溶液的试管中滴加几滴溴水,振荡,观察溶液颜色变化
氧化性:
A、A B、B C、C D、D11. 甲基丙烯酸甲酯( )在一定条件下发生聚合反应得到线型聚合物a,再通过和交联剂b作用形成网状结构聚合物,其结构片段如下图所示。
)在一定条件下发生聚合反应得到线型聚合物a,再通过和交联剂b作用形成网状结构聚合物,其结构片段如下图所示。
已知:
下列说法错误的是
A、形成线型聚合物a的过程发生了加聚反应 B、线型聚合物a能通过和乙二醇交联形成网状结构 C、在一定条件下网状结构聚合物水解,可实现交联剂b的回收再利用 D、交联过程中有水生成12. 利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示,、、等共存物会影响修复效果。下列说法错误的是 A、反应①②③④均为还原反应 B、有效腐蚀过程中,1mol三氯乙烯完全脱氯,消耗铁1.5mol C、④的电极反应式为 D、修复过程中可能产生Fe(OH)313. 常温下,某弱酸HA溶液中主要成分的物质的量浓度分数随pH的变化如图所示。下列有关叙述错误的是
A、反应①②③④均为还原反应 B、有效腐蚀过程中,1mol三氯乙烯完全脱氯,消耗铁1.5mol C、④的电极反应式为 D、修复过程中可能产生Fe(OH)313. 常温下,某弱酸HA溶液中主要成分的物质的量浓度分数随pH的变化如图所示。下列有关叙述错误的是 A、常温下,HA的电离平衡常数 B、若温度升高,曲线交点M会向左移动 C、NaA的水解平衡常数 D、某的缓冲溶液,pH约为414. 某同学研究浓硝酸与KSCN溶液的反应,在通风橱中进行如下实验:
A、常温下,HA的电离平衡常数 B、若温度升高,曲线交点M会向左移动 C、NaA的水解平衡常数 D、某的缓冲溶液,pH约为414. 某同学研究浓硝酸与KSCN溶液的反应,在通风橱中进行如下实验: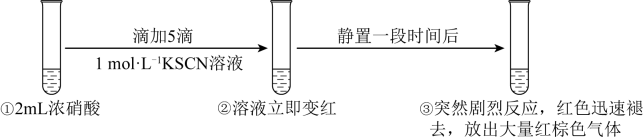
已知:SCN-能被氧化为黄色的(SCN)2 , (SCN)2可聚合为红色的(SCN)x。下列分析错误的是
A、SCN-被氧化为(SCN)2过程中,S的化合价升高 B、分析①②③知,(SCN)2聚合为(SCN)x的速率大于其被硝酸氧化的速率 C、取少量③中的溶液加入BaCl2溶液,产生白色沉淀,证明最终有生成 D、①中改用溶有NO2的浓硝酸重复上述实验,溶液先变红后迅速褪色并产生大量红棕色气体,证明NO2氧化性强于浓硝酸二、非选择题
-
15. 磷及其化合物在工业生产中起着重要的作用。(1)、磷在元素周期表中的位置是;基态磷原子价电子排布式。(2)、磷元素有白磷、黑磷等常见的单质。
①白磷()是分子晶体,易溶于 , 难溶于水,可能原因是。
②黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体是与石墨类似的层状结构,如下图所示。下列有关黑磷晶体的说法正确的是(填字母序号)。

a.黑磷与白磷互为同分异构体 b.黑磷中磷原子采取杂化
c.黑磷能导电 d.黑磷属于混合型晶体
(3)、与水会形成黄色的配离子 , 为避免颜色干扰,常在溶液中加入形成无色的 , 此配离子中(填写化学式)是中心离子,空间构型是。(4)、第IIIA族磷化物均为共价化合物,被广泛用于高温技术、新型电子产品等领域。①实验测定磷化铝和磷化铜的熔点分别为2000℃、1070℃,从结构角度说明其熔点差异的原因。
②磷化硼是一种半导体材料,晶胞结构如图所示,磷化硼的化学式是 , 已知晶胞边长a pm,阿伏加德罗常数为 , 磷化硼晶体的密度是
 16. 氢气作为清洁能源有着广泛的应用前景,请回答下列问题:(1)、I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如下。
16. 氢气作为清洁能源有着广泛的应用前景,请回答下列问题:(1)、I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如下。
过程ii的离子方程式是。
(2)、II.蒸气转化:在催化剂的作用下,水蒸气将氧化。结合图回答问题。
写出甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式:。
(3)、第II步为可逆反应。在800℃时,恒容密闭容器中CO的起始浓度为a mol/L,水蒸气的起始浓度为1.5a mol/L,达到化学平衡状态后,CO平衡转化率为60%,则此反应的平衡常数k=。(4)、在固态金属氧化物电解池中,高温共电解混合气体制备和CO,基本原理如图所示,X是电源的极(填“正”或“负”),电解池中阴极的反应式是和。 17. 一种合成解热镇痛类药物布洛芬方法如下:
17. 一种合成解热镇痛类药物布洛芬方法如下:
已知:是一种还原剂,完成下列填空:
(1)、布洛芬中含有的官能团名称为 , A→B的反应类型是。(2)、D的结构简式是。(3)、E→F的化学方程式为。(4)、化合物M的分子式为 , 与布洛芬互为同系物,且有6个氢原子化学环境相同。符合条件的M有种。(5)、布洛芬有抗炎、镇痛、解热作用,但口服该药对胃、肠道有刺激性,可以对该分子进行如图所示的成酯修饰:
下列说法正确的是____。
A、该做法使药物水溶性增强 B、布洛芬和成酯修饰产物中均含手性碳原子 C、布洛芬中所有的碳原子可能共平面 D、修饰过的分子利用水解原理达到缓释及减轻副作用的目的(6)、以丙醇为主要原料合成的合成路线如图。写出中间产物的结构简式X;Y;Z。
18. 工业以软锰矿(主要成分是 , 含有、等少量杂质)为主要原料制备高性能的磁性材料碳酸锰()。其工业流程如下: (1)、浸锰过程中与反应的离子方程式为 , 该反应是经历以下两步反应实现的。
(1)、浸锰过程中与反应的离子方程式为 , 该反应是经历以下两步反应实现的。i.
ii.……
写出ii的离子方程式:。
(2)、氧化过程中被氧化的物质主要有(写化学式):。(3)、“浸锰”反应中往往有副产物生成,温度对“浸锰”反应的影响如图所示:
为减少的生成,“浸锰”的适宜温度是 , 向过滤II所得的滤液中加入溶液时温度不宜太高的原因是。
(4)、加入溶液后,生成沉淀,同时还有气体生成,写出反应的离子方程式:。(5)、滴定法测产品纯度I.取固体产品1.160g于烧杯中,加入过量稀充分振荡,再加入NaOH溶液至碱性,发生反应:;
II.加入过量KI溶液和适量稀 , 沉淀溶解,溶液变黄;
III.取上述混合液的于锥形瓶中,加入淀粉溶液作指示剂,用0.1000mol/L 溶液进行滴定,发生反应: , 滴定终点时消耗溶液20.00mL。
①写出II中反应的离子方程式;
②判断滴定终点的方法是;
③假设杂质不参与反应,则产品纯度为。(保留四位有效数字)
19. 工业上可用过氧化氢为氧化剂浸取废旧线路板中的铜,某兴趣小组采取不同方案进行实验并研究可行性。方案1
实验装置
加入液体试剂
反应现象

10mL 30% 溶液(pH约为4)
开始无明显现象,静置10小时后,溶液变为浅蓝色,铜片上有少量蓝色沉淀,之后不再有明显变化
(1)、实验结果表明,双氧水与铜可以缓慢的反应,其电极反应式可表示为i.还原反应
ii.氧化反应
(2)、根据电极反应式,有同学设想可以通过以下方式加快反应。i.增大 , 增强的氧化性
ii.降低 , 增强Cu的还原性
(3)、以此为依据设计了方案2与方案3编号
加入液体试剂
反应现象
方案2
10mL30% 溶液和2mL 5mol/L 溶液
开始产生少量气泡,溶液变为蓝色,片刻后,反应越来越剧烈,甚至形成大量泡沫涌出(经检测,生成气体可使带火星木条复燃),反应后剩余铜片表面光亮
方案3
10mL 30% 溶液和2mL 5mol/L 氨水
生成较多气泡,溶液变为深蓝色。一段时间后,反应逐渐变慢,此时铜片上覆盖少量蓝色沉淀物。
方案2与方案3均在一定程度上加快了反应。
①方案2中,生成气体明显更剧烈的原因是。
②方案3中发生主要反应的离子方程式为。
③试评价方案2在回收铜过程的优缺点。
(4)、方案3中生成沉淀会降低铜的回收率并会阻碍反应进行,进一步改进方案获得了良好效果。编号
加入液体试剂
反应现象
方案4
10mL 30% 溶液
2mL 5mol/L氨水
同时加入少量固体
生成较多气泡,溶液变为深蓝色。反应后铜片变薄且表面光亮。
试分析的作用。
(5)、小组同学通过进一步探究发现,含有和氨水的混合溶液能继续浸取单质铜。资料:在水溶液中不稳定,Cu(I)在溶液中能以等形式稳定存在。①用离子方程式表示上述反应原理。
②通常条件下,含的溶液不能与Cu发生反应,请从氧化还原角度分析此反应能够发生的原因。