广东省东莞市七校2021-2022学年高二下学期期中联考化学试题
试卷更新日期:2023-03-15 类型:期中考试
一、单选题
-
1. 某反应过程的能量变化如下图所示,下列说法错误的是
 A、相比反应过程a,过程b可能有催化剂参与 B、该反应为△H<0 C、工业生产上使用催化剂可以降低生产能耗 D、反应过程b的活化能为E1+E22. 2月24日,俄乌战争爆发,乌方违反《第三议定书》明令禁止使用黄磷弹。黄磷(化学式为P4)、红磷(化学式为P)燃烧的热化学方程式(0℃,101kPa)分别为:P4(s)+5O2(g)=P4O10(s);△H=-3093.2kJ·mol-1;4P(s)+5O2(g)=P4O10(s);△H=-2954.0kJ·mol-1。由此判断下列说法正确的是A、红磷的燃烧热为2954.0kJ·mol-l B、已知黄磷分子为正四面体结构,则P-P键之间的夹角为109°28' C、由红磷转化为黄磷是吸热反应,等质量时黄磷能量比红磷高 D、等质量的黄磷和红磷在相同条件下分别与足量氯气反应,设产物只有PCl5 , 则红磷放出的热量更多3. 某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如图(图中只画出了HAP的部分结构)。下列说法错误的是( )
A、相比反应过程a,过程b可能有催化剂参与 B、该反应为△H<0 C、工业生产上使用催化剂可以降低生产能耗 D、反应过程b的活化能为E1+E22. 2月24日,俄乌战争爆发,乌方违反《第三议定书》明令禁止使用黄磷弹。黄磷(化学式为P4)、红磷(化学式为P)燃烧的热化学方程式(0℃,101kPa)分别为:P4(s)+5O2(g)=P4O10(s);△H=-3093.2kJ·mol-1;4P(s)+5O2(g)=P4O10(s);△H=-2954.0kJ·mol-1。由此判断下列说法正确的是A、红磷的燃烧热为2954.0kJ·mol-l B、已知黄磷分子为正四面体结构,则P-P键之间的夹角为109°28' C、由红磷转化为黄磷是吸热反应,等质量时黄磷能量比红磷高 D、等质量的黄磷和红磷在相同条件下分别与足量氯气反应,设产物只有PCl5 , 则红磷放出的热量更多3. 某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如图(图中只画出了HAP的部分结构)。下列说法错误的是( ) A、HAP能提高HCHO与O2的反应速率 B、HCHO在反应过程中,有C—H键发生断裂 C、根据图示信息,CO2分子中的氧原子全部来自O2 D、该反应可表示为:HCHO+O2
A、HAP能提高HCHO与O2的反应速率 B、HCHO在反应过程中,有C—H键发生断裂 C、根据图示信息,CO2分子中的氧原子全部来自O2 D、该反应可表示为:HCHO+O2 CO2+H2O
4. 下列说法正确的是A、酸碱中和滴定接近终点时,滴定管的尖端可以接触锥形瓶内壁 B、工业上合成NH3常选择500℃时进行而不是常温,是基于勒夏特列原理考虑的 C、中和热测定:用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行实验,用量筒量取NaOH溶液时,仰视取液,测得的中和热△H偏小 D、中科院耗时20年自研新型涂层和阴极保护联合防护技术在港珠澳大桥派上了用场,其中阴极保护技术与牺牲阳极的阴极保护法原理完全不同5. 设NA为阿伏加德罗常数的数值,下列说法正确的是A、将NA个N2和3NA个H2置于密闭的容器中充分反应生成NH3(g),放热38.6kJ,则热化学方程式为:N2(g)+3H2(g)⇌2NH3(g) △H=-38.6kJ·mol-1 B、1L0.1mol/LCH3COOH溶液中含有的氢原子数大于0.4NA C、将25gCuSO4·5H2O溶于水配成1L溶液,则溶液中Cu2+数目为0.1NA D、将NA个CO2分子通入1L1mol/L的NaOH中,充分反应后溶液中存在守恒式:c(OH-)=c(H+)+c()+2c(H2CO3)6. 室温下,浓度均为0.2mol·L-1的HA和BOH溶液等体积混合后,所得溶液中部分粒子组分及浓度如图所示。下列说法中错误的是
CO2+H2O
4. 下列说法正确的是A、酸碱中和滴定接近终点时,滴定管的尖端可以接触锥形瓶内壁 B、工业上合成NH3常选择500℃时进行而不是常温,是基于勒夏特列原理考虑的 C、中和热测定:用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行实验,用量筒量取NaOH溶液时,仰视取液,测得的中和热△H偏小 D、中科院耗时20年自研新型涂层和阴极保护联合防护技术在港珠澳大桥派上了用场,其中阴极保护技术与牺牲阳极的阴极保护法原理完全不同5. 设NA为阿伏加德罗常数的数值,下列说法正确的是A、将NA个N2和3NA个H2置于密闭的容器中充分反应生成NH3(g),放热38.6kJ,则热化学方程式为:N2(g)+3H2(g)⇌2NH3(g) △H=-38.6kJ·mol-1 B、1L0.1mol/LCH3COOH溶液中含有的氢原子数大于0.4NA C、将25gCuSO4·5H2O溶于水配成1L溶液,则溶液中Cu2+数目为0.1NA D、将NA个CO2分子通入1L1mol/L的NaOH中,充分反应后溶液中存在守恒式:c(OH-)=c(H+)+c()+2c(H2CO3)6. 室温下,浓度均为0.2mol·L-1的HA和BOH溶液等体积混合后,所得溶液中部分粒子组分及浓度如图所示。下列说法中错误的是 A、HA、BOH均为弱电解质 B、X表示HA或BOH分子 C、电离常数K(HA)=K(BOH) D、该盐溶液pH=47. 某温度下,反应:H2(g) + CO2(g)
A、HA、BOH均为弱电解质 B、X表示HA或BOH分子 C、电离常数K(HA)=K(BOH) D、该盐溶液pH=47. 某温度下,反应:H2(g) + CO2(g) H2O(g)+CO(g)的平衡常数K =9/4该温度下,在甲、乙两个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
H2O(g)+CO(g)的平衡常数K =9/4该温度下,在甲、乙两个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。起始浓度
甲
乙
c(H2)/mol • L-1
0.010
0.020
C(CO2)/mol·L-1
0.010
0.010
下列判断正确的是
A、平衡时,甲容器中H2的转化率为60% B、平衡时,乙容器中H2的转化率大于60% C、平衡时,乙容器中c(H2)是甲容器中的2倍 D、反应开始时,甲容器中的反应速率比乙容器中的反应速率快8. 在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g) △H<0,下列对图象的分析中正确的是 A、图I研究的是t0时增大压强对反应速率的影响 B、图II研究的一定是t0时使用了催化剂对反应速率的影响 C、图III研究的是温度对化学平衡的影响,且甲的温度较高 D、图IV研究的可能是压强对化学平衡的影响,且a的压强较高9. 常温下,向20mL0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法错误的是
A、图I研究的是t0时增大压强对反应速率的影响 B、图II研究的一定是t0时使用了催化剂对反应速率的影响 C、图III研究的是温度对化学平衡的影响,且甲的温度较高 D、图IV研究的可能是压强对化学平衡的影响,且a的压强较高9. 常温下,向20mL0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法错误的是 A、a点的pH>1 B、反应过程中的c(CH3COO-)/c(CH3COOH)比值不断增大 C、c点为理论上的滴定终点,此时V(NaOH)=20mL D、b点时,c(H+)+c(Na+)=c(CH3COO-)+c(OH-)10. 下列说法正确的是A、常温下在由水电离出的c(H+)=1×10-14mol/L溶液中可能大量存在Fe3+、、 B、常温下,pH均为4的NH4Cl溶液和盐酸中,由水电离出的c(H+)相等 C、25℃时,浓度均为1mol/L的(NH4)2CO3和(NH4)2Fe(SO4)2溶液中c()前者大 D、将FeCl2溶液在空气中蒸干后高温灼烧,最后可得Fe2O3或Fe3O4固体11. 下列实验操作、现象和结论均正确的是
A、a点的pH>1 B、反应过程中的c(CH3COO-)/c(CH3COOH)比值不断增大 C、c点为理论上的滴定终点,此时V(NaOH)=20mL D、b点时,c(H+)+c(Na+)=c(CH3COO-)+c(OH-)10. 下列说法正确的是A、常温下在由水电离出的c(H+)=1×10-14mol/L溶液中可能大量存在Fe3+、、 B、常温下,pH均为4的NH4Cl溶液和盐酸中,由水电离出的c(H+)相等 C、25℃时,浓度均为1mol/L的(NH4)2CO3和(NH4)2Fe(SO4)2溶液中c()前者大 D、将FeCl2溶液在空气中蒸干后高温灼烧,最后可得Fe2O3或Fe3O4固体11. 下列实验操作、现象和结论均正确的是选项
操作
现象
结论或解释
A
常温下向物质的量浓度均为0.1mol/L的
NaCl和NaI混合液中逐滴滴入AgNO3溶液
先出现黄色沉淀
Ksp(AgCl)<KSp(AgI)
B
向两试管同体积同浓度的H2O2溶液中分别滴加5滴FeCl3和CuSO4溶液
滴入FeCl3溶液的试管产生气泡较快
催化效果:Fe3+>Cu2+
C
把FeCl2溶液滴入酸性KMnO4溶液中
紫红色褪去
Fe2+具有还原性
D
滴有酚酞的Na2CO3溶液中加入BaCl2固体
溶液红色变浅
Na2CO3溶液中存在水解平衡
A、A B、B C、C D、D12. 2019年诺贝尔化学奖授予了锂离子电池开发的三位科学家。一种锂离子电池的结构如图所示,电池反应式为 LixC6 + Li1-xCoO2 C6 + LiCoO2(x<1)。下列说法正确的是
C6 + LiCoO2(x<1)。下列说法正确的是 A、放电时,a极为负极 B、充电时,Li1-xCoO2/LiCoO2电极发生Li+脱嵌,放电时发生Li+嵌入 C、放电时,若转移0.02mol电子,石墨电极将减重0.21g D、放电时,Li+在电解质中由a极向b极迁移13. Na2CrO4水溶液存在如下平衡:2H++2(黄色)⇌2⇌(橙色)+H2O,在1.00mol/L的铬酸钠(Na2CrO4)溶液中,各种含铬离子的分布分数与pH关系如图所示。下列说法错误的是
A、放电时,a极为负极 B、充电时,Li1-xCoO2/LiCoO2电极发生Li+脱嵌,放电时发生Li+嵌入 C、放电时,若转移0.02mol电子,石墨电极将减重0.21g D、放电时,Li+在电解质中由a极向b极迁移13. Na2CrO4水溶液存在如下平衡:2H++2(黄色)⇌2⇌(橙色)+H2O,在1.00mol/L的铬酸钠(Na2CrO4)溶液中,各种含铬离子的分布分数与pH关系如图所示。下列说法错误的是 A、Na2CrO4溶液中滴加硫酸,由黄色变为橙色 B、铬酸(H2CrO4)的第二步电离常数Ka2=10-6.4 C、要得到纯度较高的Na2CrO4溶液,应控制pH>9 D、pH=6时,Na2CrO4溶液中存在:c(Na+)=2c()+2c()+2c()14. 常温下,在新制氯水中滴加 NaOH 溶液,溶液中水电离出来的 c 水(H+)与 NaOH 溶液的体积之间的关系如图所示。下列推断正确的是( )
A、Na2CrO4溶液中滴加硫酸,由黄色变为橙色 B、铬酸(H2CrO4)的第二步电离常数Ka2=10-6.4 C、要得到纯度较高的Na2CrO4溶液,应控制pH>9 D、pH=6时,Na2CrO4溶液中存在:c(Na+)=2c()+2c()+2c()14. 常温下,在新制氯水中滴加 NaOH 溶液,溶液中水电离出来的 c 水(H+)与 NaOH 溶液的体积之间的关系如图所示。下列推断正确的是( ) A、用 pH 试纸测定 E 点对应的溶液,其 pH=3 B、F、H 点对应的溶液中都存在 c(Na+)=c(Cl-)+c(ClO-) C、常温下加水稀释 H 点对应的溶液,溶液的 pH 增大 D、G 点对应的溶液中c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+)15. 将一定浓度的AgNO3溶液分别滴加到浓度均为0.01mol·L-1的NaBr、Na2SeO3溶液中,所得的沉淀溶解平衡曲线如图所示(Br-、用Xn-表示,不考虑的水解),下列叙述正确的是
A、用 pH 试纸测定 E 点对应的溶液,其 pH=3 B、F、H 点对应的溶液中都存在 c(Na+)=c(Cl-)+c(ClO-) C、常温下加水稀释 H 点对应的溶液,溶液的 pH 增大 D、G 点对应的溶液中c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+)15. 将一定浓度的AgNO3溶液分别滴加到浓度均为0.01mol·L-1的NaBr、Na2SeO3溶液中,所得的沉淀溶解平衡曲线如图所示(Br-、用Xn-表示,不考虑的水解),下列叙述正确的是 A、Ksp(Ag2SeO3)≈1×10-10 B、d点对应的AgBr溶液为不饱和溶液 C、逐滴加AgNO3溶液时,先产生Ag2SeO3沉淀 D、Ag2SeO3(s)+2Br-(aq)⇌2AgBr(s)+(aq)平衡常数为109.6 , 反应趋于完全16. 验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
A、Ksp(Ag2SeO3)≈1×10-10 B、d点对应的AgBr溶液为不饱和溶液 C、逐滴加AgNO3溶液时,先产生Ag2SeO3沉淀 D、Ag2SeO3(s)+2Br-(aq)⇌2AgBr(s)+(aq)平衡常数为109.6 , 反应趋于完全16. 验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。①
②
③
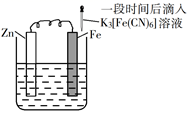
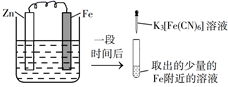
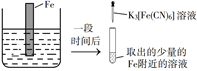
在Fe表面生成蓝色沉淀
试管内无明显变化
试管内生成蓝色沉淀
下列说法错误的是( )
A、对比②③,可以判定Zn保护了Fe B、对比①②,K3[Fe(CN)6]可能将Fe氧化 C、验证Zn保护Fe时不能用①的方法 D、将Zn换成Cu,用①的方法可判断Fe比Cu活泼二、综合题
-
17. 东莞市松山湖打造我市首个“氢谷”产业基地;氢气是一种清洁能源,也是重要的化工原料。(1)、纳米级的Cu2O可作为太阳光分解水的催化剂。一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:2H2O(g)2H2(g)+O2(g) △H=+484kJ·mol-1 , 不同时段产生O2的量见下表:
时间/min
20
40
60
80
n(O2)/mol
0.0010
0.0016
0.0020
0.0020
上述反应过程中能量转化形式为光能转化为能,达平衡过程中至少需要吸收光能为kJ(保留三位小数)。
(2)、氢气是合成氨工业的原料,合成塔中每产生2molNH3 , 放出92.2kJ热量。已知:
则1molN-H键断裂吸收的能量约等于kJ。
(3)、已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/molN2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
则H2还原NO2生成水蒸气和氮气反应的热化学方程式是。
(4)、氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是H2+2NiO(OH)2Ni(OH)2。请由总反应式回答:①电解质溶液应该是(选填酸溶液、碱溶液);
②电池放电时,负极反应式为;
③外电路中每通过0.2NA个电子时,H2的质量理论上减小g。
18. 酸碱中和滴定、氧化还原滴定和沉淀滴定法在科研和工业生产中都很重要。I.为了测定草酸(H2C2O4)溶液的浓度,进行如下实验:取25.00mL草酸溶液于锥形瓶内,加入适量稀H2SO4 , 用0.0100mol/LKMnO4溶液滴定。发生的反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。试回答:
(1)、滴定终点时的现象:。(2)、若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴至终点,则所测得c(H2C2O4)(填“偏大”、“偏小”或“无影响”)。(3)、在滴定过程中若用去KMnO4溶液体积V数据如下,则所配制的草酸溶液的物质的量浓度为mol/L。实验编号
V始(mL)
V终(mL)
V(mL)
1
1.00
13.05
?
2
0.50
12.45
?
3
0.70
15.70
?
(4)、若将KMnO4与稍过量的草酸溶液直接混合,发现开始时变色不明显,但一会后突然Ag2CrO4褪色,猜测其原因是:。(5)、II.莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度。已知常温下Ksp数值如下表。回答下列问题:AgCl
AgBr
AgCN
Ag2CrO4
AgSCN
颜色
白色
浅黄色
白色
砖红色
白色
Ksp
1.8×10-10
5.4×10-13
1.2×10-16
9.0×10-12
1.0×10-12
当溶液中的Cl-恰好沉淀完全(浓度为1.0×10-5mol/L)时,溶液中的c(Ag+)=mol/L,c()=mol/L。
(6)、若用AgNO3溶液滴定NaSCN溶液,可选为滴定指示剂的是____。A、NaCl B、KBr C、Na2CrO4 D、NaCN19. 大气环境中NOx的减量化排放受到国内外的广泛关注。利用碳还原NO的反应为:C(S)+2NO(g)⇌N2(g)+CO2(g),△S较小。回答下列问题:(1)、该反应在常温下可以自发进行,则反应的△H0(填“>”“=”或“<”),有利于提高NO平衡转化率的条件是(任写一条)。平衡后,若保持温度和容积不变,向体系中加入少量NO,NO的平衡转化率(填“增大”、“减小”或“不变”)。(2)、以上反应可分为如下四步反应历程,写出其中第三步的反应:第一步:2NO=(NO)2
第二步:C+(NO)2=C(O)+N2O
第三步:
第四步:2C(O)=CO2+C
(3)、对比研究活性炭负载铜、镧的反应活性。在三个反应容器中分别加入La/C、Cu/C、C,通入NO使其浓度达到相同浓度。不同温度下,测得第3小时末(未到达平衡)NO去除率如图所示:
①恒温恒容下C(s)+2NO(g)⇌N2(g)+CO2(g)下列能说明反应达平衡状态的是。
A.总压强恒定不变。
B.气体的平均相对分子质量不再改变
C.气体的平均密度不再改变
D.Cu/C催化、200℃时NO去除率达50%
②据图分析,相同温度下La/C、Cu/C去除NO效果比C更好,可能的原因是(写一条)。
③上述实验中,200℃时,若测得NO的去除率为80%,则可能采取的措施是。
A.及时分离出CO2 B.压缩体积
C.恒容下,向体系中通入氮气 D.寻找更好的催化剂
20.(1)、I.丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如下图。
丙烷脱氢制丙烯的过程中。恒压时向原料气中掺入高温水蒸气,则K(主反应)(填“增大”、“减小”或不变”,下同),转化率α(C3H8)。温度升高,副反应更容易发生的主要原因是。
(2)、先以丙烯制丙烯腈,再用丙烯腈在阴极电合成已二腈(弱酸环境),总反应式:2CH2=CH-CN+H2O=NC(CH2)4CN+1/2O2↑,则阳极电极反应式:。(3)、II.在2.0L密闭容器中,通入0.10molCH4和0.20molNO2进行反应:CH4(g)+2NO2(g)⇌CO2(g)+N2(g)+2H2O(g) △H<0,温度为T1和T2下,反应时间(t)与容器内甲烷物质的量数据见下表:时间(t/min)
0
2
4
6
10
12
T1 , 甲烷物质的量
0.10
0.082
0.068
0.060
0.045
0.045
T2 , 甲烷物质的量
0.10
0.080
0.065
0.055
0.050
_
计算T1、0~2min内NO2的平均反应速率v(NO2)=mol·L-1·min-1 , 温度T2下的平衡常数K=mol·L-1(若提供的数据不足以计算,填“无法确定”)。
(4)、在一恒容密闭容器中,通入一定量CH4和NO2 , 测得在相同时间内,不同温度下,NO2的转化率随温度的变化如下图。c点(填“是”或“不是”)反应达平衡的点。