山东省淄博市2022-2023学年高三第一次模拟考试化学试题
试卷更新日期:2023-03-14 类型:高考模拟
一、单选题
-
1. 化学与生产、生活关系密切,下列说法错误的是A、使用含氟牙膏能预防龋齿 B、紫外线消毒利用了使蛋白质变性的原理 C、发泡塑料饭盒不适宜盛放含油脂较多的食品 D、用外加电流法防钢铁腐蚀需附加惰性电极作阴极2. 下列做法正确的是A、用稀硝酸清洗试管内壁的银镜 B、用带橡胶塞的棕色细口瓶保存溴水 C、用玻璃棒蘸取样品进行焰色试验 D、用pH试纸测定过氧乙酸溶液的pH3. 关于C2H2、N2H2、H2O2、H2S2的结构与性质,下列说法错误的是A、热稳定性:H2O2>H2S2 B、N2H2存在顺反异构现象 C、键角:C2H2>N2H2>H2S2>H2O2 D、四种物质中沸点最高的是H2O24. 下列装置能达到实验目的是
 A、装置甲:明矾晶体制备KAl(SO4)2 B、装置乙:制备少量干燥的NH3 C、装置丙:常温下分离苯酚与水的混合物 D、装置丁:探究浓度对化学反应速率的影响5. 铝的卤化物AlX3(X=Cl、Br、I)气态时以Al2X6双聚形态存在,下列说法错误的是
A、装置甲:明矾晶体制备KAl(SO4)2 B、装置乙:制备少量干燥的NH3 C、装置丙:常温下分离苯酚与水的混合物 D、装置丁:探究浓度对化学反应速率的影响5. 铝的卤化物AlX3(X=Cl、Br、I)气态时以Al2X6双聚形态存在,下列说法错误的是
性质
AlF3
AlCl3
AlBr3
AlI3
熔点/℃
1290
192.4
97.8
189.4
沸点/℃
1272
180
256
382
A、AlF3晶体类型与其他三种不同 B、1molAl2Cl6中所含配位键数目为4NA C、Al2X6中Al、X原子价电子层均满足8e-结构 D、AlCl3熔点高于AlBr3原因是Cl的电负性大于Br,具有一定离子晶体特征6. 抗凝血药物替罗非班合成中间体结构如图,下列说法错误的是 A、该有机物中N原子有两种杂化方式 B、其水解产物均可与Na2CO3溶液反应 C、1mol该分子最多与3molNaOH反应 D、该有机物苯环上的一氯代物有3种7. 高分子材料p的合成路线如图,下列说法错误的是
A、该有机物中N原子有两种杂化方式 B、其水解产物均可与Na2CO3溶液反应 C、1mol该分子最多与3molNaOH反应 D、该有机物苯环上的一氯代物有3种7. 高分子材料p的合成路线如图,下列说法错误的是 A、m分子有对映异构体 B、n分子中所有原子共平面 C、高分子材料p可降解 D、聚合过程中有小分子生成8. 利用如图装置制备ClO2 , 并以ClO2为原料制备NaClO2。已知:高于60℃时,NaClO2分解生成NaClO3和NaCl。下列说法错误的是
A、m分子有对映异构体 B、n分子中所有原子共平面 C、高分子材料p可降解 D、聚合过程中有小分子生成8. 利用如图装置制备ClO2 , 并以ClO2为原料制备NaClO2。已知:高于60℃时,NaClO2分解生成NaClO3和NaCl。下列说法错误的是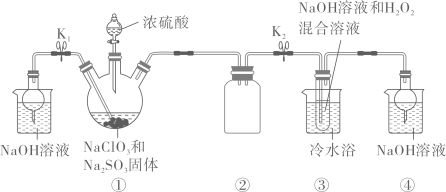 A、Na2SO3和H2O2均作还原剂 B、装置②,④的作用分别是防倒吸、吸收未反应的污染气体 C、从装置④反应后的溶液中获得晶体,可采用常压蒸发结晶 D、反应结束时,通氮气的目的是将仪器中残留的气体排入④中9. X、Y、Z、W为原子序数依次增大的前四周期元素,X为周期表中原子半径最小的元素,Y、Z位于同一主族,且原子序数之和为24,基态W原子的价电子数为11,化合物WZY4•5X2Y的热重曲线如图。下列说法错误的是
A、Na2SO3和H2O2均作还原剂 B、装置②,④的作用分别是防倒吸、吸收未反应的污染气体 C、从装置④反应后的溶液中获得晶体,可采用常压蒸发结晶 D、反应结束时,通氮气的目的是将仪器中残留的气体排入④中9. X、Y、Z、W为原子序数依次增大的前四周期元素,X为周期表中原子半径最小的元素,Y、Z位于同一主族,且原子序数之和为24,基态W原子的价电子数为11,化合物WZY4•5X2Y的热重曲线如图。下列说法错误的是 A、同周期中第一电离能大于Y的元素有3种 B、Z的最高价含氧酸酸性是同主族中最强的 C、WZY4•5X2Y中有三种不同结合力的X2Y D、220℃时,固体物质的化学式为WZY410. 从电镀污泥(含Ni2+、Ca2+、Fe3+、Al3+等)中提取镍的工艺流程如图所示,下列说法错误的是
A、同周期中第一电离能大于Y的元素有3种 B、Z的最高价含氧酸酸性是同主族中最强的 C、WZY4•5X2Y中有三种不同结合力的X2Y D、220℃时,固体物质的化学式为WZY410. 从电镀污泥(含Ni2+、Ca2+、Fe3+、Al3+等)中提取镍的工艺流程如图所示,下列说法错误的是
已知:丁二酮肟可与Ni2+反应生成易溶于有机溶剂的配合物:Ni2++2C4H8N2ONi(C4H7N2O)2+2H+
A、“氨浸”可除去Ca2+、Fe3+、Al3+等金属阳离子 B、进行操作I时,将有机相从分液漏斗上口倒出 C、操作II为反萃取,试剂X可为盐酸,有机相可返回操作I循环使用 D、操作III可能为过滤、洗涤、干燥、灼烧11. 根据下列操作及现象,所得结论正确的是操作及现象
结论
A
向溶有SO2的BaCl2溶液中加入Fe(NO3)3溶液,有白色沉淀生成
说明NO具有强氧化性
B
向2mL浓度均为0.1mol•L-1的NaBr与Na2S混合溶液中滴加2滴0.1mol•L-1的AgNO3溶液,只有黑色沉淀生成
说明Ag2S比AgBr更难溶
C
取4mL乙醇,加入12mL浓硫酸及少量沸石,迅速升温至170℃,将产生的气体进入2mL溴水中,溴水褪色
说明乙醇消去反应的产物为乙烯
D
向丙烯醛中加入足量新制氢氧化铜悬浊液,加热至不再生成砖红色沉淀,静置,向上层清液滴加溴水,溴水褪色
说明丙烯醛中含有碳碳双键
A、A B、B C、C D、D12. 一种以沸石笼为载体对NO进行催化还原的原理如图所示。下列说法错误的是 A、反应④有极性键的断裂与生成 B、反应②③均为氧化还原反应 C、反应⑤的离子方程式为:Cu(NH3)+NO=N2+NH+H2O+Cu(NH3) D、总反应还原1molNO消耗O211.2L(标准状况)13. 下列装置可分离废水中的Co2+和Ni2+。已知Ni2+和Co2+性质相似,Co2+和乙酰丙酮不反应。下列说法正确的是
A、反应④有极性键的断裂与生成 B、反应②③均为氧化还原反应 C、反应⑤的离子方程式为:Cu(NH3)+NO=N2+NH+H2O+Cu(NH3) D、总反应还原1molNO消耗O211.2L(标准状况)13. 下列装置可分离废水中的Co2+和Ni2+。已知Ni2+和Co2+性质相似,Co2+和乙酰丙酮不反应。下列说法正确的是
 A、M电极接太阳能电池的P电极 B、通电一段时间后,I、IV室内溶液pH均减小 C、膜a、膜b分别为阳离子交换膜和阴离子交换膜 D、每生成1molSO , 理论上双极膜至少解离7molH2O14. 两个均充有H2S的刚性密闭容器,起始压强均为pkPa,以温度、Al2O3催化剂为条件变量,进行实验:2H2S(g)2H2(g)+S2(g),反应相同时间,结果如图所示。下列说法错误的是
A、M电极接太阳能电池的P电极 B、通电一段时间后,I、IV室内溶液pH均减小 C、膜a、膜b分别为阳离子交换膜和阴离子交换膜 D、每生成1molSO , 理论上双极膜至少解离7molH2O14. 两个均充有H2S的刚性密闭容器,起始压强均为pkPa,以温度、Al2O3催化剂为条件变量,进行实验:2H2S(g)2H2(g)+S2(g),反应相同时间,结果如图所示。下列说法错误的是 A、温度升高,H2S分解的正,逆反应速率均增大 B、900℃,ts后达平衡,H2的平均生成速率为pkPa∙s−1 C、Al2O3催化剂使得正反应的活化能小于逆反应的活化能 D、1100℃,曲线II、III重合,说明Al2O3催化剂失去活性15. 常温下,用NaOH溶液滴定H3PO3溶液(已知H3PO3为二元弱酸),溶液中pc(H2PO)和-lg或pc(HPO)和-lg的关系如图所示。(已知pc=-lgc)。下列说法正确的是
A、温度升高,H2S分解的正,逆反应速率均增大 B、900℃,ts后达平衡,H2的平均生成速率为pkPa∙s−1 C、Al2O3催化剂使得正反应的活化能小于逆反应的活化能 D、1100℃,曲线II、III重合,说明Al2O3催化剂失去活性15. 常温下,用NaOH溶液滴定H3PO3溶液(已知H3PO3为二元弱酸),溶液中pc(H2PO)和-lg或pc(HPO)和-lg的关系如图所示。(已知pc=-lgc)。下列说法正确的是 A、L2表示pc(HPO)和-lg的关系 B、H3PO3的电离常数Ka2(H3PO3)的数量级为10-6 C、等浓度等体积的H3PO3溶液与NaOH溶液充分混合,c(HPO)>c(H3PO3) D、c(H3PO3)=c(HPO)时,溶液显碱性
A、L2表示pc(HPO)和-lg的关系 B、H3PO3的电离常数Ka2(H3PO3)的数量级为10-6 C、等浓度等体积的H3PO3溶液与NaOH溶液充分混合,c(HPO)>c(H3PO3) D、c(H3PO3)=c(HPO)时,溶液显碱性二、非选择题
-
16. LiCoO2、LiC6是重要的电极材料,回答下列问题:(1)、基态Co原子的价电子中,两种自旋状态的电子数之比为。(2)、Li、Co、O、C的电负性由大到小的顺序是。(3)、Co(III)可形成多种配合物。
①已知Co(NH3)5BrSO4中Co(III)的配位数为6,向该配合物的溶液中滴加BaCl2溶液,无明显现象,则该配合物可表示为。
②[Co(NH3)6]3+结构如图所示,Co3+位于正八面体中心,若其中两个NH3被Cl-取代,则[Co(NH3)4Cl2]-的空间结构有种。
 (4)、LiCH3、LiC(CH3)3在合成化学上应用广泛。(CH3)3C-的空间结构为;(CH3)3C-、H3C-、F3C-的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是。(5)、①正极材料LiCoO2的晶胞结构如图(a)(部分O位于晶胞之外),每个晶胞中含有个O;充电时,LiCoO2脱出部分Li+ , 形成Li1-xCoO2 , 结构如图(b),则n(Co3+):n(Co4+)=。
(4)、LiCH3、LiC(CH3)3在合成化学上应用广泛。(CH3)3C-的空间结构为;(CH3)3C-、H3C-、F3C-的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是。(5)、①正极材料LiCoO2的晶胞结构如图(a)(部分O位于晶胞之外),每个晶胞中含有个O;充电时,LiCoO2脱出部分Li+ , 形成Li1-xCoO2 , 结构如图(b),则n(Co3+):n(Co4+)=。②负极材料LiC6晶胞结构如图(c),Li原子插入石墨层中间,若该晶胞中碳碳键键长为mpm。石墨层间距为npm。该晶体的密度为g•cm-3(用NA表示阿伏加德罗常数的值)。
 17. 工业上以钛铁矿(主要成分为FeTiO3 , 含有SiO2、Fe3O4、MgO、CaO杂质)为原料制备金属钛,并得到副产品FeSO4•7H2O,其工艺流程如图:
17. 工业上以钛铁矿(主要成分为FeTiO3 , 含有SiO2、Fe3O4、MgO、CaO杂质)为原料制备金属钛,并得到副产品FeSO4•7H2O,其工艺流程如图: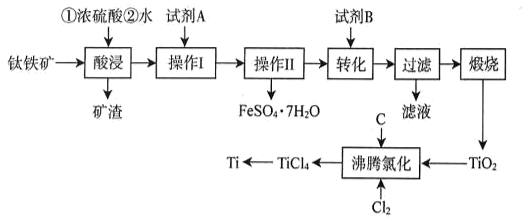
已知:①TiO2+易水解,只能存在于强酸性溶液中;高温下Ti易与N2 , H2反应。
②25℃时相关物质的Ksp见表:
物质
Fe(OH)2
Fe(OH)3
Mg(OH)2
TiO(OH)2
Ksp
1.0×10-16.3
1.0×10-38.6
1.0×10-11.6
1.0×10-29
回答下列问题:
(1)、矿渣的主要成分是;试剂A为(填化学式)。(2)、“酸段”时,钛铁矿与浓硫酸在160~200℃反应,FeTiO3转化为Fe2+和TiO2+ , 该工序主要反应的化学方程式为;加水浸取前需先冷却的目的是。(3)、“转化”工序,加入试剂B调节pH。①试剂B为(填标号)。
A.H2SO4 B.H2O2 C.Na2CO3 D.NH4Cl
②为沉钛完全[c(TiO2+)≤1.0×10-5mol•L-1]需要调节溶液的pH略大于。
(4)、“沸腾氯化”中,氯气与矿料逆流而行,目的是 , 充分反应后,混合气体中各组分的分压如表:物质
TiCl4
Cl2
CO
CO2
分压MPa
4.59×10-2
4.98×10-9
1.84×10-2
3.70×10-2
该温度下,TiO2与C、Cl2反应的总化学方程式为。
(5)、高温下镁与TiCl4反应制备粗钛时需加保护气,下列可作为保护气的是____(填标号)。A、N2 B、H2 C、CO2 D、Ar18. 以V2O5为原料制备氧钒(IV)碱式碳酸铵(NH4)5[(VO)6(CO3)4(OH)9]•10H2O过程:V2O5VOCl2溶液氧钒(IV)碱式碳酸铵粗产品
已知VO2+能被O2氧化,回答下列问题:
(1)、步骤I的反应装置如图(夹持及加热装置略去,下同)
①仪器b的名称为 , 仪器c除冷凝回流外,另一作用为。
②步骤I生成VOCl2的同时,还生成一种无色无污染的气体,该反应的化学方程式为。
(2)、步骤II可在如图装置中进行。
①接口的连接顺序为a→。
②实验开始时,先关闭K2 , 打开K1 , 当时(写实验现象),再关闭K1 , 打开K2 , 充分反应,静置,得到固体。
(3)、测定产品纯度称取mg样品用稀硫酸溶解后,加入过量的0.02mol•L-1KMnO4溶液,充分反应后加入过量的NaNO2溶液,再加适量尿素除去NaNO2 , 用cmol•L-1(NH4)2Fe(SO4)2标准溶液滴定达终点时,消耗体积为VmL。(已知:VO+Fe2++2H+=VO2++Fe3++H2O)
①样品中氧钒(IV)碱式碳酸铵(摩尔质量为Mg•mol-1)的质量分数为。
②下列情况会导致产品纯度偏大的是(填标号)。
A.未加尿素,直接进行滴定
B.滴定达终点时,俯视刻度线读数
C.用标准液润洗滴定管后,液体从上口倒出
D.滴定达终点时,发现滴定管尖嘴内有气泡生成
19. 化合物J是合成紫草酸药物的一种中间体,其合成路线如图:
已知:i.R-CHOR-CH2OH(R为烃基)
ii.

 +
+ (R为烃基)
(R为烃基)回答以下问题:
(1)、A的结构简式为;符合下列条件的A的同分异构体有种。①能与FeCl3溶液作用显色
②能发生银镜反应
③核磁共振氢谱峰面积之比为1∶2∶2∶2∶1
其中,能发生水解反应的结构简式为。
(2)、D→E的反应类型为;该反应的目的是。(3)、F→H的化学方程式为 , 有机物J中含有官能团的名称是。(4)、综合上述信息,写出由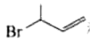 和
和 制备
制备 的合成路线,其他试剂任选。 20. 利用1-甲基萘(1-MN)制备四氢萘类物质(MTLs,包括1-MTL和5-MTL)。反应过程中伴有生成十氢茶(1-MD)的副反应,涉及反应如图:
的合成路线,其他试剂任选。 20. 利用1-甲基萘(1-MN)制备四氢萘类物质(MTLs,包括1-MTL和5-MTL)。反应过程中伴有生成十氢茶(1-MD)的副反应,涉及反应如图:
回答下列问题:
(1)、已知一定条件下反应R1、R2 , R3的焓变分别为△H1 , △H2、△H3 , 则反应R4的焓变为(用含△H1、△H2、△H3的代数式表示)。(2)、四个平衡体系的平衡常数与温度的关系如图甲所示。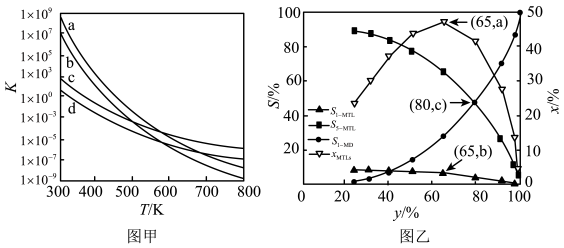
①c、d分别为反应R1和R3的平衡常数随温度变化的曲线,则表示反应R2的平衡常数随温度变化曲线为。
②已知反应R1的速率方程v正=k正•c(1-MN)•c2(H2),v逆=k逆•c(5-MTL)(k正、k逆分别为正、逆反应速率常数,只与温度、催化剂有关)。温度T1下反应达到平衡时k正=1.5k逆 , 温度T2下反应达到平衡时k正=3k逆。由此推知,T1T2(填“>”,“<”或“=”)。
③下列说法错误的是。
A.四个反应均为放热反应 B.压强越大,温度越低越有利于生成四氢萘类物质
C.反应体系中1-MD最稳定 D.由上述信息可知,400K时反应R4速率最快
(3)、1-MN在6.0×103kPa的高压H2氛围下反应(H2压强近似等于总压)。不同温度下达平衡时各产物的选择性Si(某生成物i的物质的量与消耗1-MN的物质的量之比)和物质的量分数xi(xi表示物种i与除H2外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,1-MN平衡转化率y为80%时,1-MTL的产率=;y为65%时反应R1的平衡常数Kp=kPa-2。四氢萘类物质的物质的量分数xi随1-MN平衡转化率先增大后减小,结合平衡移动原理解释原因。