湖南省九校联盟2023届高三下学期第二次联考化学试题
试卷更新日期:2023-03-14 类型:高考模拟
一、单选题
-
1. 化学在社会进步中发挥着关键性作用。下列有关材料的说法错误的是A、2022年北京冬奥会开幕式专用演出服为石墨烯智能发热材料,属于新型无机非金属材料 B、卡塔尔世界杯官方用球使用线形结构的新聚氨基酯(PU)材质,具有透气性、热固性 C、“天问一号”火星车使用的热控保温材料纳米气凝胶可产生丁达尔效应 D、“嫦娥五号”月球车上的国旗是由优质高分子材料嵌入纤维制成的,纤维也属于高分子材料
-
2. 下列化学用语正确的是A、丙烷分子的空间填充模型:
 B、O3分子的球棍模型:
B、O3分子的球棍模型: C、乙醇的核磁共振氢谱图:
C、乙醇的核磁共振氢谱图: D、基态As原子的电子排布式和价电子排布式分别为[Ar]3d104s24p3和4s24p3
D、基态As原子的电子排布式和价电子排布式分别为[Ar]3d104s24p3和4s24p3
-
3. 下列离子方程式书写正确的是A、NaHCO3溶液是常用的沉淀剂,向过量NaHCO3溶液中滴加饱和Ba(NO3)2溶液的离子方程式:Ba2++HCO =BaCO3↓+H+ B、向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+NH+HSO=BaSO4↓+NH3•H2O+H2O C、硫酸铅溶解于浓盐酸中:PbSO4+4Cl-=[PbCl4]2-+SO D、用醋酸和淀粉-KI溶液检验加碘盐中的IO:IO+I-+6H+=3I2+3H2O
-
4. 某小组为了探究不同离子与OH-反应的先后相关问题,分别在1L0.1mol•L-1NH4HCO3溶液、1L0.1mol•L-1NH4HSO3溶液中加一定量NaOH固体后并恢复到常温(体积变化忽略不计),并测得其中相关粒子浓度变化情况分别如图1、图2所示[已知:Ka1(H2CO3)=4.3×10-7 , Ka2(H2CO3)=5.61×10-11 , Ka1(H2SO3)=1.52×10-2 , Ka2(H2SO3)=1.02×10-7 , Kb(NH3•H2O)=1.75×10-5],下列说法正确的是

图11L0.1mol•L-1NH4HCO3溶液中加入一定量NaOH后各粒子浓度变化曲线

图21L0.1mol•L-1NH4HSO3溶液中加入一定量NaOH后各粒子浓度变化曲线
A、由上述实验可知与OH-反应的先后顺序为HSO>NH>HCO B、图1中,当n(NaOH)=0.05mol时,只发生反应OH-+NH=NH3•H2O C、图2中,当n(NaOH)<0.1mol时,主要发生反应HSO+OH-=H2O+SO D、上述实验说明,离子反应的先后顺序与反应平衡常数大小无关 -
5. 一种用作锂离子电池电解液的锂盐结构如图所示,X、Y、Z、W为原子序数依次增大的短周期主族元素,W原子的最外层电子数等于其总电子数的。下列说法错误的是
 A、简单离子半径:W>Y>Z B、X元素的各种含氧酸盐水溶液均显碱性 C、与W同周期的元素中,第一电离能小于W的有5种 D、该锂盐中所有非金属元素均属于元素周期表p区元素
A、简单离子半径:W>Y>Z B、X元素的各种含氧酸盐水溶液均显碱性 C、与W同周期的元素中,第一电离能小于W的有5种 D、该锂盐中所有非金属元素均属于元素周期表p区元素 -
6. 酮基布洛芬(
 )是一种常用的解热镇痛药,通过抑制前列腺素的生成可达到缓解疼痛的作用,并有解热、消炎的作用,尤其对近期新型冠状病毒感染引起的发热症状有很好的治疗作用。下列关于酮基布洛芬的说法正确的是 A、每个分子中至少有14个C原子共平面 B、1mol该物质最多能与7molH2发生加成反应 C、酮基布洛芬分子无对映异构 D、口服酮基布洛芬对胃、肠道有刺激,用
)是一种常用的解热镇痛药,通过抑制前列腺素的生成可达到缓解疼痛的作用,并有解热、消炎的作用,尤其对近期新型冠状病毒感染引起的发热症状有很好的治疗作用。下列关于酮基布洛芬的说法正确的是 A、每个分子中至少有14个C原子共平面 B、1mol该物质最多能与7molH2发生加成反应 C、酮基布洛芬分子无对映异构 D、口服酮基布洛芬对胃、肠道有刺激,用 对布洛芬进行成酯修饰,能有效改善这种状况,原理是两者发生加成反应后酸性减弱
对布洛芬进行成酯修饰,能有效改善这种状况,原理是两者发生加成反应后酸性减弱
-
7. 2022年诺贝尔化学奖授予在“点击化学和生物正交化学”领域做出贡献的三位科学家。点击化学经典反应之一是一价铜[Cu]催化的叠氮化物-端炔烃环加成反应,反应机理示意如图:

下列说法正确的是
A、反应③过程中,不涉及极性键的断裂和形成 B、转化过程中N的杂化方式发生改变 C、该反应的总反应是取代反应,反应历程是离子反应历程 D、一价铜[Cu]催化剂能有效降低总反应的焓变,加快反应速率 -
8. 一种3D打印机的柔性电池以碳纳米管作支撑材料,以吸收ZnSO4溶液的有机高聚物为固态电解质,相关图示如图1、图2,电池总反应为MnO2+Zn+(1+)Zn+ZnSO4MnOOH+[ZnSO4•3Zn(OH)2•xH2O],下列说法错误的是
 A、放电时,含有锌膜的碳纳米管纤维的反应为Zn+H2O+ZnSO4+OH--e-=[ZnSO4•3Zn(OH)2•xH2O] B、充电时,含有MnO2膜的碳纳米管纤维与外电源正极相连 C、合成图2中的有机高聚物分子的反应为缩聚反应 D、有机高聚物中通过氢键的缔合作用,增强了高聚物的稳定性
A、放电时,含有锌膜的碳纳米管纤维的反应为Zn+H2O+ZnSO4+OH--e-=[ZnSO4•3Zn(OH)2•xH2O] B、充电时,含有MnO2膜的碳纳米管纤维与外电源正极相连 C、合成图2中的有机高聚物分子的反应为缩聚反应 D、有机高聚物中通过氢键的缔合作用,增强了高聚物的稳定性 -
9. 铁、镍及其化合物有广泛的用途。某矿渣的主要成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺流程:

已知:①(NH4)2SO4在350℃以上会分解生成NH3和H2SO4;NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3;
②Ksp(CaF2)=4.0×10-11。
则下列说法错误的是
A、(NH4)2SO4的作用是将金属元素转化为可溶性硫酸盐,便于浸出 B、“浸渣”的成分为Fe(OH)3和SiO2 C、沉镍过程中的离子方程式:Ni2++HCO+NH3=NiCO3↓+NH D、“浸出液”中c(Ca2+)=1.0×10-3mol•L-1 , 当除钙率达到99%时,溶液中c(F-)=2.0×10-3mol•L-1 -
10. 某同学利用如图所示装置探究金属的腐蚀与防护,下列说法错误的是
 A、③区电极电势Cu高于Fe B、①区Fe电极和③区Fe电极电极反应均为Fe-2e-=Fe2+ C、②区Zn电极和④区Cu电极电极反应均为2H2O+2e-=H2↑+2OH- D、②区Fe电极和④区Fe电极附近滴加K3[Fe(CN)6]溶液,均会出现蓝色沉淀
A、③区电极电势Cu高于Fe B、①区Fe电极和③区Fe电极电极反应均为Fe-2e-=Fe2+ C、②区Zn电极和④区Cu电极电极反应均为2H2O+2e-=H2↑+2OH- D、②区Fe电极和④区Fe电极附近滴加K3[Fe(CN)6]溶液,均会出现蓝色沉淀 -
11. 某同学对甲苯与高锰酸钾水溶液反应速率做了如下两个实验探究:
实验I.取一定量的甲苯与一定体积和一定浓度的高锰酸钾水溶液,混合,振荡10min,缓慢褪色。
实验Ⅱ.在实验I的试剂取量基础上,再加入120g/L的冠醚(18-冠-6),振荡,4.5min褪色。
下列有关说法错误的是
A、实验I反应速率小的原因是高锰酸钾不溶于甲苯,氧化剂MnO与还原剂甲苯接触不充分 B、K+与冠醚形成超分子,这种超分子可溶于甲苯 C、冠醚依靠其与K+之间的弱配位键作用,实现对K+的识别 D、冠醚可用作相转移催化剂 -
12. 利用γ-丁内酯(BL)制备1,4-丁二醇(BD),反应过程中伴有生成四氢呋喃(THF)和1-丁醇(BuOH)的副反应,涉及反应如图:

已知:①反应I为快速反应,反应II、III为慢速反应;
②以5.0×10-3molBL或BD为初始原料,在493K、3.0×103kPa的高压H2氛围下,分别在恒压容器中进行反应(因反应I在高压H2氛围下进行,故H2压强近似等于总压),x(BL)和x(BD)随时间t变化关系如图所示[x(i)表示某物种i的物质的量与除H2外其他各物种总物质的量之比];达平衡时,以BL为原料,体系向环境放热akJ;以BD为原料,体系从环境吸热bkJ。

下列说法正确的是
A、γ-丁内酯分子中σ键与π键数目之比为6∶1 B、忽略副反应热效应,反应I焓变△H(493K,3.0×103kPa)=-(a+b)kJ•mol-1 C、t1时刻x(H2O)=0.08 D、改变H2的压强不影响副产物四氢呋喃的产量 -
13. 某化学学习小组利用NaClO溶液氧化环己醇(
 )制备环己酮(
)制备环己酮( )的装置如图所示。
)的装置如图所示。操作步骤如下:
i.向仪器A内加入环己醇、冰醋酸,逐滴加入NaClO溶液,30℃条件下反应30分钟后冷却。
ii.向仪器A内加入适量饱和NaHSO3溶液,用NaOH调节溶液显中性后加入饱和NaCl溶液,然后经分液、干燥、蒸馏得到环己酮。
下列叙述错误的是
 A、饱和NaCl溶液可促进有机相和无机相分层 B、饱和NaHSO3溶液的主要作用是除去CH3COOH C、冰醋酸既作为溶剂,同时可增强NaClO溶液的氧化性 D、若NaClO溶液滴加过快,仪器A中会产生少量黄绿色气体
A、饱和NaCl溶液可促进有机相和无机相分层 B、饱和NaHSO3溶液的主要作用是除去CH3COOH C、冰醋酸既作为溶剂,同时可增强NaClO溶液的氧化性 D、若NaClO溶液滴加过快,仪器A中会产生少量黄绿色气体 -
14. 谷氨酸(
 , 用H2A表示)在生物体内的蛋白质代谢过程中占重要地位,在水溶液中有4种分布形式(H3A+、H2A、HA-和A2-),常温下,用0.1mol•L-1HCl溶液滴定20.00mL0.1mol•L-1的Na2A溶液,溶液中pOH与离子浓度变化的关系如图所示[pOH=-lgc(OH-)],下列叙述正确的是
, 用H2A表示)在生物体内的蛋白质代谢过程中占重要地位,在水溶液中有4种分布形式(H3A+、H2A、HA-和A2-),常温下,用0.1mol•L-1HCl溶液滴定20.00mL0.1mol•L-1的Na2A溶液,溶液中pOH与离子浓度变化的关系如图所示[pOH=-lgc(OH-)],下列叙述正确的是  A、曲线X表示pOH与-lg的关系 B、Na2A溶液中,c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-) C、溶液显中性时,c(H2A)>c(A2-) D、当V(HCl)=10mL时,c(HA-)+2c(H2A)+3c(H3A+)+c(H+)=c(OH-)+c(Cl-)
A、曲线X表示pOH与-lg的关系 B、Na2A溶液中,c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-) C、溶液显中性时,c(H2A)>c(A2-) D、当V(HCl)=10mL时,c(HA-)+2c(H2A)+3c(H3A+)+c(H+)=c(OH-)+c(Cl-)
二、非选择题
-
15. 磷酸亚铁锂(化学式:LiFePO4),为近年来新开发的锂离子电池电极材料,主要用于动力锂离子电池,作为电极活性物质使用,能可逆地嵌入、脱出锂,其作为锂离子电池电极材料的研究及应用得到广泛关注。通过水热法制备磷酸亚铁锂的一种方法如图(装置如图所示,夹持装置、加热装置等省略未画出):
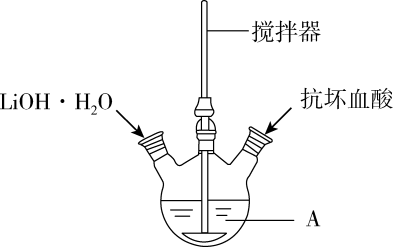
制备步骤:
I.在仪器A中加入40mL蒸馏水、0.01molH3PO4和0.01molFeSO4•7H2O,用搅拌器搅拌溶解后,缓慢加入0.03molLiOH•H2O,继续搅拌。
II.向反应液中加入少量抗坏血酸(维生素C),继续搅拌5min。
III.快速将反应液装入反应釜中,保持170℃恒温5h。
IV.冷却至室温,过滤。
V.用蒸馏水洗涤沉淀。
VI.干燥,得到磷酸亚铁锂产品。
回答下列问题:
(1)、装置图中仪器A的名称是 , 根据上述实验药品的用量,A的最适宜规格为(填标号)。A.50mL B.100mL C.250mL D.500mL
(2)、步骤II中,抗坏血酸的作用是 , 以下能代替抗坏血酸使用的是(填标号)。A.Na2SO3 B.铁粉 C.酸性高锰酸钾溶液
(3)、若所加H3PO4、FeSO4•7H2O、LiOH•H2O恰好完全反应,请写出制备磷酸亚铁锂的化学方程式:。(4)、确定所得产品中未混有Fe(OH)3、FePO4杂质的方法是。(5)、干燥后称量,若实验共得到无杂质产品1.1g,则LiFePO4的产率为%(保留小数点后一位)。(6)、某种以LiFePO4作电极材料的锂电池总反应可表示为LiFePO4+CLi1-xFePO4+CLix。放电时正极的电极反应式为。 -
16. 锗(Ge)是门捷列夫在1871年所预言的元素“亚硅”,高纯度的锗已成为目前重要的半导体材料,其化合物在治疗癌症方面也有着独特的功效。如图是以锗锌矿(主要成分为GeO2、ZnS,另外含有少量的Fe2O3等)为主要原料生产高纯度锗的工艺流程:

已知:GeO2可溶于强碱溶液,生成锗酸盐;GeCl4的熔点为-49.5℃,沸点为84℃,在水中或酸的稀溶液中易水解。
(1)、Ge在元素周期表中的位置是 , GeCl4晶体所属类别是。(2)、步骤①NaOH溶液碱浸时发生的离子反应方程式为。(3)、步骤③沉锗过程中,当温度为90℃,pH为14时,加料量(CaCl2/Ge质量比)对沉锗的影响如表所示,选择最佳加料量为(填“10-15”“15-20”或“20-25”)。编号
加料量(CaCl2/Ge)
母液体积(mL)
过滤后滤液含锗(mg/L)
过滤后滤液pH
锗沉淀率(%)
1
10
500
76
8
93.67
2
15
500
20
8
98.15
3
20
500
2
11
99.78
4
25
500
1.5
12
99.85
(4)、步骤⑤中选择浓盐酸而不选择稀盐酸的原因是。(5)、步骤⑥的化学反应方程式为。(6)、Ge元素的单质及其化合物都具有独特的优异性能,请回答下列问题:①量子化学计算显示含锗化合物H5O2Ge(BH4)3具有良好的光电化学性能。CaPbI3是H5O2Ge(BH4)3的量子化学计算模型,CaPbI3的晶体结构如图所示,若设定图中体心钙离子的分数坐标为( , , ),则分数坐标为(0,0,)的离子是。

②晶体Ge是优良的半导体,可作高频率电流的检波和交流电的整流用。如图为Ge单晶的晶胞,设Ge原子半径为rpm,阿伏加德罗常数的值为NA , 则该锗晶体的密度计算式为(不需化简)ρ=g/cm3。

-
17. 高纯度的氢氟酸是制造芯片的重要原料之一。(1)、已知:HF(aq)⇌H+(aq)+F-(aq) ΔH=-10.4kJ/mol
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol
则:HF(aq)+NaOH(aq) =NaF(aq) +H2O(l)的ΔH=。
(2)、HF无论是气态还是在水溶液中均可二聚形成(HF)2。HF能二聚的原因是 , 写出(HF)2发生第二步电离的电离方程式。(3)、如图为恒温、带有可自由移动隔板的刚性容器。当两边分别充入4g氦气和20g单分子态的HF气体时,隔板位于“5”处,隔板两边容器内的压强均为100kPa。
若固定隔板于“5”处,当右侧容器内反应2HF(g)⇌(HF)2(g)达到平衡状态时,右侧容器内压强为P1;松开隔板,隔板移至“6”处并达到新的平衡,此时右侧容器内压强为P2 , 则P1P2(填“大于”“小于”或“等于”)。该温度下,2HF(g)⇌(HF)2(g) 反应的平衡常数KP=kPa-1(KP为以分压表示的平衡常数,计算结果保留2位有效数字)。
(4)、若将上述容器改为绝热容器,固定隔板在“5”处,下列不能说明右侧容器内反应已达平衡状态的是____。A、容器右侧气体的密度不再改变 B、容器右侧的温度不再改变 C、容器右侧气体的压强不再改变 D、容器右侧气体的平均相对分子质量不再改变 E、(5)、某温度下,将分析浓度(总浓度)相同的HCl、HF和CH3COOH三种溶液,分别加水稀释时,溶液pH变化如图所示。
图中,氢氟酸溶液在稀释初期的pH上升特别快,据此判断,(HF)2与HF的酸性相比,较强的是。
(6)、NaF和HF的混合溶液具有一定的缓冲能力,即加入少量的酸或碱时,溶液的pH基本保持不变。试结合方程式和必要的文字解释之。 -
18. 利托那韦是一种疗效高、可替代性强的治疗艾滋病的蛋白酶抑制剂,合成利托那韦两种重要中间体
 和
和 的具体反应路线为:
的具体反应路线为:
I.
 的合成;
的合成;
II.
 的合成:
的合成:①

②

已知:

 ;R-OHR-Cl。
;R-OHR-Cl。根据以上信息回答下列问题:
(1)、化合物E的含氧官能团名称为 , L→M的反应类型是。(2)、用系统命名法给化合物F命名: , 写出F在盐酸溶液中加热生成的有机产物的结构简式:。(3)、写出H→I的化学方程式:。(4)、K和I反应生成L和N,请写出N的结构简式:。(5)、化合物Q是一种芳香酯,Q为D的同分异构体。已知Q含-NO2、可以发生银镜反应,则Q的可能结构有种。(6)、设计由 、HOCH2CH2NH2、
、HOCH2CH2NH2、 为原料(其他试剂任选),制备
为原料(其他试剂任选),制备 的合成路线。
的合成路线。
