甘肃省武威市2023届高三第一次联考理综化学试题
试卷更新日期:2023-03-14 类型:高考模拟
一、单选题
-
1. 化学与生产、生活、科技及环境等密切相关。下列说法正确的是A、侯氏制碱法应在饱和食盐水中先通二氧化碳再通氨气 B、大气中PM2.5比表面积大,吸附能力强,能吸附许多有毒有害物质 C、工业上用电解熔融氯化钠和熔融氧化镁的方法,来制备金属钠和镁 D、食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是防止食品氧化变质2. 《本草纲目》中记载:“看药上长起长霜,则药已成矣。”其中“长霜”代表棓酸的结晶物,棓酸(只含C、H、O)的球棍模型如图所示。下列有关棓酸的说法错误的是
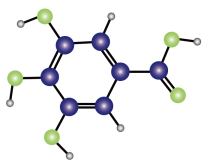 A、能发生加成反应和取代反应 B、能与溶液反应 C、分子式为 D、苯环上只有一种一氯代物3. 下列实验符合题意且能达到实验目的的是
A、能发生加成反应和取代反应 B、能与溶液反应 C、分子式为 D、苯环上只有一种一氯代物3. 下列实验符合题意且能达到实验目的的是 A、图A是制取并收集氨气 B、图B是还原氧化铜 C、图C是检验绿矾溶液是否变质 D、图D是制备少量氢气4. 设为阿伏加德罗常数的值。接触法制备硫酸的原理:(1);(2);(3)。下列说法正确的是A、的硫酸溶液中含的数目为 B、反应(2)中和反应放出热量时生成分子的数目为 C、 , 则 D、反应(1)中生成转移的电子数为5. 三室膜电渗析分离硫酸锂并回收酸碱的装置示意图如图,下列说法正确的是
A、图A是制取并收集氨气 B、图B是还原氧化铜 C、图C是检验绿矾溶液是否变质 D、图D是制备少量氢气4. 设为阿伏加德罗常数的值。接触法制备硫酸的原理:(1);(2);(3)。下列说法正确的是A、的硫酸溶液中含的数目为 B、反应(2)中和反应放出热量时生成分子的数目为 C、 , 则 D、反应(1)中生成转移的电子数为5. 三室膜电渗析分离硫酸锂并回收酸碱的装置示意图如图,下列说法正确的是 A、酸碱的浓度:进等于出 B、右侧电极的电极反应式为 C、装置工作一段时间后, D、右侧离子交换膜为阴离子交换膜6. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是电子层数的3倍,元素Y、Z、W互不相邻但位于同周期,且Y、Z的最外层电子数之和等于W的最外层电子数,W在同周期中原子半径最小。下列叙述错误的是A、原子半径的大小顺序: B、元素X的简单气态氢化物的热稳定性比Z的强 C、元素W的最高价氧化物对应水化物的酸性比Z的弱 D、Z、W形成的化合物中各原子最外层电子均满足8电子稳定结构7. 常温下,向的二元酸溶液中逐滴加入等浓度的溶液,溶液的与离子浓度变化的关系如图所示,下列说法正确的是
A、酸碱的浓度:进等于出 B、右侧电极的电极反应式为 C、装置工作一段时间后, D、右侧离子交换膜为阴离子交换膜6. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是电子层数的3倍,元素Y、Z、W互不相邻但位于同周期,且Y、Z的最外层电子数之和等于W的最外层电子数,W在同周期中原子半径最小。下列叙述错误的是A、原子半径的大小顺序: B、元素X的简单气态氢化物的热稳定性比Z的强 C、元素W的最高价氧化物对应水化物的酸性比Z的弱 D、Z、W形成的化合物中各原子最外层电子均满足8电子稳定结构7. 常温下,向的二元酸溶液中逐滴加入等浓度的溶液,溶液的与离子浓度变化的关系如图所示,下列说法正确的是 A、曲线I表示与的关系 B、滴入溶液至中性: C、的平衡常数 D、时,混合溶液呈碱性
A、曲线I表示与的关系 B、滴入溶液至中性: C、的平衡常数 D、时,混合溶液呈碱性二、非选择题
-
8. 实验室采用高温加热三氟化硼()与氯化铝()的方法制备 , 装置如图所示(夹持装置及加热装置略),已知与均易与水反应,沸点低、易升华。

部分物质的沸点如表所示:
物质
沸点/℃
12.5
180
回答下列问题:
(1)、仪器a的名称为。(2)、氟硼酸钾()中B元素的化合价为。实验中滴入浓硫酸并加热装置A,除产生气体外,还生成一种酸式盐,写出反应的化学方程式:。(3)、装置F的作用为。(4)、实验开始时,A、C两处加热装置应先加热A处,原因是。(5)、装置D采用的是或 (填“水浴加热”或“冷水浴”)。(6)、产品中氯元素含量的测定:称取样品置于蒸馏水中完全水解,并配成溶液,量取于锥形瓶中,向其中加入溶液使充分沉淀,加入一定量硝基苯用力振荡,静置后,滴加几滴溶液,用标准溶液滴定至溶液变为红色且半分钟内不褪色,消耗标准溶液的体积为 , 则产品中氯元素含量为 (列出计算式即可)。(已知:)9. 中国是世界上最大的钨储藏国。以黑钨精矿(主要成分为、 , 含少量)为原料冶炼钨的流程如图所示:
已知:钨酸酸性很弱,钨酸和均难溶于水;时,和开始沉淀的分别为10.3和7.3,完全沉淀的分别为8和5。
回答下列问题:
(1)、“粉碎”的目的是;“粉碎”后的黑钨矿粒径约为 , 往其中加入浸取液后形成的分散系属于。(2)、同浓度的硅酸根离子比钨酸根离子结合质子的能力 (填“强”或“弱”)。(3)、写出在“焙烧"”条件下与纯碱、空气反应生成的化学方程式:。(4)、“滤液I”调节应选择的试剂为 (填标号),调节的范围为。A.氨水 B. C.稀硫酸 D.
(5)、常温下, , 常温下,向溶液中不断加入石灰乳,当溶液的时,。(6)、目前,冶炼拉制钨丝的金属钨,都用组成为非整比的钨氧化物为原料,这种氧化钨中存在+5价和+6价两种价态的钨。试确定组成为的氧化钨中+5价和+6价的钨原子数之比等于。10. 丙烯是制备聚丙烯塑料的单体,工业上可用丙烷和制取丙烯:反应1:。
反应2:。
回答下列问题
(1)、反应3:。(2)、向恒温恒容密闭容器中充入和 , 只发生反应3,不能说明反应3达到平衡状态的是____ (填标号)。A、混合气体密度不随时间变化 B、混合气体总压强不随时间变化 C、混合气体平均相对分子质量不随时间变化 D、丙烷的消耗速率等于丙烯的生成速率(3)、向密闭容器中充入只发生反应1,测得速率方程为(k为速率常数,只与温度、催化剂有关)。已知:(R、C为常数,T为温度,为活化能)。实验测得其他条件相同,不同催化剂、对速率常数的影响如图1所示。其中,催化效能较高的是(填“”或“”),判断的依据是。 (4)、向密闭容器中充入和 , 发生上述反应1和反应2,测得丙烷的平衡转化率与温度、压强的关系如图2所示。
(4)、向密闭容器中充入和 , 发生上述反应1和反应2,测得丙烷的平衡转化率与温度、压强的关系如图2所示。
①X代表(填“温度”或“压强”),(填“>”、“”或“=”)。
②M点时,和的浓度相等。则M点对应的反应2的平衡常数。
(5)、向总压强恒定为的密闭容器中充入和 , 只发生反应1,的平衡转化率与的关系如图3所示。其他条件不变,随着增大,的平衡转化率减小,其原因是 , 当等于2时,经达到平衡,丙烯的分压变化速率为。 11. 我国科学家利用锰簇催化剂( , x代表氧原子数)解密光合作用。锰簇的可逆结构异构化反应如图。
11. 我国科学家利用锰簇催化剂( , x代表氧原子数)解密光合作用。锰簇的可逆结构异构化反应如图。
请回答下列问题:
(1)、基态氧原子价层电子轨道表示式为。基态钙原子中能量最高的电子所占据原子轨道的电子云轮廓图为形。(2)、已知:在元素周期表中相邻。第二电离能与第一电离能之差较小的是 (填“”或“”),理由是。(3)、在上述异构化反应中,中由形成的键有。(4)、晶胞与晶胞属于同种类型,晶胞结构如图所示。
①原子位于S原子形成的(填“正四面体”或“正八面体”)中心。
②以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在晶胞坐标系中,1号S原子坐标为 , 3号S原子坐标为 , 则2号S原子坐标为。
③已知:晶体的密度为 , 为阿伏加德罗常数的值。则晶胞中阴、阳离子最近距离为。
12. 化合物H( )是合成某治疗心脑血管疾病药物的中间体,合成H的常用方法如图:
)是合成某治疗心脑血管疾病药物的中间体,合成H的常用方法如图:
已知:①

②



请回答下列问题:
(1)、化合物H的分子式为 , E中的含氧官能团有种。(2)、A→B的反应类型为 , 溴代烃X的名称为。(3)、化合物F的结构简式为 , 反应C→D的化学方程式为。(4)、同时满足下列条件的D的同分异构体有种(不考虑立体异构)。①能发生水解反应 ②能与溶液发生显色反应
其中谱显示分子中含有4种氢原子的结构简式为(写出一种即可)。
(5)、设计以甲苯、乙酸酐为原料合成阿司匹林( )的路线 (无机试剂任选)。
)的路线 (无机试剂任选)。