2022-2023人教版九年级化学 第十单元 酸和碱 实验活动6 酸、碱的化学性质 课时提高训练
试卷更新日期:2023-03-09 类型:同步测试
一、单选题
-
1. 如图所示装置,将X滴加到Y中,U形管中的液面变得左高低右,则X、Y对应的试剂组可行的是( )
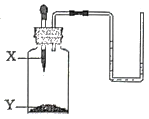
选项试剂
A
B
C
D
X
H2O
H2O
H2O
盐酸
Y
NaOH
NH4NO3
生石灰
Na2CO3
A、A B、B C、C D、D2. 稀盐酸是化学实验中常用的试剂,但下列实验中,不宜使用稀盐酸的是( )A、除去氯化钠溶液中的碳酸钠 B、除去铜粉中混有的铁粉 C、除去熟石灰中的石灰石 D、除去铁丝上的铁锈3. 检验某溶液是否为酸溶液,下列四种方案中错误的是( )A、向该溶液中滴加碳酸钠溶液,看是否有气泡产生 B、向该溶液中滴加紫色石蕊溶液,看是否变红 C、向该溶液中滴加无色酚酞溶液,看是否变色 D、向该溶液中加锌粒,看是否有气泡产生4. 下列物质敞口放置一段时间后,物质质量增加且变质的是①生石灰 ②浓硫酸 ③氢氧化钠 ④食盐水 ⑤浓盐酸 ⑥石灰水
A、①③⑥ B、②③④ C、①④⑤ D、①②③⑥5. 向盛有1mL稀盐酸的试管中滴入2滴紫色石蕊试液,再逐滴加入氢氧化钠溶液,边滴加边振荡,一直到氢氧化钠溶液过量.试管内溶液的颜色变化情况是A、无色、红色、紫色、蓝色 B、无色、蓝色、紫色、红色 C、无色、蓝色、紫色、无色 D、无色、红色、紫色、无色6. 下列实验设计能达到目的的是( )A、用湿润的pH试纸测定肥皂水的pH B、用肥皂水鉴别蒸馏水和硬水 C、用湿润的蓝色石蕊试纸检验NH3 D、用浓硫酸除去NH3中的水蒸气7. 若用表达式“H2SO4+X→盐+Y”归纳总结稀硫酸的化学性质,观点正确的是( )选项
X的物质类别
稀硫酸的性质描述
A
金属
若X为Cu,则Y一定为H2
B
金属氧化物
若X为Fe2O3 , 则盐一定为FeSO4
C
碱
Y一定为H2O
D
盐
生成的盐一定为白色沉淀
A、A B、B C、C D、D8. 比较推理是化学学习中常用的思维方法,下列有关物质的比较推理中正确的是( )A、酸能使紫色石蕊溶液变红,通入后的紫色石蕊溶液变红,所以 是酸 B、氧化物含有氧元素,但含氧元素的化合物不一定是氧化物 C、在同一化合物中,金属元素显正价,所以非金属元素一定显负价 D、氢氧化铝可以治疗胃酸过多,所以氢氧化钠也可以治疗胃酸过多9. 某学校运动会上,学生在进行化学越野赛。如图所示,某同学携带着稀盐酸逆时针奔跑,若稀盐酸分别能与各个红旗点的物质发生反应,就能跑向下一个红旗点。下列说法错误的是( ) A、若②是铁,稀盐酸与其反应后,溶液呈现浅绿色 B、若③是氧化铜,稀盐酸与其反应后,溶液的质量增加 C、若④是碳酸钠,要检验该反应中稀盐酸是否过量,可选取的试剂为硝酸银溶液 D、若⑤是氢氧化钠,稀盐酸与其充分反应后,所得无色溶液中最多有2种溶质10. 有关酸的性质叙述正确的是( )A、酸碱中和反应会放出热量 B、酸与盐的反应都会放出气体 C、酸溶液能使紫色石蕊试液变蓝 D、酸能与所有金属反应,生成氢气
A、若②是铁,稀盐酸与其反应后,溶液呈现浅绿色 B、若③是氧化铜,稀盐酸与其反应后,溶液的质量增加 C、若④是碳酸钠,要检验该反应中稀盐酸是否过量,可选取的试剂为硝酸银溶液 D、若⑤是氢氧化钠,稀盐酸与其充分反应后,所得无色溶液中最多有2种溶质10. 有关酸的性质叙述正确的是( )A、酸碱中和反应会放出热量 B、酸与盐的反应都会放出气体 C、酸溶液能使紫色石蕊试液变蓝 D、酸能与所有金属反应,生成氢气二、填空题
-
11. 盛石灰水的试剂瓶内壁常有一层白色的固体物质很难用水洗掉,那么生成该物质有关反应的化学方程式是 , 清洗该物质的方法是。12. 某同学进行化学实验时将生锈的铁钉放入到足量的稀盐酸中,他首先看到了 , 其发生反应的方程式为 , 过了一段时间后,他又看到 , 其发生反应的方程式为。13. 盐酸是重要的化工原料,也是实验室中最常用的化学试剂之一。(1)、用质量分数为37%的浓盐酸配制1000g质量分数为0.37%(pH约为1)的稀盐酸。
①所配稀盐酸中溶质的质量为g,所需浓盐酸的质量为g。
②已知浓盐酸密度为1.19g/cm3 , 量取上述所需浓盐酸用到的仪器是(填标号)。
A、10mL量筒
B、50mL量筒
C、试管
D、胶头滴管
③测定所配稀盐酸的酸碱度,应将pH试纸放置在上。
(2)、取少量氢氧化钙粉末于试管中,加入2mL水,振荡,得到白色浑浊液,滴加1滴酚酞溶液,再滴加稀盐酸至反应完全,可观察到的现象是。(3)、取等质量的铁片和铁粉放入两支试管中,分别加入相同体积相同浓度的稀盐酸。①铁与稀盐酸反应的化学方程式为。
②下列示意图中,与实验结果相符的是(填标号)。
 14. 溶液的酸碱度可以用pH表示,当pH7时,溶液呈酸性,且pH越小,酸性越 , pH =13时,溶液呈性。紫色石蕊溶液遇性溶液变蓝,某溶液滴加无色酚酞溶液不变色,该溶液呈性。15.(1)、请按要求将下列各组物质的化学式填写到横线上(每空填一个):
14. 溶液的酸碱度可以用pH表示,当pH7时,溶液呈酸性,且pH越小,酸性越 , pH =13时,溶液呈性。紫色石蕊溶液遇性溶液变蓝,某溶液滴加无色酚酞溶液不变色,该溶液呈性。15.(1)、请按要求将下列各组物质的化学式填写到横线上(每空填一个):A熟石灰 B氯化钠 C氢氧化钠 D稀盐酸 E碳酸钠
①改良酸性土壤,配制波尔多液的是;
②侯氏制碱法中的“碱”是;
③可用来除去热水瓶中水垢的是;
(2)、进行如图实验,研究物质的性质。
①能产生气泡的是(填序号)。
②能证明C中发生反应的现象是。
③E烧杯中的物质与稀盐酸反应的化学方程式。
三、简答题
-
16. 200g某硫酸溶液恰好与5.6g铁完全反应。试计算:(1)、这种硫酸溶液中溶质的质量分数。(2)、反应后所得溶液中溶质的质量分数。17. 某同学在实验时发现一瓶装有氢氧化钠溶液的试剂瓶口有白色粉末,他推测该白粉末可能是残留在瓶口的氢氧化钠变质形成的新物质。(1)、为验证自己的推测,他进行了下列实验:取少量白色粉末滴加稀盐酸,有气泡产生。上述实验能否说明氢氧化钠变质了?理由是什么?(2)、为进一步探究该白色粉末中是否含有氢氧化钠,还需做什么实验?请写出简要的实验步骤。
四、综合题
-
18. 利用你学过的化学知识解决下列问题:(1)、物质的保存
①浓硫酸、浓盐酸应当密封保存,原因是。
②铁桶能存放氢氧化钠溶液,不能存放稀盐酸。原因是(用方程式表示)。
(2)、物质的使用①盐酸常用于除去铁制品表面的锈,反应的化学方程式是。使用盐酸时要小心,不小心溅到了手上,应当立即 , 再涂上3%-5%的碳酸氢钠溶液。
②下列物质中可用作治疗胃酸过多的胃药有(填序号)。
A.Al(OH)3 B.CaCO3粉末 C.NaCl D.NaOH E.CuO
写出上述胃药中碱与胃酸反应的化学方程式 , 选择一种不能治疗胃酸过多的物质,说明不能使用的理由。
五、实验探究题
-
19. 无土栽培是一种新型农业生产技术。无土栽培的重要物质是植物生长营养液,鹏鹏从家中拿来一瓶用于种植甜瓜的浓缩营养液(无色),大家一起对这种营养液展开了研究。已知该浓缩营养液的配方如下:
营养液A
营养液B
肥料名称
硝酸钙
硝酸钾
磷酸二氢铵
硫酸镁
溶质的质量分数(%)
9.45
8.08
1.53
4.93
(1)、活动一:检验营养液的酸碱性【收集证据】
1组同学测定营养液A的pH,操作是 , 测得其pH7(填“>”“<”或“=”),证明营养液A呈中性。
(2)、2组同学取少量营养液B于试管中,向其中滴加无色酚酞溶液,观察到 , 证明营养液B呈酸性。【质疑评价】鹏鹏对2组同学的结论产生了质疑,理由是。为证明2组同学的结论正确,应将操作方法修改为。
(3)、活动二:分析营养液的使用方法【分析交流】浓缩营养液不能直接用于蔬菜种植,需加水稀释:取营养液Al0g,向其中加入990g水,稀释后溶液中溶质的质量分数是%,稀释过程中用到的玻璃仪器有:烧杯、量筒、。
(4)、活动三:研究营养液的结晶原因同学们进行完上述活动后,将剩余的营养液A敞口放在窗外,儿天后打扫卫生时发现,营养液A中出现了少量晶体,这是为什么呢?
【查阅资料】硝酸钙在不同温度下的溶解度如下表所示:
温度℃
0
10
20
30
40
50
溶解度/g
102
115
129
138
149
189
【小组讨论】原营养液A属于硝酸钙的溶液(填“饱和”或“不饱和”)。将其敞口放在窗外,出现晶体的原因可能是。
20. 归纳是学习化学的重要方法,小明用图 1 总结了酸的五条化学性质,请回答下列问题:
 (1)、稀盐酸和稀硫酸具有相似的化学性质,是因为它们的水溶液中都含有(填离子符号);(2)、醋酸是生活中常见的酸,将醋酸滴入紫色石蕊溶液中,观察到 , 由此能验证酸的性质Ⅰ;(3)、将生锈的铁钉放入足量的稀硫酸中,可以观察到铁锈慢慢溶解,该反应的化学 方程式为 , 将生锈的铁钉长时间浸泡后,还能观察到铁钉表面会产生 , 由此能验证酸的性质Ⅱ和Ⅲ;(4)、为了验证性质Ⅴ,小明进行了如图 2 所示实验,当观察到溶液由红色变为无色, 说明氢氧化钠和盐酸发生了化学反应,该反应的化学反应方程式。实验后,小明对得到的无色溶液中溶质的成分产生了兴趣,并进行了实验探究:(5)、【提出问题】反应后得到的无色溶液中溶质的成分是什么?
(1)、稀盐酸和稀硫酸具有相似的化学性质,是因为它们的水溶液中都含有(填离子符号);(2)、醋酸是生活中常见的酸,将醋酸滴入紫色石蕊溶液中,观察到 , 由此能验证酸的性质Ⅰ;(3)、将生锈的铁钉放入足量的稀硫酸中,可以观察到铁锈慢慢溶解,该反应的化学 方程式为 , 将生锈的铁钉长时间浸泡后,还能观察到铁钉表面会产生 , 由此能验证酸的性质Ⅱ和Ⅲ;(4)、为了验证性质Ⅴ,小明进行了如图 2 所示实验,当观察到溶液由红色变为无色, 说明氢氧化钠和盐酸发生了化学反应,该反应的化学反应方程式。实验后,小明对得到的无色溶液中溶质的成分产生了兴趣,并进行了实验探究:(5)、【提出问题】反应后得到的无色溶液中溶质的成分是什么?【猜想与假设】猜想一:酚酞、NaCl;猜想二:酚酞、NaCl、(填化学式);
(6)、【实验探究】取少量光亮的镁条于试管中,向其中加入少量反应后的无色溶液,观察到的现象是 , 可推断猜想一成立;(7)、【查阅资料】 Cu(OH)2 是一种蓝色、不溶于水的碱;【反思与评价】小明认为还可以用其它物质来检验无色溶液中溶质的成分。该物质可以是下列物质中的____(字母填序号)。
A、紫色石蕊溶液 B、Cu C、CuO D、Na2CO3 E、Cu(OH)2
-