广东省深圳市2022-2023学年高三第一次调研考试化学试题
试卷更新日期:2023-03-08 类型:高考模拟
一、单选题
-
1. 服饰文化是中华传统文化中的重要一脉。下列制作服饰所用原料的主要成分为纤维素的是A、
 蚕丝
B、
蚕丝
B、 棉花
C、
棉花
C、 皮革
D、
皮革
D、 羊毛
2. 广东省海洋资源丰富。下列有关说法正确的是A、海底石油经裂化和裂解可得不饱和烃 B、海带等藻类植物中富含 C、潮汐能属于生物质资源 D、“海水晒盐”时主要发生化学变化3. 近年来,我国科技迅猛发展。下列科技成果中蕴含的化学知识叙述正确的是A、新型手性螺环催化剂能降低化学反应的焓变 B、DNA存储技术中用于编码的DNA是核糖核酸 C、建造港珠澳大桥所采用的高强抗震螺纹钢属于合金 D、“天舟五号”飞船搭载的燃料电池放电时主要将热能转化为电能4. 化学实验是化学探究的一种重要途径。下列有关实验的描述正确的是A、用湿润的蓝色石蕊试纸检验 B、中学实验室中,可将未用完的钠放回原试剂瓶 C、进行焰色试验时,可用玻璃棒替代铂丝 D、酸碱中和滴定实验中,应先用待测液润洗锥形瓶5. 劳动创造幸福。下列劳动项目与所述的化学知识没有关联的是
羊毛
2. 广东省海洋资源丰富。下列有关说法正确的是A、海底石油经裂化和裂解可得不饱和烃 B、海带等藻类植物中富含 C、潮汐能属于生物质资源 D、“海水晒盐”时主要发生化学变化3. 近年来,我国科技迅猛发展。下列科技成果中蕴含的化学知识叙述正确的是A、新型手性螺环催化剂能降低化学反应的焓变 B、DNA存储技术中用于编码的DNA是核糖核酸 C、建造港珠澳大桥所采用的高强抗震螺纹钢属于合金 D、“天舟五号”飞船搭载的燃料电池放电时主要将热能转化为电能4. 化学实验是化学探究的一种重要途径。下列有关实验的描述正确的是A、用湿润的蓝色石蕊试纸检验 B、中学实验室中,可将未用完的钠放回原试剂瓶 C、进行焰色试验时,可用玻璃棒替代铂丝 D、酸碱中和滴定实验中,应先用待测液润洗锥形瓶5. 劳动创造幸福。下列劳动项目与所述的化学知识没有关联的是选项
劳动项目
化学知识
A
分析员用X射线衍射仪区分普通玻璃和水晶
普通玻璃属于非晶体,水晶属于晶体
B
面点师制作糕点时添加小苏打作膨松剂
可与碱反应
C
实验员用加热法分离和NaCl
易升华
D
维修工用NaOH和铝粉疏通厨卫管道
Al与NaOH溶液反应产生
A、A B、B C、C D、D6. “结构决定性质”是化学学科的核心观念。下列有关性质的比较正确的是A、在水中的溶解度:戊醇<乙醇 B、熔点:MgO<CaO C、硬度:金刚石<碳化硅<硅 D、第一电离能:Cl<P<S7. 利用如图所示装置进行的制备及性质探究实验时,下列说法错误的是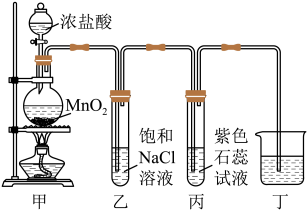 A、甲中反应的氧化剂与还原剂的物质的量之比为1∶4 B、乙的作用为除去中的HCl C、丙中紫色石蕊试液先变红后褪色 D、为吸收多余的 , 丁中可盛放NaOH溶液8. 谷氨酸单钠是味精的主要成分,利用发酵法制备该物质的流程如下:
A、甲中反应的氧化剂与还原剂的物质的量之比为1∶4 B、乙的作用为除去中的HCl C、丙中紫色石蕊试液先变红后褪色 D、为吸收多余的 , 丁中可盛放NaOH溶液8. 谷氨酸单钠是味精的主要成分,利用发酵法制备该物质的流程如下:
下列说法错误的是
A、可用碘水检验淀粉是否完全水解 B、可用红外光谱仪测定谷氨酸中所含官能团的种类 C、1mol谷氨酸中含有手性碳原子的数目约为 D、“中和”时,需要严格控制的用量9. 化学在环境污染治理中发挥了重要作用。下列治理措施没有运用相应化学原理的是选项
治理措施
化学原理
A
向燃煤中添加生石灰以减少酸雨的形成
CaO具有碱性氧化物的通性
B
在汽车尾气系统中安装催化转化器以减少尾气污染
CO和NO在催化剂作用下发生反应,生成无毒气体
C
用聚乳酸塑料替代传统塑料以减少白色污染
聚乳酸具有生物可降解性
D
向工业废水中添加FeS以除去废水中的
FeS具有还原性
A、A B、B C、C D、D10. 法国科学家莫瓦桑在无水HF中电解制得单质氟(),获得1906年诺贝尔化学奖。下列关于该过程的描述错误的是A、阳极上发生氧化反应 B、阴极反应为 C、需将电解产生的两种气体严格分开 D、理论上,每转移 , 可得到(标准状况下)11. 含硫化合物的反应具有多样性。下列有关反应的离子方程式书写错误的是A、用溶液吸收废气: B、海水提溴工艺中用还原: C、用溶液处理锅炉水垢中的: D、将S与溶液混合加热制备:12. 下列实验操作能达到相应实验目的的是选项
实验操作
实验目的
A
向肉桂醛(
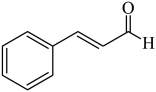 )中加入酸性溶液
)中加入酸性溶液验证肉桂醛中含碳碳双键
B
向待测液中先滴加氯水,再滴加KSCN溶液
检验溶液中是否含有
C
用pH试纸分别测定等浓度的溶液和NaClO溶液的pH
比较和HClO的酸性强弱
D
常温常压下,向两份相同锌粒中,分别加入体积相同、浓度不同的稀硫酸,记录收集相同体积所需的时间
探究浓度对化学反应速率的影响
A、A B、B C、C D、D13. X、Y、Z、W、Q为原子序数依次递增的短周期主族元素。基态X原子价电子层有3个单电子,Z与Y可形成原子个数比为1∶1的含非极性共价键的离子化合物。W、Q的最外层电子数之和等于Z的原子序数。下列说法正确的是A、简单离子半径:Z>Y B、X、W单质的晶体类型一定相同 C、简单气态氢化物的稳定性:X>Y D、Q的最高价含氧酸根的空间结构为正四面体形14. 恒容密闭容器中,与在不同温度下发生反应: , 达到平衡时,各组分的物质的量浓度(c)随温度(T)变化如图所示: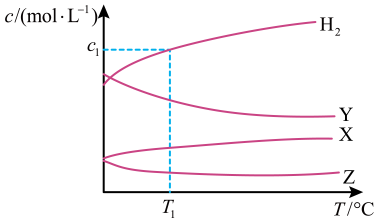
下列说法正确的是
A、该反应的平衡常数随温度升高而增大 B、曲线Y表示随温度的变化关系 C、提高投料比 , 可提高的平衡转化率 D、其他条件不变,与在℃下反应,达到平衡时15. 一种可充电锌-空气电池放电时的工作原理如下图所示。已知:I室溶液中,锌主要以的形式存在,并存在。下列说法正确的是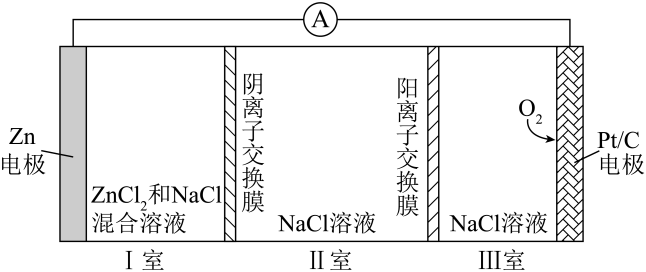 A、放电时,I室溶液pH增大 B、放电时,该装置II室可实现海水淡化 C、充电时,Zn电极反应为 D、充电时,每生成 , III室溶液质量理论上减少32g16. 常温下,乙二胺的水溶液中,、和的分布分数与pH的关系如图所示。已知:。
A、放电时,I室溶液pH增大 B、放电时,该装置II室可实现海水淡化 C、充电时,Zn电极反应为 D、充电时,每生成 , III室溶液质量理论上减少32g16. 常温下,乙二胺的水溶液中,、和的分布分数与pH的关系如图所示。已知:。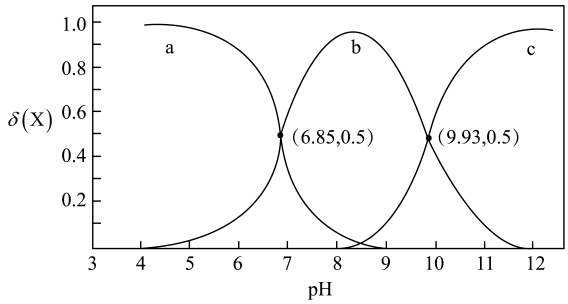
下列说法错误的是
A、溶液显酸性 B、曲线b可表示 C、的平衡常数 D、溶液中:二、综合题
-
17. 某学习小组将Cu与的反应设计为原电池,并进行相关实验探究。回答下列问题:(1)、I.实验准备
稀硫酸的配制
①配制的溶液,需溶液的体积为mL。
②在实验室配制上述溶液的过程中,下图所示仪器,需要用到的是(填仪器名称)。
 (2)、Cu与在酸性条件下反应的离子方程式为。(3)、II.实验探究
(2)、Cu与在酸性条件下反应的离子方程式为。(3)、II.实验探究【实验任务】利用相关原电池装置进行实验,探究物质氧化性或还原性的影响因素。
【查阅资料】其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大。
【进行实验】
利用下表所示装置进行实验1~4,记录数据。
装置
实验序号
烧杯中所加试剂
电压表读数
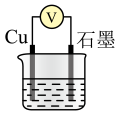
30%
1
30.0
/
10.0
2
30.0
1.0
9.0
3
30.0
2.0
8.0
4
35.0
1.0
已知:本实验条件下,对电压的影响可忽略。
①根据表中信息,补充数据:。
②由实验2和4可知,(填“大于”或“小于”或“等于”),说明其他条件相同时,溶液的浓度越大,其氧化性越强。
(4)、由(3)中实验结果 , 小组同学对“电压随pH减小而增大”可能的原因,提出了以下两种猜想:猜想1:酸性条件下,的氧化性随pH减小而增强。
猜想2:酸性条件下,Cu的还原性随pH减小而增强。
为验证猜想,小组同学在(3)中实验1~4的基础上,利用下表装置进行实验5~-7,并记录数据。
装置
实验序号
操作
电压表读数
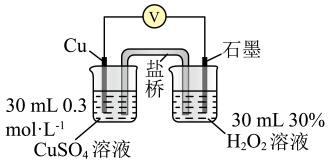
5
/
6
①向(填“左”或“右”)侧烧杯中滴加溶液。
7
向另一侧烧杯中滴加溶液
②实验结果为:、 , 说明猜想2不成立,猜想1成立。
(5)、已知Cu与反应时,加入氨水可形成深蓝色的。小组同学利用(4)中实验5的装置继续探究,向左侧烧杯中滴加5.0mL一定浓度的氨水,相比实验5,电压表读数增大,分析该电压表读数增大的原因:。【实验结论】物质的氧化性(或还原性)强弱与其浓度、pH等因素有关。
三、综合题
-
18. 铋及其化合物广泛应用于电子材料、医药等领域。一种以含铋烧渣(主要成分为、 , 还含有少量MnS、、CuO及等)制取并回收锰的工艺流程如下:
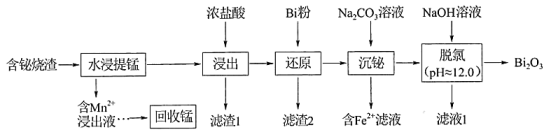
已知:①氧化性:;
②易水解成BiOCl沉淀;常温下,BiOCl存在的pH范围约为2.0~11.0;
③常温下,;。
回答下列问题:
(1)、基态锰原子的价电子排布式为。(2)、“水浸提锰”时,另加入少量稀硫酸可促进(填化学式)溶解,进一步提高锰的浸取率。(3)、“滤渣2”的主要成分有(填化学式)、Bi。(4)、常温下,“含滤液”中的浓度为。为保证BiOCl产品的纯度,理论上,“沉铋”时应控制溶液的pH<(保留一位小数)。(5)、“脱氯”过程中发生主要反应的离子方程式为。(6)、BiOCl是一种性能优良的光催化剂,可催化降解有机污染物对硝基苯酚(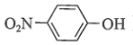 )等。对硝基苯酚的熔点高于邻硝基苯酚(
)等。对硝基苯酚的熔点高于邻硝基苯酚(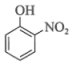 )的熔点,其原因是。 (7)、我国科学家在新型二维半导体芯片材料——硒氧化铋的研究中取得突破性进展。硒氧化铋的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞参数为a pm,a pm,b pm。
)的熔点,其原因是。 (7)、我国科学家在新型二维半导体芯片材料——硒氧化铋的研究中取得突破性进展。硒氧化铋的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞参数为a pm,a pm,b pm。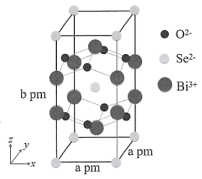
①该晶胞沿z轴方向的投影图为(填标号)。
A.
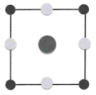 B.
B. C.
C. D.
D.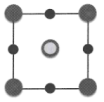
②该晶体中,每个周围紧邻的共有个。
③该晶体的密度为(列出计算式,为阿伏加德罗常数的值)。
19. 苯乙烯是生产塑料与合成橡胶的重要原料。氧化乙苯脱氢制苯乙烯的反应为:反应I:

已知:
反应II:
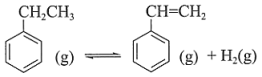
反应III:
回答下列问题:
(1)、反应I的。(2)、下列关于反应I~III的说法正确的是____(填标号)。A、及时分离出水蒸气,有利于提高平衡混合物中苯乙烯的含量 B、保持恒定时,说明反应I达到化学平衡状态 C、其他条件相同,反应II分别在恒容和恒压条件下进行,前者乙苯的平衡转化率更高 D、反应III正反应的活化能小于逆反应的活化能(3)、在催化剂作用下,氧化乙苯脱氢制苯乙烯可能存在如下图所示反应机理: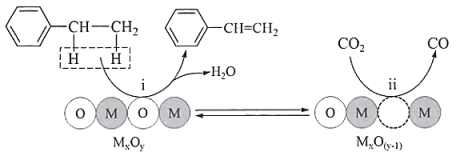
该机理可表示为以下两个基元反应,请补充反应ⅱ:
ⅰ:
 ;
;ⅱ:.
(4)、常压下,乙苯和经催化剂吸附后才能发生上述反应I。控制投料比[∶n(乙苯)]分别为1∶1、5∶1和10∶1,并在催化剂作用下发生反应,乙苯平衡转化率与反应温度的关系如图所示: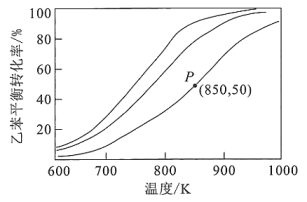
①乙苯平衡转化率相同时,投料比越高,对应的反应温度越(填“高”或“低”)。
②相同温度下,投料比远大于10∶1时,乙苯的消耗速率明显下降,可能的原因是:
ⅰ.乙苯的浓度过低;
ⅱ.。
③850K时,反应经t min达到图中P点所示状态,若初始时乙苯的物质的量为n mol,则v(苯乙烯)=。
(5)、700K时,向恒容密闭容器中加入过量和一定量乙苯,初始和平衡时容器内压强分别为和 , 则平衡时苯乙烯的分压为kPa(以含有、、p的代数式表示)。[已知:①混合气体中某组分的分压等于总压与该气体物质的量分数之积;以平衡分压代替平衡浓度进行计算,可得反应的分压平衡常数。② ]20. 以A和芳香烃E为原料制备除草剂茚草酮中间体(Ⅰ)的合成路线如下:
回答下列问题:
(1)、A中所含官能团的名称为。(2)、B→C的反应类型为。(3)、D中碳原子的杂化轨道类型有;其中,电负性最大的元素为。(4)、写出F→G的化学方程式。(5)、B的同分异构体中,满足下列条件的结构有种;其中,核磁共振氢谱有四组峰,且峰面积之比为6∶2∶2∶1的结构简式为。条件:①含有苯环;
②与溶液发生显色反应;
③含有2个甲基,且连在同一个碳原子上。
(6)、利用原子示踪技术追踪G→H的反应过程: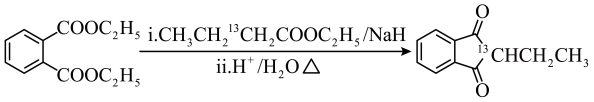
根据上述信息,写出以乙醇和
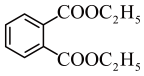 为原料合成
为原料合成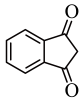 的路线(无机试剂任选) 。
的路线(无机试剂任选) 。
-