黑龙江省大庆市2023届高三下学期第一次教学质量检测化学试题
试卷更新日期:2023-03-08 类型:高考模拟
一、单选题
-
1. 中华文化源远流长、博大精深,云南省馆藏文物是中华文化的重要代表。下列文物主要是由硅酸盐材料制成的是( )
文物




战国牛虎铜案
溪山行旅图
西汉滇王编钟
新石器时代鸡形陶壶
选项
A
B
C
D
A、A B、B C、C D、D2. 下列事实用化学用语表述错误的是A、用电子式表示NaCl的形成过程: B、中子数为20的K原子:
C、常温时,0.1mol·L−1氨水的pH≈11.1:
D、O2-的结构示意图:
B、中子数为20的K原子:
C、常温时,0.1mol·L−1氨水的pH≈11.1:
D、O2-的结构示意图: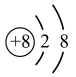 3. 氮及其化合物在生产生活中具有广泛的应用。在给定条件下,下列选项所示物质间的转化能实现的是( )A、 B、 C、 D、4. 北京故宫的屋顶有各种颜色的琉璃瓦,其坚实耐用,经历几百年的风雨洗礼仍能保存完整,下列说法错误的是( )A、琉璃瓦的主要成分是硅酸盐 B、制作琉璃瓦的主要原料是黏土 C、琉璃瓦坚实耐用取决于硅酸盐的结构 D、黄色和绿色琉璃瓦中分别含有、5. 下列实验操作规范且能达到实验目的的是( )
3. 氮及其化合物在生产生活中具有广泛的应用。在给定条件下,下列选项所示物质间的转化能实现的是( )A、 B、 C、 D、4. 北京故宫的屋顶有各种颜色的琉璃瓦,其坚实耐用,经历几百年的风雨洗礼仍能保存完整,下列说法错误的是( )A、琉璃瓦的主要成分是硅酸盐 B、制作琉璃瓦的主要原料是黏土 C、琉璃瓦坚实耐用取决于硅酸盐的结构 D、黄色和绿色琉璃瓦中分别含有、5. 下列实验操作规范且能达到实验目的的是( )选项
A
B
C
D
操作


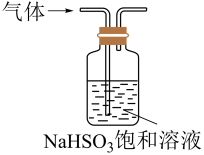
实验目的
制备氢氧化铁胶体
定容
除去中的少量HCl
制备并收集
A、A B、B C、C D、D6. 下列关于、、及的叙述正确的是A、都是共价化合物且常温下均为气体 B、可用于制光导纤维,干冰可用于人工降雨 C、都是酸性氧化物,都能与强碱溶液反应 D、都能溶于水且与水反应生成相应的酸7. 一种实现二氧化碳固定及再利用的反应如图所示。下列叙述正确的是( )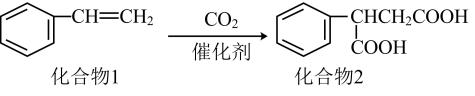 A、化合物1中碳原子的杂化类型为sp3杂化 B、化合物1与乙烯互为同系物 C、化合物2可以与乙二醇发生缩聚反应 D、化合物2中所有碳原子一定共平面8. 下列离子方程式书写正确的是A、硫酸铜溶液中滴入过量的氨水: B、金属镁与浓硫酸共热: C、磁性氧化铁粉末中滴入过量稀硝酸: D、氢化钠与水剧烈反应:9. 含铁物质与其相应化合价的关系如图所示。下列推断合理的是
A、化合物1中碳原子的杂化类型为sp3杂化 B、化合物1与乙烯互为同系物 C、化合物2可以与乙二醇发生缩聚反应 D、化合物2中所有碳原子一定共平面8. 下列离子方程式书写正确的是A、硫酸铜溶液中滴入过量的氨水: B、金属镁与浓硫酸共热: C、磁性氧化铁粉末中滴入过量稀硝酸: D、氢化钠与水剧烈反应:9. 含铁物质与其相应化合价的关系如图所示。下列推断合理的是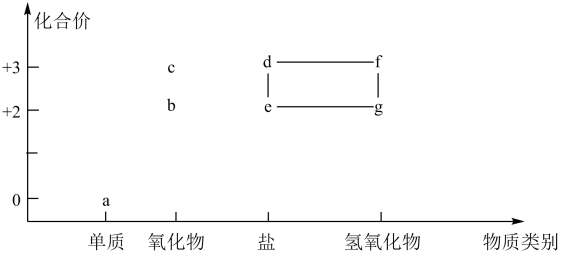 A、可用苯酚溶液鉴别đ和e B、a与水反应可直接生成c C、e的水溶液常用于净水 D、存在e-d-f-g的循环转化关系10. 设为阿伏加德罗常数的值,下列说法正确的是( )A、16.9g过氧化钡()固体中阴、阳离子总数为0.2 B、溶液中,氢原子数目为2 C、标准状况下,22.4L氯气与56g铁充分反应,转移的电子数为3 D、密闭容器中和充分反应后,容器中分子数为211. 反应经历两步:①X→Y;②Y→3Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法正确的是
A、可用苯酚溶液鉴别đ和e B、a与水反应可直接生成c C、e的水溶液常用于净水 D、存在e-d-f-g的循环转化关系10. 设为阿伏加德罗常数的值,下列说法正确的是( )A、16.9g过氧化钡()固体中阴、阳离子总数为0.2 B、溶液中,氢原子数目为2 C、标准状况下,22.4L氯气与56g铁充分反应,转移的电子数为3 D、密闭容器中和充分反应后,容器中分子数为211. 反应经历两步:①X→Y;②Y→3Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法正确的是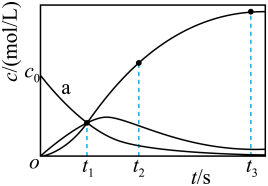 A、s时, B、a为随t的变化曲线 C、s时,Y的消耗速率大于生成速率 D、s后,12. X、Y、Z、M为原子序数依次增大的前四周期元素,其有关性质或结构信息如下:
A、s时, B、a为随t的变化曲线 C、s时,Y的消耗速率大于生成速率 D、s后,12. X、Y、Z、M为原子序数依次增大的前四周期元素,其有关性质或结构信息如下:元素
X
Y
Z
M
性质或结构信息
原子核外有三个能级,每个能级含有的电子数都相等
原子核外有两个电子层,最外层有3个未成对电子
氢化物为二元弱酸
基态原子核外价电子排布式为
下列说法错误的是
A、X元素与Z元素的原子可构成直线形分子 B、Y元素氢化物的沸点一定比X元素氢化物的沸点高 C、Z元素的二价阴离子是正四面体结构 D、将M的低价硝酸盐溶解在足量稀硝酸中,有气体产生13. 工业上采用电化学法对煤进行脱硫处理(煤中含硫物质主要是),以减少硫排放。模拟装置如图所示。下列说法错误的是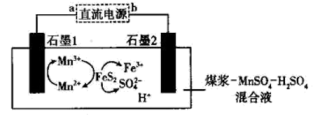 A、电子流向:b极→石墨2→电解质溶液→石墨1→a极 B、石墨1为阳极,发生氧化反应,被氧化 C、脱硫反应为 D、电路中转移电子,理论上处理14. 某混合物可能含有Al、Cu、、 , 为探究该混合物成分,某兴趣小组设计如图分析方案。下列分析错误的是( )
A、电子流向:b极→石墨2→电解质溶液→石墨1→a极 B、石墨1为阳极,发生氧化反应,被氧化 C、脱硫反应为 D、电路中转移电子,理论上处理14. 某混合物可能含有Al、Cu、、 , 为探究该混合物成分,某兴趣小组设计如图分析方案。下列分析错误的是( )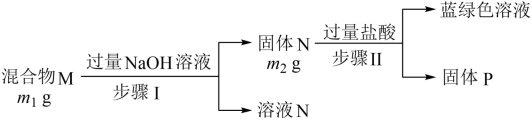 A、固体P一定是纯净物 B、若 , 则原混合物中可能含有Al C、蓝绿色溶液中一定含有的金属阳离子为、 D、向溶液N中通入足量的 , 一定可观察到有白色沉淀生成15. 由下列实验操作及现象得出的结论正确的是
A、固体P一定是纯净物 B、若 , 则原混合物中可能含有Al C、蓝绿色溶液中一定含有的金属阳离子为、 D、向溶液N中通入足量的 , 一定可观察到有白色沉淀生成15. 由下列实验操作及现象得出的结论正确的是选项
实验操作
现象
结论
A
取溶液于试管中,加入溶液,充分反应后滴入5滴15%KSCN溶液
溶液变血红色
KI与的反应有一定限度
B
向溶液X中滴加少量NaOH稀溶液,将湿润的红色石蕊试纸靠近试管口
石蕊试纸不变蓝
溶液X中肯定不含
C
将硫酸酸化的溶液滴入溶液中
溶液变黄色
氧化性:(酸性条件)
D
向一定浓度的溶液中通入适量气体
产生黑色沉淀
的酸性比的强
A、A B、B C、C D、D16. 室温下,通过下列实验探究亚硫酸盐的性质。已知:、。实验
实验操作和现象
1
向溶液中通入(标准状况) , 测得约为9
2
向溶液中通入至溶液
3
向溶液中通入(标准状况) , 测得约为3
4
取实验3所得溶液 , 加入溶液,产生白色沉淀
下列说法错误的是
A、实验1得到的溶液中: B、实验2得到的溶液中: C、实验3得到的溶液中: D、实验4中可知:二、综合题
-
17. 某化学小组用下列装置(夹持装置已略去)制备氨基甲酸铵(),其反应原理为 。已知:氨基甲酸铵难溶于四氯化碳;易水解生成碳酸氢铵;受热易分解生成尿素。
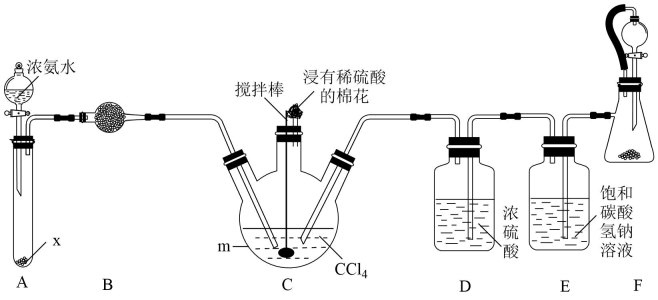
试回答下列问题:
(1)、装置C中仪器m的名称是;装置F中橡皮管的作用是。(2)、装置A是制备氨气的简易装置,装置B中盛放的试剂为。(3)、反应时,为了提高氨基甲酸铵的产量,仪器m应放置在(填“热水浴”或“冷水浴”)中;装置C中浸有稀硫酸的棉花作用是。(4)、装置F中利用盐酸和石灰石制 , 则装置E、D的作用分别是。(5)、实验制备过程中,为了提高氨基甲酸铵纯度,请提出合理措施:(写两条)。18. 我国科学家开发催化剂来提高燃料电池的性能。某小组以含镍废料(主要含、 , 以及少量、、、、、和等)为原料提取镍的流程如下: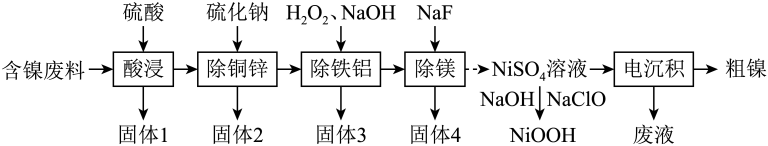
已知常温下部分难溶物的如表所示:
物质
请回答下列问题:
(1)、“酸浸”中产生了一种还原性气体,它是(填化学式);“除铁铝”中双氧水的作用是。(2)、“固体2”中除、外,还可能含硫单质等物质,生成硫单质的离子方程式为。(3)、为提高原料利用率,“电沉积”得到的“废液”可以循环用于(填名称)工序。(4)、常温下,在“除铁铝”中,当滤液中时,其。(5)、可以通过电解法提纯镍,粗镍作(填“阳”或“阴”)极,阴极的电极反应式为。19. 氮元素在地球上含量丰富,氮及其化合物在工农业生产和生活中有着重要作用,氮氧化物也是主要的大气污染物。回答下列问题:(1)、已知在催化剂的作用下,与反应生成无污染气体:①
②
③
则④ (用含、、的代数式表示)。实验室可用氯化铵与消石灰反应制备少量: , 该反应在(填“高温”、“低温”或“任何温度”)下能自发进行。
(2)、在催化剂作用下,也能将转化为无毒清洁物质,恒温条件下,将一定量的与气体通入恒容密闭容器中,发生反应。下列可判断反应达到平衡的是____(填标号)。A、混合气体的密度保持不变 B、 C、容器内总压强不再改变 D、(3)、汽车尾气中含有较多的和 , 在催化剂作用下,发生反应。实验测得: , (、分别为正、逆反应的速率常数,只与温度有关)。某温度下,在体积为的恒容密闭容器中充入和 , 当反应达到平衡时,的转化率为80%,则:①。
②平衡时体系压强为 , 为用分压表示的平衡常数(分压总压物质的量分数),则平衡常数(用含p的式子表示)。
20. 镍铜合金是由60%镍、33%铜、7%铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能和高温强度,耐蚀性强,耐磨性好,容易加工,可作为航空发动机的结构材料。根据所学知识,回答下列问题:(1)、铜元素的焰色试验呈绿色,下列三种波长为橙、黄、绿色对应的波长,则绿色对应的辐射波长为____(填标号)。A、 B、 C、(2)、基态的价电子排布式为。(3)、乙酰丙酮(结构如图)中C原子的杂化轨道类型有 , 乙酰丙酮中σ键与π键数目之比为。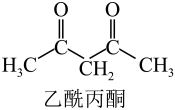 (4)、Cu与Fe的第二电离能分别为 , , 大于的主要原因是。(5)、已知的立方晶胞结构如图所示。
(4)、Cu与Fe的第二电离能分别为 , , 大于的主要原因是。(5)、已知的立方晶胞结构如图所示。
①已知a、b的坐标参数依次为(0,0,0)、( , , ),则d的坐标参数为。
②晶胞边长为cpm,该晶体的密度为。(列计算式,设为阿伏加德罗常数的数值)
21. 天然产物G具有抗肿瘤等生物活性,某课题组设计的合成路线如图(部分反应条件已省略):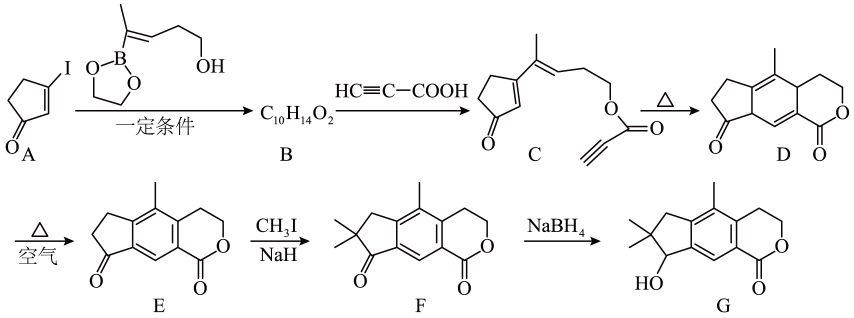
已知:
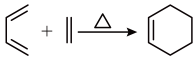
请回答:
(1)、有机物G中含有的官能团的名称为。(2)、化合物B的结构简式为。(3)、写出的化学方程式: , 其反应类型为。(4)、有机物K是G的同分异构体,其中含有3个六元碳环(其结构为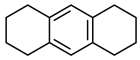 ),同时符合下列条件的有机物K有种。
),同时符合下列条件的有机物K有种。①遇溶液会发生显色反应
②与溶液反应有气体生成