吉林省四平市2021-2022学年高三下学期最后冲刺化学试题
试卷更新日期:2023-03-08 类型:高考模拟
一、单选题
-
1. 中国诗词深受众人喜爱,针对下列一些诗词,从化学角度解读正确的是A、王安石的《梅花》 “遥知不是雪,为有暗香来”描述了物质发生化学变化过程中既有状态变化又有气味的产生 B、庾信的《杨柳歌》“独忆飞絮鹅毛下,非复青丝马尾垂”从化学成分分析现实生活中“飞絮”“鹅毛”主要成分都是蛋白质 C、赵孟頫的《烟火诗》“纷纷灿烂如星陨,赫赫喧虺似火攻”描述了颜色反应的现象 D、刘禹锡的《浪淘沙》“千淘万漉虽辛苦,吹尽狂沙始到金”,说明金在自然界中以游离态存在,其化学性质稳定2. 25℃时,取浓度均为0.1 mol·L−1的醋酸溶液和氨水各20 mL,分别用0.1 mol·L−1 氢氧化钠溶液和0.1 mol·L−1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是
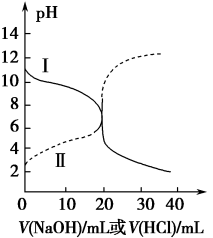 A、曲线I,滴加10 mL溶液时:c(NH4+)+c(H+)=c(OH-)+c(NH3·H2O) B、曲线I,滴加20 mL溶液时:两溶液恰好完全反应,此时溶液的pH<7 C、曲线II,滴加溶液体积在10~20 mL之间时存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) D、曲线II,滴加30 mL溶液时:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)3. 下列关于pH=3的CH3COOH溶液的叙述正确的是( )A、溶液中H2O电离出的c(OH-)=1.0×10-3mol⋅L-1 B、加入少量CH3COONa固体后,溶液pH升高 C、与等体积0.001mol/L NaOH溶液反应,所得溶液呈中性 D、与pH=3的硫酸溶液浓度相等4. 对NaOH晶体叙述错误的是A、存在两种化学键 B、含共价键的离子化合物 C、存在两种离子 D、含共价键的共价化合物5. 下列离子方程式正确的是A、氯化铝溶液与一定量的碳酸钠溶液反应:Al3++3CO32-+3H2O=Al(OH)3↓+3HCO3- B、氯化钠固体与浓硫酸混合微热:Cl-+H+HCl↑ C、氯气通入石灰乳:Cl2+2OH-=Cl-+ClO-+H2O D、苯酚钠溶液呈碱性的原理:C6H5O-+H2O→C6H5OH+OH-6. 饱和二氧化硫水溶液中存在下列平衡体系:SO2+H2OH++ , H++ , 若向此溶液中A、加水,浓度增大 B、通入少量Cl2气体,溶液pH增大 C、加少量CaSO3粉末,浓度基本不变 D、通入少量HCl气体,溶液中浓度减小7. 设NA为阿伏加德罗常数,下列说法正确的是( )A、6.2g白磷分子(P4)中含P-P键数为0.05NA B、1mol CH3+含电子数为8NA C、标准状况下,22.4LSO3中含原子数为4NA D、常温常压下,11.2LCO2气体通过足量Na2O2充分反应,转移电子数为2NA8. 某固体混合物可能由、、、、中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积)。关于该固体混合物,下列说法正确的是
A、曲线I,滴加10 mL溶液时:c(NH4+)+c(H+)=c(OH-)+c(NH3·H2O) B、曲线I,滴加20 mL溶液时:两溶液恰好完全反应,此时溶液的pH<7 C、曲线II,滴加溶液体积在10~20 mL之间时存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) D、曲线II,滴加30 mL溶液时:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)3. 下列关于pH=3的CH3COOH溶液的叙述正确的是( )A、溶液中H2O电离出的c(OH-)=1.0×10-3mol⋅L-1 B、加入少量CH3COONa固体后,溶液pH升高 C、与等体积0.001mol/L NaOH溶液反应,所得溶液呈中性 D、与pH=3的硫酸溶液浓度相等4. 对NaOH晶体叙述错误的是A、存在两种化学键 B、含共价键的离子化合物 C、存在两种离子 D、含共价键的共价化合物5. 下列离子方程式正确的是A、氯化铝溶液与一定量的碳酸钠溶液反应:Al3++3CO32-+3H2O=Al(OH)3↓+3HCO3- B、氯化钠固体与浓硫酸混合微热:Cl-+H+HCl↑ C、氯气通入石灰乳:Cl2+2OH-=Cl-+ClO-+H2O D、苯酚钠溶液呈碱性的原理:C6H5O-+H2O→C6H5OH+OH-6. 饱和二氧化硫水溶液中存在下列平衡体系:SO2+H2OH++ , H++ , 若向此溶液中A、加水,浓度增大 B、通入少量Cl2气体,溶液pH增大 C、加少量CaSO3粉末,浓度基本不变 D、通入少量HCl气体,溶液中浓度减小7. 设NA为阿伏加德罗常数,下列说法正确的是( )A、6.2g白磷分子(P4)中含P-P键数为0.05NA B、1mol CH3+含电子数为8NA C、标准状况下,22.4LSO3中含原子数为4NA D、常温常压下,11.2LCO2气体通过足量Na2O2充分反应,转移电子数为2NA8. 某固体混合物可能由、、、、中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积)。关于该固体混合物,下列说法正确的是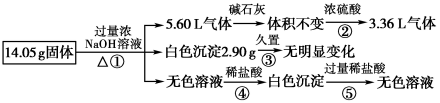 A、一定含有Al,其质量为 B、一定含有和 , 且物质的量相等 C、一定不含 , 可能含有和 D、一定含有和9. 下列图示两个装置的说法错误的是( )
A、一定含有Al,其质量为 B、一定含有和 , 且物质的量相等 C、一定不含 , 可能含有和 D、一定含有和9. 下列图示两个装置的说法错误的是( )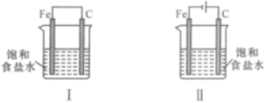 A、Fe的腐蚀速率,图Ⅰ>图Ⅱ B、图Ⅱ装置称为外加电流阴极保护法 C、图Ⅰ中C棒上:2H++2e=H2↑ D、图Ⅱ中Fe表面发生还原反应10. 下列转化不能通过一步实现的是( )A、FeFe3O4 B、AlNaAlO2 C、CuCuSO4 D、CuCuS11. 杜瓦苯(
A、Fe的腐蚀速率,图Ⅰ>图Ⅱ B、图Ⅱ装置称为外加电流阴极保护法 C、图Ⅰ中C棒上:2H++2e=H2↑ D、图Ⅱ中Fe表面发生还原反应10. 下列转化不能通过一步实现的是( )A、FeFe3O4 B、AlNaAlO2 C、CuCuSO4 D、CuCuS11. 杜瓦苯(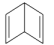 )与苯互为同分异构体,则杜瓦苯 A、最简式是CH2 B、分子中所有原子共平面 C、能使酸性高锰酸钾溶液褪色 D、是CH2=CH-CH=CH2的同系物12. 高能LiFePO4电池多应用于公共交通,结构如图所示。电池中间是聚合物的隔膜,其主要作用是在反应过程中只让Li+通过,原理如下:(1−x)LiFePO4+xFePO4+LixCn
)与苯互为同分异构体,则杜瓦苯 A、最简式是CH2 B、分子中所有原子共平面 C、能使酸性高锰酸钾溶液褪色 D、是CH2=CH-CH=CH2的同系物12. 高能LiFePO4电池多应用于公共交通,结构如图所示。电池中间是聚合物的隔膜,其主要作用是在反应过程中只让Li+通过,原理如下:(1−x)LiFePO4+xFePO4+LixCn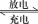 LiFePO4+nC。下列说法错误的是( )
LiFePO4+nC。下列说法错误的是( )
 A、放电时,Li+向正极移动 B、放电时,电子由负极→用电器→正极 C、充电时,阴极反应为xLi++nC+xe-=LixCn D、充电时,阳极质量增重13. T℃下,三种硫酸盐MSO4 , (M表示Pb2+或Ba2+或Sr2+)的沉淀溶解平衡曲线如图所示。已知pM=-lgc(M),p(SO42-)=-lgc(SO42-)。下列说法正确的是( )
A、放电时,Li+向正极移动 B、放电时,电子由负极→用电器→正极 C、充电时,阴极反应为xLi++nC+xe-=LixCn D、充电时,阳极质量增重13. T℃下,三种硫酸盐MSO4 , (M表示Pb2+或Ba2+或Sr2+)的沉淀溶解平衡曲线如图所示。已知pM=-lgc(M),p(SO42-)=-lgc(SO42-)。下列说法正确的是( ) A、BaSO4在任何条件下都不可能转化成PbSO4 B、X点和Z点分别是SrSO4和BaSO4的饱和溶液,对应的溶液中c(M)=c(SO42-) C、在ToC时,用0.01mol.L-1Na2SO4溶液滴定20mL浓度均是0.01mol.L-1的Ba(NO3)2和Sr(NO3)2的混合溶液,Sr2+先沉淀 D、ToC下,反应PbSO4(s)+Ba2+(aq)
A、BaSO4在任何条件下都不可能转化成PbSO4 B、X点和Z点分别是SrSO4和BaSO4的饱和溶液,对应的溶液中c(M)=c(SO42-) C、在ToC时,用0.01mol.L-1Na2SO4溶液滴定20mL浓度均是0.01mol.L-1的Ba(NO3)2和Sr(NO3)2的混合溶液,Sr2+先沉淀 D、ToC下,反应PbSO4(s)+Ba2+(aq) BaSO4(s)+Pb2+(aq)的平衡常数为102.4
14. 已知有机物C2H4O、C3H6O2和C4H8组成的混合物中,碳元素的质量分数为a%,则氧元素的质量分数为A、(100-)% B、% C、% D、无法计算15. 国际能源期刊报道了一种正在开发中的绿色环保“全氢电池”,有望减少废旧电池产生污染。其工作原理如图所示。下列说法正确的是
BaSO4(s)+Pb2+(aq)的平衡常数为102.4
14. 已知有机物C2H4O、C3H6O2和C4H8组成的混合物中,碳元素的质量分数为a%,则氧元素的质量分数为A、(100-)% B、% C、% D、无法计算15. 国际能源期刊报道了一种正在开发中的绿色环保“全氢电池”,有望减少废旧电池产生污染。其工作原理如图所示。下列说法正确的是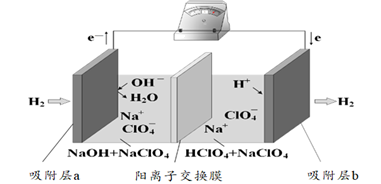 A、“全氢电池”工作时,将酸碱反应的中和能转化为电能 B、吸附层b发生的电极反应:H2 – 2e- + 2 OH-= 2H2O C、Na+ 在装置中从右侧透过阳离子交换膜向左侧移动 D、“全氢电池”的总反应: 2H2 + O2 =2H2O16. 室温下,分别用0.1000mol•L-1的NaOH标准液滴定浓度均为0.1mol•L-1的三种酸HX、HY、和HZ,滴定曲线如图所示,下列说法错误的是
A、“全氢电池”工作时,将酸碱反应的中和能转化为电能 B、吸附层b发生的电极反应:H2 – 2e- + 2 OH-= 2H2O C、Na+ 在装置中从右侧透过阳离子交换膜向左侧移动 D、“全氢电池”的总反应: 2H2 + O2 =2H2O16. 室温下,分别用0.1000mol•L-1的NaOH标准液滴定浓度均为0.1mol•L-1的三种酸HX、HY、和HZ,滴定曲线如图所示,下列说法错误的是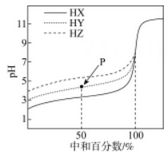 A、三种酸的酸性强弱:HX>HY>HZ B、等浓度、等体积的HY溶液和NaY溶液混合,混合液显酸性 C、用NaOH标准液滴定HZ溶液时,选用酚酞作指示剂 D、滴定HX的曲线中,当中和百分数为50%时,溶液中存在c(X-)<c(Na+)
A、三种酸的酸性强弱:HX>HY>HZ B、等浓度、等体积的HY溶液和NaY溶液混合,混合液显酸性 C、用NaOH标准液滴定HZ溶液时,选用酚酞作指示剂 D、滴定HX的曲线中,当中和百分数为50%时,溶液中存在c(X-)<c(Na+)二、综合题
-
17. 以下是由甲苯合成乙酰水杨酸和酚酞的合成路线。
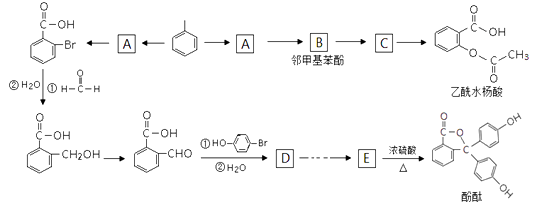 (1)、写出“甲苯→A”的化学方程式。(2)、写出C的结构简式 , E分子中的含氧官能团名称为;(3)、上述涉及反应中,“E→酚酞”发生的反应类型是。(4)、写出符合下列条件的乙酰水杨酸的一种同分异构体的结构简式。
(1)、写出“甲苯→A”的化学方程式。(2)、写出C的结构简式 , E分子中的含氧官能团名称为;(3)、上述涉及反应中,“E→酚酞”发生的反应类型是。(4)、写出符合下列条件的乙酰水杨酸的一种同分异构体的结构简式。①遇FeCl3溶液显紫色, ②能与碳酸氢钠反应,
③苯环上只有2个取代基的, ④能使溴的CCl4溶液褪色。
(5)、写出乙酰水杨酸和NaOH溶液完全反应的化学方程式:。(6)、由D合成E有多步,请设计出D→E的合成路线。(有机物均用结构简式表示)。(合成路线常用的表示方式为:D
 ……
…… E)18. 扁桃酸D在有机合成和药物生产中有着广泛应用。用常见化工原料制备D,再由此制备有机物I的合成路线如下:
E)18. 扁桃酸D在有机合成和药物生产中有着广泛应用。用常见化工原料制备D,再由此制备有机物I的合成路线如下: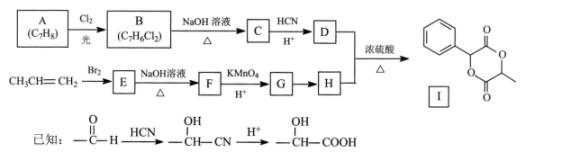
回答下列问题:
(1)、C的名称是 , I的分子式为。(2)、E→F的反应类型为 , G中官能团的名称为 。(3)、 A→B的化学方程式为。(4)、反应G→H的试剂及条件是。(5)、写出符合下列条件的D的同分异构体:。①能发生银镜反应 ②与FeCl3溶液显紫色 ③核磁共振氢谱峰面积之比1:2:2:3
(6)、写出以溴乙烷为原料制备H的合成路线(其他试剂任选)。19. 金属磷化物(如磷化锌)是常用的蒸杀虫剂。我国卫生部门规定:粮食中磷化物(以PH3计)的含量不超过0.050mg:kg-1时,粮食质量方达标。现设计测定粮食中残留磷化物含量的实验如下【资料查阅】磷化锌易水解产生PH3;PH3沸点为-88℃,有剧毒性、强还原性、易自然。
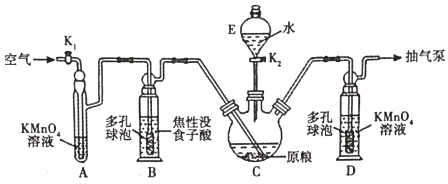
【用量标准]如图:装置A、B、E中盛有的试剂均足量;C中装有100原粮;D中盛有40.00mL6.0×10-5mol・L-1KMnO4溶液(H2SO4酸化)。
【操作流程】安装仪器并检查气密性→PH3的产生与吸收一转移KMnO4吸收溶液→用Na2SO3标准溶液滴定。
试回答下列问题:
(1)、仪器E的名称是;仪器B、D中进气管下端设计成多孔球泡形状,目的是。(2)、A装置的作用是;B装置的作用是吸收空气中的O2 , 防止。(3)、下列操作中,不利于精确测定出实验结果的是(选填序号)。a.实验前,将C中原粮预先磨碎成粉末
b.将蒸馏水预先煮沸、迅速冷却并注入E中
c.实验过程中,用抽气泵尽可能加快抽气速率
(4)、磷化锌发生水解反应时除产生PH3外,还生成(填化学式)。(5)、D中PH3被氧化成H3PO4 , 该反应的离子方程式为。(6)、把D中吸收液转移至容量瓶中,加水稀释至250.00mL,取25.00mL于锥形瓶中,用 5.0×10-5mol・L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液10.00mL.则该原粮中磷化物(以PH3计)的含量为mg・kg-1 , 该原粮质量(填“达标”或“不达标“)。20. 绿矾(FeSO4·7H2O)外观为半透明蓝绿色单斜结晶或颗粒,无气味。受热能分解,且在空气中易被氧化。(1)、I.医学上绿矾可用于补血剂甘氨酸亚铁[(NH2CH2COO)2Fe]颗粒的制备,有关物质性质如下:甘氨酸(NH2CH2COOH)
柠檬酸
甘氨酸亚铁
易溶于水,微溶于乙醇,两性化合物
易溶于水和乙醇,有强酸性和还原性
易溶于水,难溶于乙醇
向绿矾溶液中,缓慢加入NH4HCO3溶液,边加边搅拌,反应结束后生成沉淀FeCO3。该反应的离子方程式为。
(2)、制备(NH2CH2COO)2Fe:往FeCO3中加入甘氨酸(NH2CH2COOH)的水溶液,滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。①加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是。
②洗涤操作,选用的最佳洗涤试剂是(填序号)。
A.热水 B.乙醇 C.柠檬酸
(3)、II.绿矾晶体受热分解的反应为2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+14H2O,实验室用图I所示装置验证其分解产物。请回答下列问题:
Fe2O3+SO2↑+SO3↑+14H2O,实验室用图I所示装置验证其分解产物。请回答下列问题: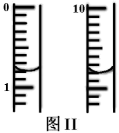
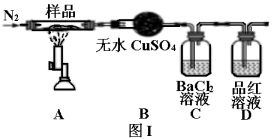
加热前通入氮气的目的是。
(4)、实验中观察到装置B现象为。(5)、C装置和D装置能否调换(填“能”或“否”)。(6)、样品完全分解后,残留物全部为红棕色固体,检验装置A中的残留物含有Fe2O3的方法是。(7)、该装置有个明显缺陷是。(8)、III.测定绿矾样品中铁元素的含量。称取m g绿矾样品于锥形瓶中溶解后加稀H2SO4酸化,用 c mol·L−1 KMnO4 溶液滴定至终点。耗KMnO4溶液体积如图II所示,(滴定时发生反应的离子方程式为:5Fe2++MnO4−+8H+=5Fe3++Mn2++4H2O),该晶体中铁元素的质量分数为(用含m、c的式子表示)。
21. X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素。其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大。P元素的第三电子层处于全充满状态,第四电子层只有一个电子。请回答下列问题:(1)、基态X的外围电子电子排布图为 , P元素属于 区元素。(2)、XZ2分子的空间构型是 , YZ2分子中Y的杂化轨道类型为 , 相同条件下两者在水中的溶解度较大的是(写分子式),理由是。(3)、含有元素N的盐的焰色反应为色,许多金属盐都可以发生焰色反应,其原因是。(4)、元素M与元素Q形成晶体中,M离子与Q离子的配位数之比为。(5)、P单质形成的晶体中,P原子采取的堆积方式为 , P原子采取这种堆积方式的空间利用率为(用含π表达式表示)。