吉林省长春市2022届高三临考押题卷(B)理科综合化学试题
试卷更新日期:2023-03-08 类型:高考模拟
一、单选题
-
1. 《天工开物》中“治铁"原典中记载:“凡治铁成器,取已炒熟铁为之……凡炉中炽铁用炭,煤炭居十七,木炭居十三……即用煤炭也别有铁炭一种,取其火性内攻、焰不虚腾者,与炊炭同行而有分类也……”。下列说法正确的是A、熟铁是纯净的铁单质,生铁是铁和碳的混合物 B、治铁过程只涉及化合反应与置换反应, C、铁炭和炊炭均为碳元素的同素异形体 D、治铁用到的煤炭和木炭均可还原铁的氧化物2. 如图是实验室制备氯气并进行相关实验的装置(夹持与加热装置已省略),下列有关说法错误的是
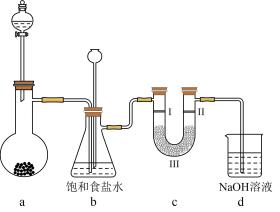 A、若无加热装置,则装置a蒸馏烧瓶中可用高锰酸钾或次氯酸钠 B、检验氯气是否有漂白性,则I、II、III分别为湿润的石蕊试纸、碱石灰、干燥的石蕊试纸 C、装置b的作用既可以洗气又可以作安全瓶监测装置c是否堵塞 D、含有4molHCl的浓盐酸与足量二氧化锰反应,产生标准状况下的Cl2体积小于22.4L3. 反式脂肪酸对人体的健康不利,反式油酸结构简式如图所示,下列说法正确的是
A、若无加热装置,则装置a蒸馏烧瓶中可用高锰酸钾或次氯酸钠 B、检验氯气是否有漂白性,则I、II、III分别为湿润的石蕊试纸、碱石灰、干燥的石蕊试纸 C、装置b的作用既可以洗气又可以作安全瓶监测装置c是否堵塞 D、含有4molHCl的浓盐酸与足量二氧化锰反应,产生标准状况下的Cl2体积小于22.4L3. 反式脂肪酸对人体的健康不利,反式油酸结构简式如图所示,下列说法正确的是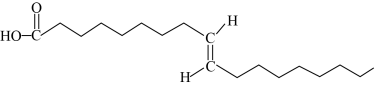 A、反式油酸的分子式为C18H36O2 B、反式油酸不能发生取代反应 C、该物质可形成高分子聚合物 D、1mol反式油酸最多消耗2molH24. X、Y、Z、W是原子序数依次增大的短周期主族元素,其中W的最外层电子数是次外层电子数的3倍,由X、Y、Z、W四种元素形成的离子化合物G结构如下,下列有关说法正确的是
A、反式油酸的分子式为C18H36O2 B、反式油酸不能发生取代反应 C、该物质可形成高分子聚合物 D、1mol反式油酸最多消耗2molH24. X、Y、Z、W是原子序数依次增大的短周期主族元素,其中W的最外层电子数是次外层电子数的3倍,由X、Y、Z、W四种元素形成的离子化合物G结构如下,下列有关说法正确的是 A、X与Y、Z、W均能形成10电子和18电子的化合物 B、X、Y、Z三种元素只能形成共价化合物,不能形成离子化合物 C、氢化物的稳定性:Y<Z<W D、构成化合物G的原子最外层均达到8电子稳定结构5. 汽车尾气中含有CO和NOx(2≥x≥1),通过设计如图所示电池装置可以利用汽车尾气给汽车蓄电瓶供电,下列说法错误的是
A、X与Y、Z、W均能形成10电子和18电子的化合物 B、X、Y、Z三种元素只能形成共价化合物,不能形成离子化合物 C、氢化物的稳定性:Y<Z<W D、构成化合物G的原子最外层均达到8电子稳定结构5. 汽车尾气中含有CO和NOx(2≥x≥1),通过设计如图所示电池装置可以利用汽车尾气给汽车蓄电瓶供电,下列说法错误的是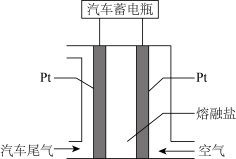 A、负极参与反应的物质至少有4种 B、正极发生的电极反应式为O2+4e-=2O2- C、NOx放电时两极消耗气体体积比在4:1~4:3之间 D、该电池可长期采用多孔石墨作为电极而不作更换6. 乙烯液相催化氧化乙醛机理如图所示:
A、负极参与反应的物质至少有4种 B、正极发生的电极反应式为O2+4e-=2O2- C、NOx放电时两极消耗气体体积比在4:1~4:3之间 D、该电池可长期采用多孔石墨作为电极而不作更换6. 乙烯液相催化氧化乙醛机理如图所示:
下列说法错误的是
A、产生1molCH3CHO转移电子数为2NA B、CuCl2与PdCl2是催化剂,CuCl与Pd是中间产物 C、I、II、III步均发生氧化还原反应 D、该反应过程中既有极性键和非极性键断裂又有极性键和非极性键形成7. 难溶物在水溶液中存在沉淀溶解平衡,已知Ksp(CaSO4)=9.0×10-6 , Ksp(CaCO3)=2.8×10-9 , 离子浓度与物质常温下的溶解度关系如图所示,下列说法正确的是 A、L1为CaSO4曲线,L2为CaCO3曲线 B、c1的数量级为10-4 , c2=3.0×10-3mol/L C、常温下L1溶解度:a>d,a>e D、降低温度a点可移动至c点
A、L1为CaSO4曲线,L2为CaCO3曲线 B、c1的数量级为10-4 , c2=3.0×10-3mol/L C、常温下L1溶解度:a>d,a>e D、降低温度a点可移动至c点二、综合题
-
8. 聚阴离子Na2FePO4F多用于锂离子电池正极材料,一种工艺简单、绿色经济的合成流程如下:

首先将含有NaF和FePO4各0.025mol的原料研磨混合30min,混合均匀转移到80mL。的水热釜中,将0.025mol的CH3COONa溶于6mL蒸馏水中,并加入1g蔗糖溶解均匀并慢慢加入水热釜中得到流变态混合物,请回答下列问题:
(1)、80℃干燥的加热方式:。(2)、前驱体主要成分是NaF、FePO4、CH3COONa和蔗糖四种物质的混合物。此段操作的目的是。(3)、加入的NaF、FePO4、CH3COONa物质的量之比为1:1:1的目的是。(4)、350℃烧结主要是蔗糖碳化,产生的碳粒包裹在生成的纳米级Na2FePO4F的表面,碳层的作用是。(5)、二次烧结中有NaF、FePO4、CH3COONa反应生成Na2FePO4F、CO、水及焦炭,试写出该反应的化学方程式:。(6)、假定原料完全反应,最后称量黑色粉末Na2FePO4F/C共5.63g,则产品中Na2FePO4F含量为(保留三位有效数字)。9. 三草酸合铁酸钾{K3[Fe(C2O4)3]}是制备负载型活性铁催化剂的主要原料,也是一些有机反应的催化剂。具有工业生产价值。无机实验室制备三草酸合铁酸钾的原理如下:①(NH4)2Fe(SO4)2+2H2O+H2C2O4=FeC2O4·2H2O↓+(NH4)2SO4+H2SO4
②6FeC2O4·2H2O+3H2O2+6K2C2O4=4K3[Fe(C2O4)3]+2Fe(OH)3↓+12H4O
③2Fe(OH)3+3H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O
(1)、草酸亚铁的制备:在如图所示装置中完成反应①。称取5g硫酸亚铁铵放入锥形瓶中,加入15mL蒸馏水,2~4滴3mol/LH2SO4 , 然后加入25mL饱和H2C2O4溶液,加热至沸腾,静置,有黄色沉淀生成。过滤,用蒸馏水洗涤沉淀。
①实验中加入2~4滴3mol/LH2SO4的目的是;
②用蒸馏水洗涤沉淀的具体操作为。
(2)、三草酸合铁(III)酸钾的制备:向草酸亚铁沉淀中加入15mL饱和K2C2O4溶液,保持温度为40℃,恒温搅拌下逐滴滴加10mL6%H2O2溶液,最后逐滴加入饱和H2C2O4溶液至溶液变成亮绿色,将溶液浓缩至15mL后,冷却析出翠绿色晶体。
①仪器a的名称是 , 反应保持为40℃的原因是;
②逐滴加入H2O2和H2C2O4的目的是 , 为了达到该目的,还可以进行的实验操作为。
(3)、三草酸合铁(III)酸钾(M=437g/mol)含量的测定:取制得的样品mg配成溶液,加入5mL3mol/LH2SO4加热至80℃,用cmol/LKMnO4溶液滴定,消耗KMnO4溶液VmL。①加入高锰酸钾溶液时发生反应的离子方程式为。
②该样品的质量分数为(写出表达式即可),测量值比实际值偏小,原因可能是(任写一种即可)。
10. 乙酸是一种合成纤维、医药、农药、染料和粘合剂的重要的化工原料,也是优良的有机溶剂。(1)、已知CO的燃烧热为283kJ/mol;CH3OH的燃烧热为725kJ/mol;CH3COOH的燃烧热为870kJ/mol。试写出由CO与CH3OH制取CH3COOH的热化学方程式:。(2)、工业上制取一氧化碳常用焦炭与氧气和二氧化碳反应。已知:C(s)+O2(g)⇌CO(g) △H1=-110.5kJ/mol ①
C(s)+CO2(g)⇌2CO(g) △H2=+552.5kJ/mol ②
工业上将一定比例的氧气和二氧化碳投入焦炭炉中反应,不同温度下,达到平衡时氧气和二氧化碳体积分数如图:

试解释随温度的升高氧气与二氧化碳的变化趋势的原因:;在850℃时反应炉中达到热平衡,则通入的n(O2):n(CO2)=(填,最简单整数比);此时反应器中压强为p0 , 则反应②的Kp=。
(3)、650℃向某1L容器中投入1mol甲醇和不同物质的量的一氧化碳,测得平衡时反应物或生成物的体积分数如图:
则曲线c表示的物质是;e点CO的转化率为;(用分数表达或保留三位有效数字)在M点平衡状态下进行压缩,则重新达到平衡,M点可能移到:。(填“不变”“O”“N”或“P”)。
11. 单质硼的硬度近似于金刚石,有很高的电阻。但它的导电率随温度的升高而增大,高温时为良导体。硼在自然界中主要以硼酸和硼酸盐的形式存在。(1)、基态硼原子的价电子排布式为 , 晶体硼的熔沸点(填“高于”或“低于”)金刚石,原因是。(2)、硼酸与氢氧化钠在一定条件下可以生成四硼酸钠,结构如图所示,四硼酸钠中含有的化学键类型为 , O原子的杂化类型为 , B原子与相连的3个O原子围成的图形为 , 第一电离能介于硼元素和氧元素之间的第二周期元素有种。 (3)、硼和氮可以构成多种类型的晶体,其中一种晶体的晶胞如图所示,晶胞上下底面均为菱形,晶胞参数如图所示,该晶体的化学式为 , 晶胞密度为(写出表达式即可)。
(3)、硼和氮可以构成多种类型的晶体,其中一种晶体的晶胞如图所示,晶胞上下底面均为菱形,晶胞参数如图所示,该晶体的化学式为 , 晶胞密度为(写出表达式即可)。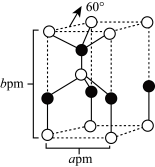 12. 盐酸西替利嗪是第二代无镇定作用的抗组胺药物,一种改进合成工艺如下:
12. 盐酸西替利嗪是第二代无镇定作用的抗组胺药物,一种改进合成工艺如下: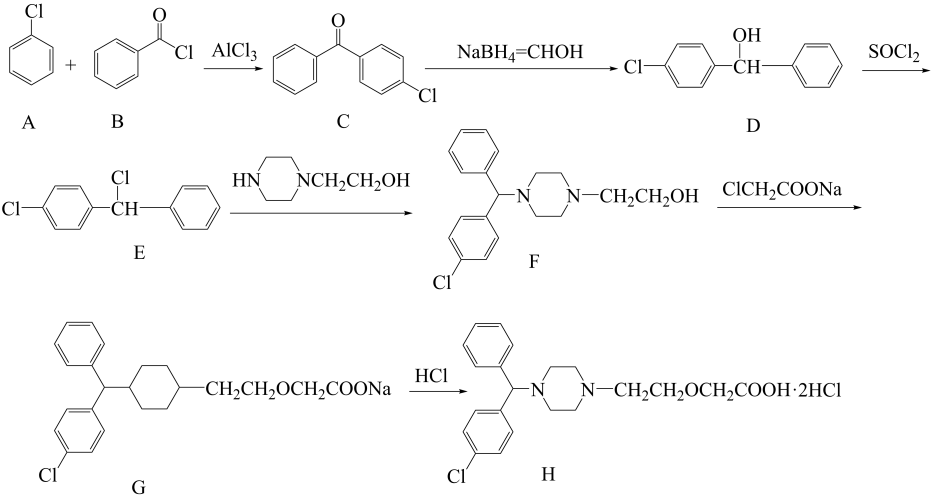
回答下列问题:
(1)、有机物A的名称:;指出D的官能团名称:。(2)、有机物B中至少有个原子共平面,D→E的反应类型:。(3)、写出E→F的化学方程式:。(4)、C的同分异构体很多,其中含有两个苯环(无其他环)的同分异构体有种(不含C本身),写出苯环上一取代物有4种的结构简式:。(5)、参照流程图补充完整下列合成路线中的试剂名称或结构简式:
试剂1:;试剂2:;产物1:。