浙江省温州市2022-2023学年高三上学期第一次适应性考试化学试题
试卷更新日期:2023-03-08 类型:高考模拟
一、单选题
-
1. 下列含两种金属阳离子的盐是A、 B、 C、 D、2. 下列物质一定能导电的是A、食盐 B、石英 C、盐酸 D、酒精3. 下列仪器可加热的是A、
 B、
B、 C、
C、 D、
D、 4. 下列物质主要成分的化学式正确的是A、黄铁矿:CuFeS2 B、漂粉精:NaClO C、金刚砂:SiC D、孔雀石:2CuCO3·Cu(OH)25. 下列表示错误的是A、SiH4的电子式:
4. 下列物质主要成分的化学式正确的是A、黄铁矿:CuFeS2 B、漂粉精:NaClO C、金刚砂:SiC D、孔雀石:2CuCO3·Cu(OH)25. 下列表示错误的是A、SiH4的电子式: B、甲酸甲酯的实验式:HCOOCH3
C、乙烯的分子结构示意图:
B、甲酸甲酯的实验式:HCOOCH3
C、乙烯的分子结构示意图: D、的VSEPR模型:
D、的VSEPR模型: 6. 下列说法错误的是A、聚乳酸是高分子,由乳酸经加聚反应制备 B、甲酸是最简单的羧酸,最早从蚂蚁中获得 C、萘是稠环芳香烃,可用于杀菌、防蛀、驱虫 D、氧炔焰的温度很高,常用于焊接或切割金属7. 下列说法正确的是A、1H-、2H、3H+具有相同质子数,互为同位素 B、乙酸、硬脂酸互为同系物 C、乙醇和乙醚互为同分异构体 D、碘和碘蒸气互为同素异形体8. 下列说法错误的是A、激光、荧光、LED灯光都与电子跃迁释放能量有关 B、臭氧为弱极性分子,在水中的溶解度高于在四氯化碳中的溶解度 C、等离子体是由电子、阳离子和电中性粒子组成的整体上呈电中性的气态物质 D、由于甲基(--CH3)推电子,甲酸的pKa小于乙酸的pKa9. 下列说法错误的是A、硬铝密度小、强度高,具有较强的抗腐蚀能力,是制造飞机的理想材料 B、普通玻璃以纯碱、石灰石和石英砂为原料,在玻璃窑中反应制得 C、膳食纤维是人体七大营养素之一,在人体内水解为葡萄糖加以吸收利用 D、和的溶液均显碱性,可用作食用碱或工业用碱10. 关于反应3SiO2+6C+2N2Si3N4+6CO,下列说法正确的是A、C在反应过程中被还原 B、Si3N4既是氧化产物又是还原产物 C、氧化剂和还原剂质量之比为1:3 D、每生成14.0g Si3N4共转移1.2mol电子11. 下列说法正确的是A、乙酸乙酯的酸、碱性水解实验,可通过酯层的消失时间比较酯的水解速率 B、焰色实验时,可以用铁丝代替铂丝,使用前都需用稀硫酸清洗干净 C、钾与水反应时,为清楚的观察实验现象,可近距离俯视烧杯 D、粗盐净化过程中,可用Ba(NO3)2除去SO杂质12. 设[aX+bY]为a个X微粒和b个Y微粒组成的一个微粒集合体,NA为阿伏加德罗常数的值,下列说法正确的是A、23gC2H5OH中C—H单键的数目为6NA B、20gND3溶于水形成的氨水溶液中质子数约为10NA C、常温下,pH=2的磷酸溶液中H+数目为0.01NA D、2SO2+O2⇌2SO3 , 则每1mol[2SO2+O2]完全反应转移的电子数等于4NA13. 下列实验对应的离子方程式正确的是A、向饱和食盐水中加浓盐酸析出固体:Na++Cl−NaCl↓ B、在铜片表面滴几滴稀硝酸产生无色气体:Cu+2H+=Cu2++H2↑ C、向Na2CO3溶液中滴加少量氯水:CO+2Cl2+H2O=CO2↑+2Cl−+2HClO D、向血红色Fe(SCN)3溶液中加入过量铁粉至溶液褪色:2Fe3++Fe=3Fe2+14. 下列说法正确的是A、糖类都含有羰基,对氢氧化铜等弱氧化剂表现出还原性 B、蛋白质的一级结构与肽键的形成有关 C、橡胶的硫化程度越高,强度越大,弹性越好 D、氨基酸既易溶于水,又易溶于乙醇、乙醚等溶剂15. 下列关于有机物
6. 下列说法错误的是A、聚乳酸是高分子,由乳酸经加聚反应制备 B、甲酸是最简单的羧酸,最早从蚂蚁中获得 C、萘是稠环芳香烃,可用于杀菌、防蛀、驱虫 D、氧炔焰的温度很高,常用于焊接或切割金属7. 下列说法正确的是A、1H-、2H、3H+具有相同质子数,互为同位素 B、乙酸、硬脂酸互为同系物 C、乙醇和乙醚互为同分异构体 D、碘和碘蒸气互为同素异形体8. 下列说法错误的是A、激光、荧光、LED灯光都与电子跃迁释放能量有关 B、臭氧为弱极性分子,在水中的溶解度高于在四氯化碳中的溶解度 C、等离子体是由电子、阳离子和电中性粒子组成的整体上呈电中性的气态物质 D、由于甲基(--CH3)推电子,甲酸的pKa小于乙酸的pKa9. 下列说法错误的是A、硬铝密度小、强度高,具有较强的抗腐蚀能力,是制造飞机的理想材料 B、普通玻璃以纯碱、石灰石和石英砂为原料,在玻璃窑中反应制得 C、膳食纤维是人体七大营养素之一,在人体内水解为葡萄糖加以吸收利用 D、和的溶液均显碱性,可用作食用碱或工业用碱10. 关于反应3SiO2+6C+2N2Si3N4+6CO,下列说法正确的是A、C在反应过程中被还原 B、Si3N4既是氧化产物又是还原产物 C、氧化剂和还原剂质量之比为1:3 D、每生成14.0g Si3N4共转移1.2mol电子11. 下列说法正确的是A、乙酸乙酯的酸、碱性水解实验,可通过酯层的消失时间比较酯的水解速率 B、焰色实验时,可以用铁丝代替铂丝,使用前都需用稀硫酸清洗干净 C、钾与水反应时,为清楚的观察实验现象,可近距离俯视烧杯 D、粗盐净化过程中,可用Ba(NO3)2除去SO杂质12. 设[aX+bY]为a个X微粒和b个Y微粒组成的一个微粒集合体,NA为阿伏加德罗常数的值,下列说法正确的是A、23gC2H5OH中C—H单键的数目为6NA B、20gND3溶于水形成的氨水溶液中质子数约为10NA C、常温下,pH=2的磷酸溶液中H+数目为0.01NA D、2SO2+O2⇌2SO3 , 则每1mol[2SO2+O2]完全反应转移的电子数等于4NA13. 下列实验对应的离子方程式正确的是A、向饱和食盐水中加浓盐酸析出固体:Na++Cl−NaCl↓ B、在铜片表面滴几滴稀硝酸产生无色气体:Cu+2H+=Cu2++H2↑ C、向Na2CO3溶液中滴加少量氯水:CO+2Cl2+H2O=CO2↑+2Cl−+2HClO D、向血红色Fe(SCN)3溶液中加入过量铁粉至溶液褪色:2Fe3++Fe=3Fe2+14. 下列说法正确的是A、糖类都含有羰基,对氢氧化铜等弱氧化剂表现出还原性 B、蛋白质的一级结构与肽键的形成有关 C、橡胶的硫化程度越高,强度越大,弹性越好 D、氨基酸既易溶于水,又易溶于乙醇、乙醚等溶剂15. 下列关于有机物 的说法错误的是 A、核磁共振氢谱中会出现6组峰 B、所有碳原子都可以处于同一平面上 C、1mol该物质在NaOH溶液中发生水解,最多可消耗2molNaOH D、可以使酸性高锰酸钾溶液褪色16. X、Y、Z、Q、W原子序数依次增大。X的电子只有一种自旋取向,Y和Z的某同位素测定可用于分析古代人类的食物结构,Q单质可用于自来水消毒,W为第4周期金属元素,基态原子无未成对电子且内层电子全满。下列说法一定正确的是A、Z、Y的氢化物稳定性:Z<Y B、Q与Y原子形成的分子空间结构为四面体型 C、Q单质可从Z的简单气态氢化物中置换出Z D、[W(ZX3)4]2+中σ键数为1217. 25℃时, , 下列说法错误的是A、25℃时,电离程度: B、25℃时,浓度为NaHA的pH>7 C、25℃时,溶液中加入与等体积混合后: D、25℃时,pH相同的与NaB的溶液中水的电离程度相同18. 标准状态下,1mol纯物质的相对能量及解离为气态原子时所消耗的能量如下表所示:
的说法错误的是 A、核磁共振氢谱中会出现6组峰 B、所有碳原子都可以处于同一平面上 C、1mol该物质在NaOH溶液中发生水解,最多可消耗2molNaOH D、可以使酸性高锰酸钾溶液褪色16. X、Y、Z、Q、W原子序数依次增大。X的电子只有一种自旋取向,Y和Z的某同位素测定可用于分析古代人类的食物结构,Q单质可用于自来水消毒,W为第4周期金属元素,基态原子无未成对电子且内层电子全满。下列说法一定正确的是A、Z、Y的氢化物稳定性:Z<Y B、Q与Y原子形成的分子空间结构为四面体型 C、Q单质可从Z的简单气态氢化物中置换出Z D、[W(ZX3)4]2+中σ键数为1217. 25℃时, , 下列说法错误的是A、25℃时,电离程度: B、25℃时,浓度为NaHA的pH>7 C、25℃时,溶液中加入与等体积混合后: D、25℃时,pH相同的与NaB的溶液中水的电离程度相同18. 标准状态下,1mol纯物质的相对能量及解离为气态原子时所消耗的能量如下表所示:物质
相对能量/
0
0
x
0
-75
-393.5
解离总耗能/kJ
498
946
632
717
1656
y
下列说法正确的是
A、 B、逐级断开中的每摩尔C—H所消耗的能量均为414kJ C、解离每摩尔C(s,石墨)中的碳碳键平均耗能为239kJ D、根据的可计算出H—O键能19. 冰的晶胞结构如图所示。下列相关说法错误的是 A、晶胞中z方向上的两个氧原子最短距离为d,则冰晶胞中的氢键的长为d B、冰晶体中,相邻的水分子间皆以氢键结合 C、冰密度比干冰的小,主要是因为冰晶体分子间的氢键存在方向性、饱和性 D、硫化氢晶体结构与冰相似20. T℃,反应 , 在密闭容器中达到平衡时的体积为100mL。已知密度:CaO(s):、:。下列有关说法正确的是A、恒温、恒容,体系中再加入56g , 平衡不移动 B、恒温、恒压,体系中再加入100g , 平衡不移动 C、恒温,压缩容器体积,平衡后,反应速率加快 D、恒温、恒压,体系中通入一定量 , 平衡正向移动,建立新的平衡状态21. 一种新型的高性能、低成本的钠型双离子可充电电池,其结构如图所示。采用锡箔(不参与电极反应)作为电池电极及集流体,石墨()为另一极,电解液为作为电解质的溶液。下列有关说法错误的是
A、晶胞中z方向上的两个氧原子最短距离为d,则冰晶胞中的氢键的长为d B、冰晶体中,相邻的水分子间皆以氢键结合 C、冰密度比干冰的小,主要是因为冰晶体分子间的氢键存在方向性、饱和性 D、硫化氢晶体结构与冰相似20. T℃,反应 , 在密闭容器中达到平衡时的体积为100mL。已知密度:CaO(s):、:。下列有关说法正确的是A、恒温、恒容,体系中再加入56g , 平衡不移动 B、恒温、恒压,体系中再加入100g , 平衡不移动 C、恒温,压缩容器体积,平衡后,反应速率加快 D、恒温、恒压,体系中通入一定量 , 平衡正向移动,建立新的平衡状态21. 一种新型的高性能、低成本的钠型双离子可充电电池,其结构如图所示。采用锡箔(不参与电极反应)作为电池电极及集流体,石墨()为另一极,电解液为作为电解质的溶液。下列有关说法错误的是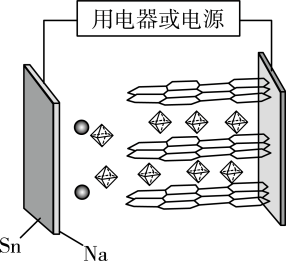 A、放电时,锡箔与钠的合金为负极 B、充电时,图中所示的正八面体形离子嵌入石墨电极 C、电池总反应: D、当外电路通过nmol电子时,锡钠极板质量应减少23ng22. 氯化铬酰()常温下为深红色液体,能与、等互溶,沸点117℃,不存在立体异构,遇水反应并生成两种酸。下列说法错误的是A、中Cr的化合价数与基态原子的价电子数相等 B、结构为四面体而非平面形 C、为离子晶体 D、遇水可发生反应:23. 25℃时,分别向20mL浓度均1.0mol·L−1的CH3COOH、CH3COONa溶液中逐滴加入浓度均1.0mol·L−1NaOH、HCl溶液VmL,溶液的pH与lgY[Y=或]的关系如图所示。下列说法错误的是
A、放电时,锡箔与钠的合金为负极 B、充电时,图中所示的正八面体形离子嵌入石墨电极 C、电池总反应: D、当外电路通过nmol电子时,锡钠极板质量应减少23ng22. 氯化铬酰()常温下为深红色液体,能与、等互溶,沸点117℃,不存在立体异构,遇水反应并生成两种酸。下列说法错误的是A、中Cr的化合价数与基态原子的价电子数相等 B、结构为四面体而非平面形 C、为离子晶体 D、遇水可发生反应:23. 25℃时,分别向20mL浓度均1.0mol·L−1的CH3COOH、CH3COONa溶液中逐滴加入浓度均1.0mol·L−1NaOH、HCl溶液VmL,溶液的pH与lgY[Y=或]的关系如图所示。下列说法错误的是 A、曲线①中的Y= B、当pH=4.74时,恒有关系:c(H+)+c(Na+)=c(OH−)+c(CH3COOH) C、当滴入体积V=10mL时,溶液pH>4.74 D、25℃时,1.0mol·L−1的CH3COONa的pH=9.3724. 将40.8gFe、FeO混合物置于纯氧中加热,迅速被氧化生成46.4g Fe3O4 , 则Fe、FeO的物质的量之比为A、1:3 B、1:2 C、1:1 D、2:125. 下列方案设计、现象和结论都正确的是
A、曲线①中的Y= B、当pH=4.74时,恒有关系:c(H+)+c(Na+)=c(OH−)+c(CH3COOH) C、当滴入体积V=10mL时,溶液pH>4.74 D、25℃时,1.0mol·L−1的CH3COONa的pH=9.3724. 将40.8gFe、FeO混合物置于纯氧中加热,迅速被氧化生成46.4g Fe3O4 , 则Fe、FeO的物质的量之比为A、1:3 B、1:2 C、1:1 D、2:125. 下列方案设计、现象和结论都正确的是目的
方案设计和现象
结论
A
判断KCl的化学键类型
将KCl固体溶于水,进行导电性实验,KCl溶液可导电
KCl中含有离子键
B
验证具有氧化性
向溶液中滴加溶液,褪色
具有氧化性
C
比较与的大小
向饱和溶液滴加相同浓度的溶液,产生白色沉淀
D
鉴别与
取适量固体于试管,插入温度计,加少量水,温度降低
该固体是
A、A B、B C、C D、D二、非选择题
-
26. 完成下列问题。(1)、已知气体溶解度(气体压强为 , 温度为293K,在100g水中的溶解度)数据如下表:
气体
溶解度/g
分子结构特点
乙烷
0.0062
中心原子杂化,轨道半径较大,C负电性(δ-)及H正电性(δ+)不明显
乙炔
0.117
中心原子sp杂化,轨道半径较小,C负电性(δ-)及H正电性(δ+)明显
结合上表信息,说明乙烷与乙炔气体的溶解度存在差异的原因:。
(2)、已知乙酸()的正交晶胞如图所示。阿伏加德罗常数为。
①第一电离能比C、O都大的同周期主族元素是:(填元素符号)。
②乙酸晶胞的密度。
(3)、某笼形络合物结构中,金属离子与连接形成平面层,两个平面层通过分子连接,中间的空隙填充大小合适的分子(如)。其基本结构如图(H原子未画出):
①。
②该结构不是晶胞结构单元,理由是;
③通过分析,金属离子的配位数为(填入序号)。
A.2、3 B.4、6 C.3、4 D.5、6
27. 化合物X含四种元素,某实验小组按如下流程进行相关实验:
已知:①反应I为非氧化还原反应;②溶液D只含1种溶质;③气体F可使品红溶液褪色。请回答下列问题:
(1)、X的组成元素为(写元素符号);D中溶质的化学式为。(2)、金属C与HI溶液反应可生成黄色固体和无色气体,该反应的离子方程式为。(3)、X与稀硫酸反应也可得到A、E、F、G,且E、F的物质的量之比为1:1.写出对应的化学方程式:。(4)、将混合气体B通入足量的NaOH溶液中充分反应,试设计实验检验反应产物中的阴离子:。28. C、CO、是常见还原剂。不同的反应,选择合理的还原剂以达到不同的工艺意图。工业上常见几种还原反应如下:反应I:
反应II:
反应III:
反应IV:
反应V:
回答下列问题。
(1)、从的角度,说明反应I自发进行的可能性:。(2)、①其他条件不变,分别测定CO还原FeO、还原FeO反应体系中,平衡时、CO体积分数与温度的关系如图所示。关于该类还原反应,有关说法错误的是。
A.温度越高,FeO被CO还原的程度越大
B.温度越低,还原生成铁所需的的浓度越大
C.若还原FeO活化能相对较小,则混合气体系中的还原FeO速率由决定
D.宜在低温下进行
②结合反应I及图示信息,说明随温度升高,在平衡体系中,与CO还原FeO的能力发生变化的原因:。
③计算576℃反应III的平衡常数K=。
(3)、根据反应IV,在如图中分别画出、的能量变化,并进行必要的标注。 (4)、已知基元反应的速率方程可表示为:(k为速率常数,下同)。碰撞理论研究发现,大多数化学反应并不是经过简单的碰撞就能完成,往往需经过多个反应步骤才反应过程能实现。用还原合成HI的反应实际上经过两步基元反应完成的:
(4)、已知基元反应的速率方程可表示为:(k为速率常数,下同)。碰撞理论研究发现,大多数化学反应并不是经过简单的碰撞就能完成,往往需经过多个反应步骤才反应过程能实现。用还原合成HI的反应实际上经过两步基元反应完成的:已知快反应近似平衡态。若在温度为T℃下, , 。写出T℃下反应的速率方程:v=(用含、、、a、b的代数式表示)
29. 氢化铝锂()以其优良的还原性广泛应用于医药、农药、香料、染料等行业,实验室按如图流程、装置开展了制备实验(夹持、尾气处理装置已省略)。
已知:①
物质
苯
乙醚
易溶
可溶
难溶
可溶
LiH
微溶
LiCl
难溶
②LiH、在潮湿的空气中都会发生剧烈水解。
③乙醚易燃,一般不与金属单质反应,沸点34.5℃。
请回答:
(1)、仪器a的名称是;装置b的作用是。(2)、乙醚中的少量水分也会对的制备产生严重的影响,以下试剂或操作可有效降低市售乙醚(含水体积分数0.2%)含水量的是____。A、分液 B、钠 C、五氧化二磷 D、通入乙烯(3)、滤渣A的主要成分是。(4)、下列说法错误的是____。A、为提高过滤出滤渣A的速度,可先加水让滤纸紧贴漏斗内壁 B、为提高合成的速率,可将反应温度提高至40℃ C、操作B可在蒸发皿中进行 D、能溶于乙醚与配位键有关(5)、从下列选项中选择属于一系列操作C的最佳操作 , 并排序。a.将操作B剩余液体置于蒸馏烧瓶中
b.将操作B后剩余液体倒入漏斗中过滤
c.用余热蒸干苯
d.开冷凝水、加热
e.将固体放入苯液中进行搅拌、浸泡和反复清洗、过滤
f.转移固体至烧瓶中真空脱苯
g.转移固体至表面皿中低温加热干燥脱
(6)、(不含LiH)纯度可采用如下方法测定(装置如图所示):25℃,常压下,准确称取产品xg,记录量气管B起始体积读数 , 在分液漏斗中准确加入过量的四氢呋喃(可减缓与H2O的反应速率)、水混合液10.0mL,打开旋塞至滴加完所有液体,立即关闭旋塞,调整量气管B读数 , 则的质量分数为(用含x、、的代数式表达)。
注:量气管B由碱式滴定管改装;25℃,常压下气体摩尔体积约为24.5L/mol。
30. 多环氨基甲酰基吡啶酮类似物F作为药物在医学上有广泛的应用
已知:
I.

 (易被氧化)
(易被氧化)II.

III.R′OH+RCl→R′OR
请回答:
(1)、下列说法错误的是____。A、浓硝酸和浓硫酸是反应①②③其中一步的反应试剂 B、化合物A中的含氧官能团是羧基 C、化合物B具有两性 D、反应④的反应类型为加成反应(2)、化合物C的结构简式是;化合物F的分子式是;(3)、写出D+B→F的化学方程式。(4)、设计以为原料合成 的路线(用流程图表示,无机试剂任选)。 (5)、写出同时符合下列条件的化合物B的同分异构体的结构简式。
的路线(用流程图表示,无机试剂任选)。 (5)、写出同时符合下列条件的化合物B的同分异构体的结构简式。①谱和IR谱检测表明:分子中共有5种不同化学环境的氢原子,有键。
②分子中只含有两个六元环,其中一个为苯环。