浙江省余姚市2022-2023学年高三上学期适应性测试化学试题
试卷更新日期:2023-03-08 类型:高考模拟
一、单选题
-
1. 下列物质属于混合物的是A、冰醋酸 B、酒精 C、盐酸 D、小苏打2. 下列属于弱电解质的是A、Na B、HClO C、BaSO4 D、NaOH3. 下列物质化学成分错误的是A、消石灰:Ca(OH)2 B、绿矾:FeSO4·7H2O C、硬脂酸:C17H33COOH D、草酸:HOOC-COOH4. 欲分离某CCl4和H2O的混合液,需要用到的仪器是A、
 B、
B、 C、
C、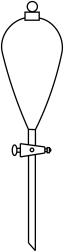 D、
D、 5. 下列表示错误的是A、乙醇的分子式:C2H5OH B、甲醛的球棍模型:
5. 下列表示错误的是A、乙醇的分子式:C2H5OH B、甲醛的球棍模型: C、2-甲基-1,3-丁二烯的键线式:
C、2-甲基-1,3-丁二烯的键线式: D、乙酸乙酯的结构简式:CH3COOCH2CH3
6. 下列说法正确的是A、O2和O3互为同位素 B、C2H4和C3H6一定互为同系物 C、白磷和红磷互为同素异形体 D、乙醇与乙醚互为同分异构体7. 关于有机反应类型,下列判断错误的是A、2CH3CHO + O2 2CH3COOH 氧化反应 B、
D、乙酸乙酯的结构简式:CH3COOCH2CH3
6. 下列说法正确的是A、O2和O3互为同位素 B、C2H4和C3H6一定互为同系物 C、白磷和红磷互为同素异形体 D、乙醇与乙醚互为同分异构体7. 关于有机反应类型,下列判断错误的是A、2CH3CHO + O2 2CH3COOH 氧化反应 B、 加成反应
C、CH3CH2Cl + NaOH CH2=CH2+ NaCl+H2O 消去反应
D、
加成反应
C、CH3CH2Cl + NaOH CH2=CH2+ NaCl+H2O 消去反应
D、
 取代反应
8. 关于反应4(NH4)2SO4 N2↑+6NH3↑+ 3SO2↑+SO3↑+7H2O,以下说法错误的是A、(NH4)2SO4既发生氧化反应也发生还原反应 B、SO2是还原产物 C、生成3molSO2时,转移6 mol电子 D、还原产物与氧化产物的物质的量之比为1:39. 下列说法错误的是A、NaCl饱和溶液中依次通入足量的NH3、CO2 , 可析出NaHCO3 B、纳米铁粉和 FeS 都可以去除水体中的 Cu2+、Hg2+等离子,其原理不相同 C、SO2具有还原性,可用 KMnO4溶液测定食品中SO2残留量 D、二氧化硅是一种酸性氧化物,故不能和酸发生反应10. 下列说法错误的是A、金属镁较轻且硬度大,常用于制造飞机的零部件 B、Al2O3熔点很高,可用作高级耐火材料 C、人体中极少量的NO会促进血管扩张,防止血管栓塞 D、黄绿色气体ClO2是一种高效安全的灭菌消毒剂11. 下列说法错误的是A、可用纸层析法分离含少量 Fe3+和 Cu2+的混合溶液,亲水性强的 Cu2+在滤纸条的下方 B、抽滤过程中洗涤沉淀时,应关小水龙头,加洗涤剂浸没沉淀,用玻璃棒在过滤器上搅拌以使沉淀跟洗涤剂充分接触,以便洗得更干净 C、液溴不慎溅到手上,先用苯清洗伤口,再用水洗;溴中毒时不可进行人工呼吸 D、Na3AlF6溶液中滴加稀氨水无明显白色沉淀12. 下列“类比”结果错误的是A、受热分解生成和 , 则受热分解生成和S B、的分子构型为直线形,则的分子构型也为直线形 C、与溶液反应得到 , 则与溶液反应也得到 D、溶解度大于 , 则溶解度大于13. 能正确表示下列变化的离子方程式是A、KHSO4溶液中滴入Ba(OH)2溶液至中性:H++ +Ba2++OH- = BaSO4↓+H2O B、CuCl2溶液与过量氨水反应:Cu2++2NH3·H2O=Cu(OH)2↓+2 C、KMnO4溶液滴入KOH溶液中微热,得到透明的绿色溶液K2MnO4:4+4OH- 4+O2↑+2H2O D、NH4Al(SO4)2溶液中滴入少量NaOH溶液: +OHˉ= NH3·H2O14. 一种长效、缓释阿司匹林(有机物L)的结构如下图所示:
取代反应
8. 关于反应4(NH4)2SO4 N2↑+6NH3↑+ 3SO2↑+SO3↑+7H2O,以下说法错误的是A、(NH4)2SO4既发生氧化反应也发生还原反应 B、SO2是还原产物 C、生成3molSO2时,转移6 mol电子 D、还原产物与氧化产物的物质的量之比为1:39. 下列说法错误的是A、NaCl饱和溶液中依次通入足量的NH3、CO2 , 可析出NaHCO3 B、纳米铁粉和 FeS 都可以去除水体中的 Cu2+、Hg2+等离子,其原理不相同 C、SO2具有还原性,可用 KMnO4溶液测定食品中SO2残留量 D、二氧化硅是一种酸性氧化物,故不能和酸发生反应10. 下列说法错误的是A、金属镁较轻且硬度大,常用于制造飞机的零部件 B、Al2O3熔点很高,可用作高级耐火材料 C、人体中极少量的NO会促进血管扩张,防止血管栓塞 D、黄绿色气体ClO2是一种高效安全的灭菌消毒剂11. 下列说法错误的是A、可用纸层析法分离含少量 Fe3+和 Cu2+的混合溶液,亲水性强的 Cu2+在滤纸条的下方 B、抽滤过程中洗涤沉淀时,应关小水龙头,加洗涤剂浸没沉淀,用玻璃棒在过滤器上搅拌以使沉淀跟洗涤剂充分接触,以便洗得更干净 C、液溴不慎溅到手上,先用苯清洗伤口,再用水洗;溴中毒时不可进行人工呼吸 D、Na3AlF6溶液中滴加稀氨水无明显白色沉淀12. 下列“类比”结果错误的是A、受热分解生成和 , 则受热分解生成和S B、的分子构型为直线形,则的分子构型也为直线形 C、与溶液反应得到 , 则与溶液反应也得到 D、溶解度大于 , 则溶解度大于13. 能正确表示下列变化的离子方程式是A、KHSO4溶液中滴入Ba(OH)2溶液至中性:H++ +Ba2++OH- = BaSO4↓+H2O B、CuCl2溶液与过量氨水反应:Cu2++2NH3·H2O=Cu(OH)2↓+2 C、KMnO4溶液滴入KOH溶液中微热,得到透明的绿色溶液K2MnO4:4+4OH- 4+O2↑+2H2O D、NH4Al(SO4)2溶液中滴入少量NaOH溶液: +OHˉ= NH3·H2O14. 一种长效、缓释阿司匹林(有机物L)的结构如下图所示:
下列分析错误的是
A、有机物L为高分子化合物 B、1 mol 有机物L最多能与2n mol NaOH反应 C、有机物L能发生加成、取代、氧化、水解反应 D、有机物L在体内可缓慢水解,逐渐释放出 15. 如图是元素周期表的一部分。X、Y、Z、W均为短周期元素,若Z原子序数是Y的两倍,则下列说法错误的是
15. 如图是元素周期表的一部分。X、Y、Z、W均为短周期元素,若Z原子序数是Y的两倍,则下列说法错误的是X
Y
Z
W
A、X元素的简单氢化物分子间可以形成氢键 B、Y元素与X、Z、W元素均可形成两种以上的化合物 C、最高价氧化物对应水化物的酸性:W>Z D、阴离子半径由大到小的顺序为:X>Y>Z>W16. 关于化合物HOO-SO3H的性质,下列推测不合理的是A、具有强氧化性 B、水解可生成H2O2和H2SO4 C、具有强酸性 D、与足量NaOH溶液反应最终产物为Na2SO4和H2O217. 相同温度和压强下,关于物质熵的大小比较,不合理的是A、31g白磷(s)< 31g红磷(s) B、1 molH2(g) < 2 molH2(g) C、1mol H2O(s)< 1molH2O(l) D、1molH2S(g) > 1molH2O(g)18. 设NA为阿伏加德罗常数的值,下列说法正确的是A、标准状况下,2.24L H2O中含有电子数为NA B、12g金刚石中的共价键数目为2NA C、0.1mol/L的NaOH水溶液中含有Na+数目为0.01NA D、1mol CnH2n+2含有 (2n+1)NA个共价键19. 下列说法正确的是A、为确定某酸H2A是强酸还是弱酸,可通过在常温下测NaHA溶液的pH,若pH>7,则H2A一定是弱酸 B、用NaOH标准溶液滴定CH3COOH溶液至中性时,CH3COOH溶液恰好被中和 C、向冰醋酸中不断加水,溶液的pH不断增大 D、25℃和40℃时,0.1 mol·L-1的氨水的pH不相等,而25℃和40℃时,0.1 mol·L-1的氢氧化钠溶液的pH相等20. 室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBrC2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是A、加入NaOH,可增大乙醇的物质的量 B、将氢溴酸改成NaBr(s)和浓硫酸,可能有利于生成C2H5Br C、若反应物增大至2 mol,则两种反应物平衡转化率之比不变 D、若起始温度提高至60℃,可缩短反应达到平衡的时间21. 根据以下H2和Cl2反应生成HCl的能量循环图:
下列说法正确的是
A、∆H4>0 B、∆H1<0 C、∆H1+∆H2+∆H3-∆H4=0 D、∆H3>∆H422. 利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是 A、该燃料电池的总反应为:N2+3H22NH3 B、相比现有工业合成氨,该方法条件温和,同时还可提供电能 C、正极电极反应为:N2+6e-+6H2O=2NH3+6OH- D、电池工作时质子通过交换膜由负极区向正极区移动23. 在25 ℃时,将1.0 L x mol·L-1CH3COOH溶液与0.1 mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量变化如图所示。下列叙述错误的是
A、该燃料电池的总反应为:N2+3H22NH3 B、相比现有工业合成氨,该方法条件温和,同时还可提供电能 C、正极电极反应为:N2+6e-+6H2O=2NH3+6OH- D、电池工作时质子通过交换膜由负极区向正极区移动23. 在25 ℃时,将1.0 L x mol·L-1CH3COOH溶液与0.1 mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量变化如图所示。下列叙述错误的是 A、水的电离程度:a>b>c B、a点对应的混合溶液中:c(CH3COO-)=c(Na+)>c(OH-)=c(H+) C、b点对应的混合溶液中:c(CH3COOH)= mol·L-1 D、该温度下,CH3COOH的电离平衡常数均为Ka=24. 2021年Benjamin List 和Dave MacMillan因不对称有机催化获得诺贝尔化学奖。他们利用有机小分子代替传统的金属催化剂进行不对称合成,脯氨酸是最常见的有机小分子催化剂,下图利用脯氨酸催化Aldol反应的机理如下图所示:
A、水的电离程度:a>b>c B、a点对应的混合溶液中:c(CH3COO-)=c(Na+)>c(OH-)=c(H+) C、b点对应的混合溶液中:c(CH3COOH)= mol·L-1 D、该温度下,CH3COOH的电离平衡常数均为Ka=24. 2021年Benjamin List 和Dave MacMillan因不对称有机催化获得诺贝尔化学奖。他们利用有机小分子代替传统的金属催化剂进行不对称合成,脯氨酸是最常见的有机小分子催化剂,下图利用脯氨酸催化Aldol反应的机理如下图所示:
下列说法错误的是
A、Aldol反应方程式: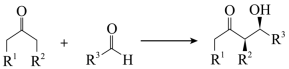 B、1→2为消去反应,2→3为加成反应
C、化合物3和4互为同分异构体
D、中间体3中存在氢键
25. 下列方案设计、现象和结论都正确的是
B、1→2为消去反应,2→3为加成反应
C、化合物3和4互为同分异构体
D、中间体3中存在氢键
25. 下列方案设计、现象和结论都正确的是目的
方案设计
现象和结论
A
探究乙醇消去反应的产物
取4mL乙醇,加入12mL浓硫酸、沸石,迅速升温至170℃,将产生的气体通入2mLKMnO4溶液中
若KMnO4溶液褪色,则乙醇消去反应的产物为乙烯
B
探究 Fe 与水蒸气高温反应的固体产物中铁元素的化合价
取少量固体产物于试管中,先加足量硫酸铜溶液,过滤,再向过滤后固体中加足量的稀硫酸溶解,分成两份:一份中滴加硫氰化钾溶液,另一份中滴加高锰酸钾溶液
若前者溶液变血红色,后者溶液紫色褪去,则固体产物中铁元素有+2、+3 两种化合价
C
检验某牙膏中是否存在甘油
取少量该牙膏样品于试管中,加适量蒸馏水,搅拌、静置,取上层清液,加入适量新制氢氧化铜,观察现象
若产生绛蓝色沉淀,则该牙膏中含甘油
D
探究Na2SO3固体样品是否变质
取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入足量BaCl2溶液
若有白色沉淀产生,则样品已经变质
A、A B、B C、C D、D二、非选择题
-
26. 回答下列问题:(1)、NaCl、MgCl2和AlCl3的熔点如表:
NaCl
MgCl2
AlCl3
熔点/℃
801
714
194
NaCl、MgCl2熔点比AlCl3熔点高的原因是。
(2)、苯甲酸的电离平衡常数为Ka=6.4×10-5 , 为什么邻羟基苯甲酸(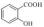 )的电离平衡常数Ka1为苯甲酸的15.9 倍、而间羟基苯甲酸(
)的电离平衡常数Ka1为苯甲酸的15.9 倍、而间羟基苯甲酸( )的电离平衡常数为苯甲酸的1.26倍?。 27. 室温时,20mL某气态烃与过量的氧气混合,将完全燃烧后的产物通过浓硫酸,再恢复至室温,气体体积减少了50mL。将剩余的气体再通过足量氢氧化钠溶液后干燥,体积又减少了40mL。(1)、该气态烃的分子式。(2)、写出简要计算过程 。28. 阴阳离子比为1:2的固体离子化合物X由3种元素组成,某学习小组开展如下探究实验:
)的电离平衡常数为苯甲酸的1.26倍?。 27. 室温时,20mL某气态烃与过量的氧气混合,将完全燃烧后的产物通过浓硫酸,再恢复至室温,气体体积减少了50mL。将剩余的气体再通过足量氢氧化钠溶液后干燥,体积又减少了40mL。(1)、该气态烃的分子式。(2)、写出简要计算过程 。28. 阴阳离子比为1:2的固体离子化合物X由3种元素组成,某学习小组开展如下探究实验:
已知,溶液B中仅有一种阳离子(氢离子除外),溶液B中的某种溶质阴离子结构与化合物X阴离子结构相似,C、D均为纯净物。请回答:
(1)、砖红色沉淀C的化学式为。(2)、化合物X的化学式为。(3)、蓝色溶液B中含有的溶质是(用化学式表示)。(4)、写出溶液B与乙醛反应的离子方程式。(5)、某同学怀疑砖红色沉淀中可能含有Cu单质,请设计实验验证此猜想。29.(1)、I.1mol CO2与足量的碳在恒容密闭容器中反应:C(s)+CO2(g) 2CO(g)。测得平衡时,体系中气体体积分数与温度的关系如下图所示:
已知:气体分压(p分)=气体总压(p总)×体积分数。
请回答:
判断该反应的自发性并说明理由。
(2)、下列说法正确的是____。A、1×103K时,若充入惰性气体,v正、v逆均减小,v逆变化幅度更大 B、1×103K时,突然升温,v正、v逆均增大,v正变化幅度更大 C、1×103K时,反应达平衡后CO2的转化率为25.0 % D、T×103K时,若充入等体积的CO2和CO,平衡向逆反应方向移动(3)、1×103K时,起始压强为100KPa,反应一段时间达到平衡,用平衡分压p(B)代替平衡浓度表示的化学平衡常数Kp=KPa (保留三位有效数字)。【p(B)= p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数】(4)、已知,在上述条件下(初始投料为1molCO2与足量的碳,恒容密闭容器中),在给定CO2的转化率为25.0 %时,V逆随温度的变化曲线如下图所示,画出V正随温度(0.5×103K至2.5×103K)的变化曲线。 (5)、II.碘酸盐型碘钟的实验方法:向用H2SO4酸化的KIO3溶液中加入NaHSO3溶液(以及少量淀粉溶液)。实验现象:“无色→蓝黑色→无色→蓝黑色→……”的周期性变化。
(5)、II.碘酸盐型碘钟的实验方法:向用H2SO4酸化的KIO3溶液中加入NaHSO3溶液(以及少量淀粉溶液)。实验现象:“无色→蓝黑色→无色→蓝黑色→……”的周期性变化。可用一组离子方程式表示每一个周期内的反应进程,请补充其中的2个离子方程式。
①;②+5I -+ 6H+ = 3I2+3H2O;③。
30. 二氯亚砜(SOCl2)是有机合成中常用的氯化剂,实验室用如图装置(夹持装置已省略)制备SOCl2。
已知:①SCl2+SO3 =SOCl2+SO2 ;
②常压下,SOCl2熔点-104.5℃,沸点79℃,极易水解;SCl2熔点-78℃,沸点56.9℃,加热至40℃以上,部分开始分解;SO3熔点17℃,沸点45℃。
请回答:
(1)、装置A中加入纯净的发烟硫酸(H2SO4·nSO3),装置B中加入SCl2 , 加入发烟硫酸目的是。(2)、关于装置,下列说法错误的是____。A、可对装置A进行慢慢加热 B、需对装置B加热,以加快反应速率 C、装置C中冷凝水流向应下进上出 D、装置D所加试剂为NaOH溶液,主要目的是除SO2 , 防止污染环境(3)、二氯亚砜在稍高于沸点的温度下会发生明显的分解,分解产物为S2Cl2和一种常温为无色刺激性气味气体A和单质气体B,写出化学反应方程式。(4)、反应结束后,装置B中除SOCl2外还含有少量SCl2和SO3 , 可用蒸馏法进行提纯。针对蒸馏,从下列选项选择合适操作并排序:a→( ▲ )→( ▲ )→( ▲ )→( ▲ )→( ▲ )→( ▲ )→蒸馏结束。
a.搭建蒸馏装置| b.通冷凝水 c.检查气密性 d.加热蒸馏烧瓶
e.收集45-60℃馏分 f.收集76-77℃馏分 g.加试剂,加沸石
(5)、可用碘量法测定产品中 SOCl2的纯度。步骤如下:①称取m g SOCl2于装有过量NaOH溶液的密封良好的水解瓶中,水解完全后,将溶液全部移入 500mL容量瓶中,用移液管准确吸取试样溶液 50mL 于250mL碘量瓶中,加两滴对硝基酚指示剂、滴加 2mol/L盐酸溶液至黄色刚好消失。
②准确加入V mL c0 mol/L的碘标准溶液,避光放置30min。
③用 c1 mol/L的硫代硫酸钠标准溶液返滴过量的碘,临近终点时加淀粉指示剂,继续滴定至蓝色消失为终点,消耗硫代硫酸钠V1mL。
④同时按样品同样操作(将样品换成50mL水,再进行②、③)做一空白试验,消耗硫代硫酸钠V2 mL。
已知:SOCl2+4NaOH=Na2SO3+2NaCl+2H2O;
Na2SO3+H2O+I2=Na2SO4+2HI;
I2+2Na2S2O3=Na2S4O6+2NaI。
(i)步骤①滴加 2mol/L盐酸溶液的原因是。
(ii)则SOCl2的纯度为(用m 、c1、V1、V2 )。
31. 某课题组研制了药物Kenolide-A的中间体H,合成路线如下:
已知:①
 ②R1CHO+
②R1CHO+

请回答:
(1)、化合物D的结构简式是。(2)、下列说法正确的是____。A、化合物B分子中所有的碳原子一定共平面 B、化合物E含有三个手性碳原子 C、化合物C和D发生加成反应生成E D、化合物H的分子式为C15H24O3(3)、写出E→F的化学方程式是。(4)、写出3种同时满足下列条件的化合物C的同分异构体的结构简式(不考虑立体异构体):。①1H-NMR谱显示只有2种不同化学环境的氢原子;②不超过1个环;
(5)、以甲醇和丙酮为原料,设计A的合成路线(用流程图表示,无机试剂、有机溶剂任选)。