湖南省百校2023届高三开年摸底联考化学试题
试卷更新日期:2023-03-08 类型:开学考试
一、单选题
-
1. 从日常生活到科技前沿,化学无处不在。下列说法正确的是A、热水泡茶涉及萃取、分液等操作 B、天然奶油是从牛奶或羊奶中提取出的半固态物质,属于蛋白质 C、速滑竞赛服使用聚氨酯材料可减少空气阻力,聚氨酯是高分子材料 D、用于制造“山东舰”上舰载机降落拦阻索的特种钢,属于新型无机非金属材料2. 下列实验操作或装置(略去部分夹持仪器)正确的是
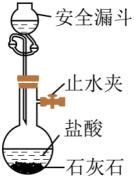
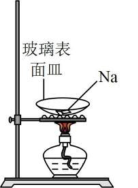
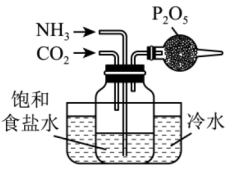
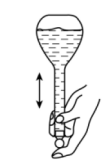
A.制取少量
B.钠的燃烧
C.制备
D.配制一定物质的量浓度的溶液
A、A B、B C、C D、D3. 已知氯化1-乙基-3-甲基咪唑(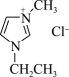 )被广泛应用于有机合成和聚合反应、分离与提纯以及电化学研究中。下列说法错误的是 A、电负性: B、五元环处于同一平面,则两个氮原子的杂化方式分别为、 C、氯化1-乙基-3-甲基咪唑中含有键数目为 D、氯化1-乙基-3-甲基咪唑中的化学键类型:离子键、共价键4. 绿柱石()是一种重要的矿物。X、Y、Z、W为短周期元素,原子序数依次增加,且价电子数和为15,X、Z、W处于相邻的主族,和的电荷与半径之比相近,导致两元素性质相似。下列说法正确的是A、第一电离能:Z<W,第二电离能:Z>W B、原子半径:Z>W>Y>X C、XY是碱性氧化物,是酸性氧化物 D、已知W、Y都可与氢气生成氢化物,电负性Y>W>H5. 下列有关海水综合利用的离子方程式错误的是( )A、海水提镁中用石灰乳沉镁: B、海水提溴中用水溶液富集溴: C、氯碱工业中电解饱和食盐水: D、侯氏制碱法中获取碳酸氢钠:6. 二氧化锗常用作有机物的催化剂以及半导体的原料。一种从烟尘(主要成分为 , 含、、、等杂质)中提纯二氧化锗的工艺流程如下
)被广泛应用于有机合成和聚合反应、分离与提纯以及电化学研究中。下列说法错误的是 A、电负性: B、五元环处于同一平面,则两个氮原子的杂化方式分别为、 C、氯化1-乙基-3-甲基咪唑中含有键数目为 D、氯化1-乙基-3-甲基咪唑中的化学键类型:离子键、共价键4. 绿柱石()是一种重要的矿物。X、Y、Z、W为短周期元素,原子序数依次增加,且价电子数和为15,X、Z、W处于相邻的主族,和的电荷与半径之比相近,导致两元素性质相似。下列说法正确的是A、第一电离能:Z<W,第二电离能:Z>W B、原子半径:Z>W>Y>X C、XY是碱性氧化物,是酸性氧化物 D、已知W、Y都可与氢气生成氢化物,电负性Y>W>H5. 下列有关海水综合利用的离子方程式错误的是( )A、海水提镁中用石灰乳沉镁: B、海水提溴中用水溶液富集溴: C、氯碱工业中电解饱和食盐水: D、侯氏制碱法中获取碳酸氢钠:6. 二氧化锗常用作有机物的催化剂以及半导体的原料。一种从烟尘(主要成分为 , 含、、、等杂质)中提纯二氧化锗的工艺流程如下
已知:在浓盐酸中的溶解度很低。下列说法正确的是
A、在滤液中加入固体调 , 先得沉淀,后得沉淀 B、“沉锗”后分离出单宁与的产物所用玻璃仪器为玻璃棒、分液漏斗、烧杯 C、水解的离子方程式为 D、“水解”操作时为保证 , 水解彻底进行,需加入过量高纯水7. 中国科学技术大学科研人员开发了一种高性能的水系锰基锌电池。该装置获得电能的同时可以制得 , 其工作原理如图所示,下列说法正确的是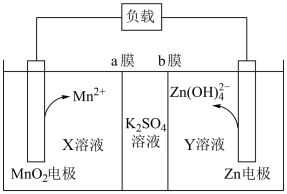 A、电池放电时,正极区溶液的pH降低 B、a膜为阳离子交换膜,b膜为阴离子交换膜 C、X溶液中的溶质只能为 , Y溶液中溶质只能为KOH D、放电时,消耗1mol Zn时,正极区电解质溶液增重87g8. 贝诺酯是新型消炎、解热。镇痛、治疗风湿病的药物,其合成过程如下:
A、电池放电时,正极区溶液的pH降低 B、a膜为阳离子交换膜,b膜为阴离子交换膜 C、X溶液中的溶质只能为 , Y溶液中溶质只能为KOH D、放电时,消耗1mol Zn时,正极区电解质溶液增重87g8. 贝诺酯是新型消炎、解热。镇痛、治疗风湿病的药物,其合成过程如下: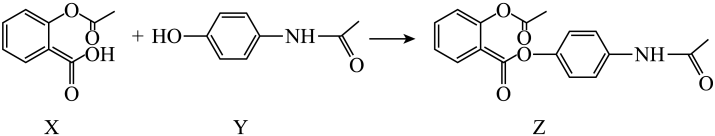
下列说法错误的是
A、三种物质中均含有2种官能团 B、物质X中所有碳原子均为杂化 C、物质Y遇溶液显紫色 D、最多与反应9. 氮化硼是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到和 , 如图所示。下列叙述正确的是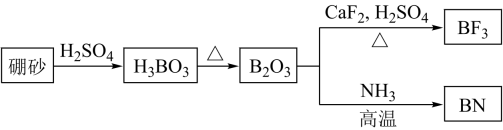 A、硼酸具有片层状结构,层与层之间,单元间都以范德华力连接 B、立方氮化硼结构与金刚石相似。立方氮化硼晶胞中每个氮原子周围有4个硼原子 C、与反应后再用氨气中和得到 , 含有配位键的数目为 D、与都是由极性键构成的极性分子10. 氢气和二氧化碳在催化剂作用下合成甲醇的反应为放热反应,催化过程可解释为“吸附-活化-解离”的过程,催化反应机理如图所示。下列说法正确的是
A、硼酸具有片层状结构,层与层之间,单元间都以范德华力连接 B、立方氮化硼结构与金刚石相似。立方氮化硼晶胞中每个氮原子周围有4个硼原子 C、与反应后再用氨气中和得到 , 含有配位键的数目为 D、与都是由极性键构成的极性分子10. 氢气和二氧化碳在催化剂作用下合成甲醇的反应为放热反应,催化过程可解释为“吸附-活化-解离”的过程,催化反应机理如图所示。下列说法正确的是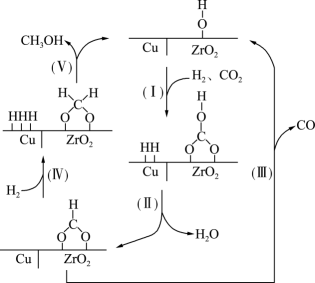 A、反应过程中I-V步,C元素化合价不变 B、单位时间内生成的水越多,则甲醇的产率越大 C、增大催化剂的表面积,可以提高甲醇的平衡产率 D、氢气和二氧化碳在催化反应过程中有副产物生成11. 室温下,下列实验探究方案不能得到相应结论的是
A、反应过程中I-V步,C元素化合价不变 B、单位时间内生成的水越多,则甲醇的产率越大 C、增大催化剂的表面积,可以提高甲醇的平衡产率 D、氢气和二氧化碳在催化反应过程中有副产物生成11. 室温下,下列实验探究方案不能得到相应结论的是选项
探究方案
探究结论
A
向饱和的溶液中CuS固体,测得溶液中不变
B
将25℃溶液加热到40℃,用传感器检测到溶液pH逐渐变小
温度升高,水解平衡正向移动,浓度增大
C
用一定浓度的NaOH滴定一定体积、浓度的草酸(、弱酸)溶液(用甲基橙作指示剂)
确定草酸是二元酸
D
利用晶体X射线衍射可测定原子坐标
确定分子的空间结构
A、A B、B C、C D、D12. 羟基自由基()具有极强的氧化能力,它能有效地氧化降解废水中的有机污染物。在直流电源作用下,利用双极膜电解池产生羟基自由基()处理含苯酚废水和含甲醛废水的原理如图所示。已知:双极膜中间层中的解离为和。下列说法错误的是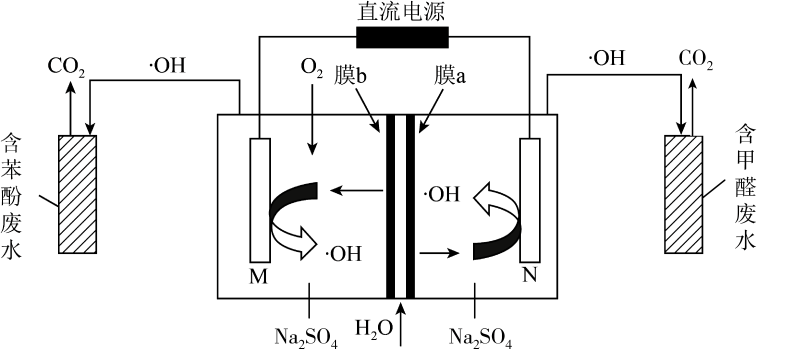 A、双极膜将水解离为和的过程是物理变化 B、阴极电极反应式为 C、每处理9.4g苯酚,理论上有2.8mol透过膜a D、通电一段时间后,苯酚和甲醛转化生成物质的量之比为7∶613. 在一定温度下,以为催化剂,氯苯和在溶液中发生反应
A、双极膜将水解离为和的过程是物理变化 B、阴极电极反应式为 C、每处理9.4g苯酚,理论上有2.8mol透过膜a D、通电一段时间后,苯酚和甲醛转化生成物质的量之比为7∶613. 在一定温度下,以为催化剂,氯苯和在溶液中发生反应反应①:(邻二氯苯)
反应②:(对二氯苯)
反应①和②存在的速率方程:和 , 、为速率常数,只与温度有关,反应①和②的曲线如图所示。下列说法错误的是
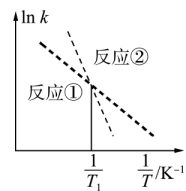 A、若对二氯苯比邻二氯苯稳定,则 B、保持反应体系温度恒定,体系中两种有机产物的浓度之比保持不变 C、通过改变催化剂可以提高产物中对二氯苯的比例 D、相同时间内,(对二氯苯)(邻二氯苯)14. 难溶盐可溶于盐酸,常温下,用调节浊液的 , 测得体系中或与的关系如图所示。下列说法错误的是
A、若对二氯苯比邻二氯苯稳定,则 B、保持反应体系温度恒定,体系中两种有机产物的浓度之比保持不变 C、通过改变催化剂可以提高产物中对二氯苯的比例 D、相同时间内,(对二氯苯)(邻二氯苯)14. 难溶盐可溶于盐酸,常温下,用调节浊液的 , 测得体系中或与的关系如图所示。下列说法错误的是 A、M代表与的变化曲线 B、难溶盐的溶度积常数 C、Y点的溶液中存在 D、Z点的溶液中存在15. 镍电池的电极活性材料为多组分合金(主要成分为镍、钴,还含有铝、铁等),可重新回收利用。利用废镍电池资源化生产醋酸钴晶体的工艺流程如下。
A、M代表与的变化曲线 B、难溶盐的溶度积常数 C、Y点的溶液中存在 D、Z点的溶液中存在15. 镍电池的电极活性材料为多组分合金(主要成分为镍、钴,还含有铝、铁等),可重新回收利用。利用废镍电池资源化生产醋酸钴晶体的工艺流程如下。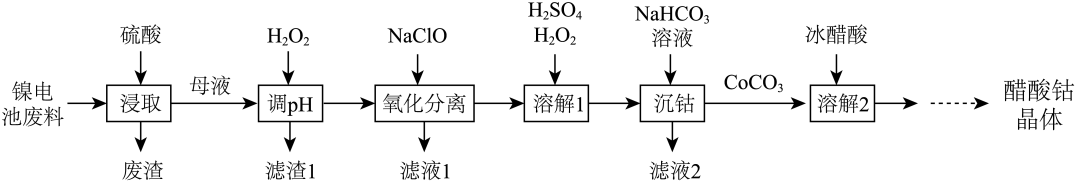
已知:①浸取母液中除铝元素外,其他金属元素的化合价均为价。
②部分金属阳离子沉淀的如下表。
沉淀物
开始沉淀
2.2
7.4
7.6
0.1
4.0
7.6
完全沉淀
3.2
8.9
9.2
1.1
5.2
9.2
请回答下列问题:
(1)、“浸取”时可以提高浸取率的操作有(任写1条)。(2)、“调”时溶液的范围是 , 所得滤渣1的主要成分为(填化学式)。(3)、“氧化分离”操作控制溶液 , 加入发生反应的离子方程式为。(4)、“溶解1”操作中加入的作用为 , “沉钴”操作过程中发生反应的离子方程式为。(5)、“溶解2”操作后得到醋酸钴晶体,要使该醋酸钴晶体的纯度更高,所采取的实验操作名称应为。(6)、碱金属可以插入石墨层中,钾的石墨插层化合物具有超导性,其中K层平行于石墨层。图1为其晶胞图,垂直于石墨层方向的原子投影如图2所示。
C—C键的键长为 , 则K层中m与n两个K原子之间的距离为 , 设为阿伏加德罗常数的值,若晶胞参数分别为、、 , 则该石墨插层化合物的晶胞密度为(用含x、y、z、的代数式表示)。
16. 碘酸钙为白色固体,微溶于水,是一种无机精细与专用化学品。一种制备并测定六水合碘酸钙含量的实验设计如下。步骤I:碘酸氢钾的制备
在三颈烧瓶中加入碘、氯酸钾和水,滴加的盐酸至 , 控制温度85℃左右,装置如图。
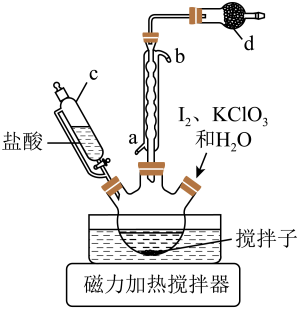
步骤II:碘酸钙晶体的制备
将步骤I反应后的溶液转入烧杯中,加入X溶液调节;继续滴加溶液,充分反应后用冰水冷却,抽滤、洗涤、干燥,得粗产品碘酸钙晶体。
步骤III:产品中碘酸钙晶体含量测定
①准确称取粗产品,置于烧杯中,加入溶解样品,转移到容量瓶中定容。量取溶液于碘量瓶中,加入稍过量的 , 然后用标准溶液滴定至浅黄色,加入2滴淀粉溶液,继续滴定至终点,平行测定三次后取平均值,用去标准溶液。
②空白实验:不取产品,其余试剂用量和步骤相同,消耗标准溶液。
已知: , ,
请回答下列问题:
(1)、仪器c的名称为 , 步骤I中有黄绿色气体产生,则制备反应的化学方程式为 , 干燥管d中的试剂是。(2)、步骤I中温度不宜过高的原因是 , 判断反应结束的实验现象是。(3)、步骤II中X溶液是 , 反应后用冰水冷却的目的是。(4)、步骤III中空白实验的主要目的是。(5)、碘酸钙晶体中的纯度为(计算结果保留两位小数)。17. 我国科学家首次实现了二氧化碳到淀粉的人工合成,关键的一步是利用化学催化剂将高浓度还原成。催化加氢制的反应体系中,发生的主要反应如下。I.
II.
III.
回答下列问题:
(1)、已知上述反应I、II、III的平衡常数K与温度T的关系为: , , (x、y、z、A、B、C均为常数,A、C均大于零,B小于零)。则反应I的活化能(正)(逆),的数值范围是。(2)、反应I可能的反应历程如下图所示。已知:方框内包含微粒种类及数目、微粒的相对总能量;TS表示过渡态、*表示吸附在催化剂上的微粒。
则反应历程中决速步骤的反应方程式为。
(3)、在催化剂作用下,将和的混合气体充入一恒容密闭容器中进行反应,达平衡时,的转化率和容器中混合气体的平均相对分子质量随温度变化如图。
①250℃后,随温度升高,平衡时混合气体的平均相对分子质量几乎不变的原因是。
②T℃时,反应的初始压强为 , 平衡时甲醇的选择性(生成甲醇消耗的在总消耗量中占比)为 , 反应I的平衡常数(为以分压表示的平衡常数,分压=总压×物质的量的分数)。若再向密闭容器中通入和 , 使二者分压均增大 , 则的转化率(填“增大”“减小”或“不变”)。
18. 化合物I是一种治疗抑郁症的药物,一种合成路线如下。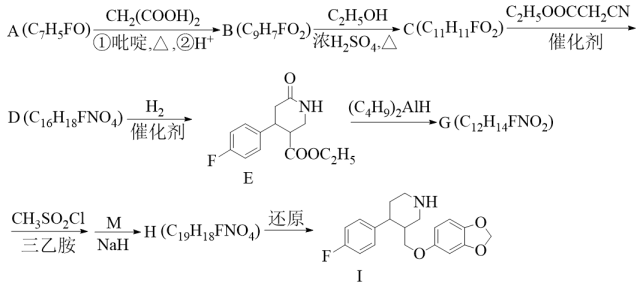
已知:i.
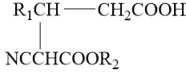
ii.
回答下列问题:
(1)、A的名称为 , C中官能团有种。(2)、B→C反应的化学方程式为。(3)、C→D的反应类型为 , G的结构简式为。(4)、M的分子式为 , 则M的结构简式为 , 则M的同分异构体中,满足下列条件的有种。①遇溶液变紫色;②只含一个环状结构;③该有机物与足量金属钠反应生成。
(5)、已知i.;ii.

根据相关信息,写出
 为主要原料制备M的合成路线:。
为主要原料制备M的合成路线:。