重庆市大渡口区2023年中考第一次适应性检测化学试题
试卷更新日期:2023-03-08 类型:中考模拟
一、单选题
-
1. 下列变化中,属于化学变化的是A、绢布刺绣 B、干冰升华 C、切割玻璃 D、高粱酿酒2. 下列物质不属于空气污染物的是A、二氧化碳 B、一氧化碳 C、二氧化硫 D、可吸入颗粒物3. 下列符号既能表示一种元素,又能表示一个原子,还能表示一种单质的是A、H B、N2 C、H2O D、Cu4. 下图所示实验操作正确的是A、
 过滤
B、
过滤
B、 倾倒液体
C、
倾倒液体
C、 检查气密性
D、
检查气密性
D、 称量NaCl
5. 妈妈烘焙蛋糕时散发出阵阵香味,说明分子具有的性质是A、分子体积很小 B、分子间间隔很小 C、分子在不断运动 D、分子可以再分6. 古语道:“人要实、火要虚”,此话提醒人们,燃烧固体燃料时需要将其架空,燃烧才能更旺。根据你所学过的知识判断,“火要虚”的原因是A、加快散热的速度 B、提高空气中氧气的含量 C、降低可燃物的着火点 D、增大可燃物与空气的接触面积7. 分类是学习化学常用的方法。下列物质分类正确的是A、金属元素:锂、硼、氟 B、单质:液氧、钢铁、水银 C、氧化物:冰水混合物、干冰、氧化铜 D、混合物:稀盐酸、活性炭、金刚石8. 下列关于氮气用途的叙述中,错误的是A、制成有色电光源 B、医疗冷冻麻醉 C、食品防腐 D、制造化肥9. 从中药中提取的绿原酸(化学式为C16H18O9)有很好的抗癌功效。下列关于绿原酸的说法错误的是A、由三种元素组成 B、含有43个原子 C、所含氢元素的质量分数最小 D、在空气中燃烧可能生成CO210. 推理是学习化学的一种重要的思维方法,下列推理正确的是A、置换反应有单质生成,则有单质生成的反应一定是置换反应 B、蜡烛燃烧生成CO2和H2O,则蜡烛组成中一定含有碳、氢元素 C、单质是由一种元素组成的纯净物,则只含有一种元素的物质一定是单质 D、同种元素原子的电子数相同,所以具有相同电子数的粒子一定是同种元素11. 氮化镓晶体可作为蓝色LED光源的基础材料。关于镓元素在元素周期表中的信息及原子的结构示意图如图,下列说法错误的是
称量NaCl
5. 妈妈烘焙蛋糕时散发出阵阵香味,说明分子具有的性质是A、分子体积很小 B、分子间间隔很小 C、分子在不断运动 D、分子可以再分6. 古语道:“人要实、火要虚”,此话提醒人们,燃烧固体燃料时需要将其架空,燃烧才能更旺。根据你所学过的知识判断,“火要虚”的原因是A、加快散热的速度 B、提高空气中氧气的含量 C、降低可燃物的着火点 D、增大可燃物与空气的接触面积7. 分类是学习化学常用的方法。下列物质分类正确的是A、金属元素:锂、硼、氟 B、单质:液氧、钢铁、水银 C、氧化物:冰水混合物、干冰、氧化铜 D、混合物:稀盐酸、活性炭、金刚石8. 下列关于氮气用途的叙述中,错误的是A、制成有色电光源 B、医疗冷冻麻醉 C、食品防腐 D、制造化肥9. 从中药中提取的绿原酸(化学式为C16H18O9)有很好的抗癌功效。下列关于绿原酸的说法错误的是A、由三种元素组成 B、含有43个原子 C、所含氢元素的质量分数最小 D、在空气中燃烧可能生成CO210. 推理是学习化学的一种重要的思维方法,下列推理正确的是A、置换反应有单质生成,则有单质生成的反应一定是置换反应 B、蜡烛燃烧生成CO2和H2O,则蜡烛组成中一定含有碳、氢元素 C、单质是由一种元素组成的纯净物,则只含有一种元素的物质一定是单质 D、同种元素原子的电子数相同,所以具有相同电子数的粒子一定是同种元素11. 氮化镓晶体可作为蓝色LED光源的基础材料。关于镓元素在元素周期表中的信息及原子的结构示意图如图,下列说法错误的是 A、镓的原子核内有31个质子 B、镓的原子核外有四个电子层 C、镓的相对原子质量是69.72g D、镓原子容易失去3个电子变成镓离子12. 下列实验不能达到实验目的是
A、镓的原子核内有31个质子 B、镓的原子核外有四个电子层 C、镓的相对原子质量是69.72g D、镓原子容易失去3个电子变成镓离子12. 下列实验不能达到实验目的是



A.探究CaO与水反应的能量变化
B.探究质量守恒定律
C.探究燃烧的条件
D.除去CO中少量的CO2
A、A B、B C、C D、D13. 将甲、乙、丙、丁四种物质放入密闭容器中充分反应,测得各物质在反应前后的质量关系如图所示。下列说法错误的是 A、x的值为20 B、该反应属于化合反应 C、丙可能是该反应的催化剂 D、甲、乙的相对分子质量比为7:814. 碳及其化合物是我们身边重要的物质,下列说法正确的是A、C60是一种新型的化合物 B、烧煤取暖时,在炉上放一盆水可防止煤气中毒 C、在特定的条件下,石墨转化为金刚石,属于化学变化 D、含碳燃料燃烧时会产生二氧化碳,这是形成酸雨的主要原因15. 有CO、CO2和N2的混合气体180g,其中碳元素的质量分数为20%,使该混合气体与足量的灼热氧化铜完全反应后,再将气体通入足量的澄清石灰水中,充分反应后得到白色沉淀的质量为A、150g B、200g C、250g D、300g16. 下列图像能正确反映对应变化关系的是
A、x的值为20 B、该反应属于化合反应 C、丙可能是该反应的催化剂 D、甲、乙的相对分子质量比为7:814. 碳及其化合物是我们身边重要的物质,下列说法正确的是A、C60是一种新型的化合物 B、烧煤取暖时,在炉上放一盆水可防止煤气中毒 C、在特定的条件下,石墨转化为金刚石,属于化学变化 D、含碳燃料燃烧时会产生二氧化碳,这是形成酸雨的主要原因15. 有CO、CO2和N2的混合气体180g,其中碳元素的质量分数为20%,使该混合气体与足量的灼热氧化铜完全反应后,再将气体通入足量的澄清石灰水中,充分反应后得到白色沉淀的质量为A、150g B、200g C、250g D、300g16. 下列图像能正确反映对应变化关系的是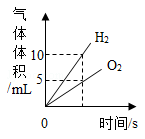
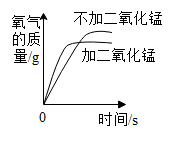
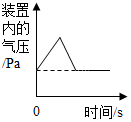
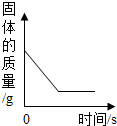
A.水通电,电解生成两种气体的体积变化
B.加热两份等质量的氯酸钾固体制取氧气
C.足量镁条在密闭容器中燃烧
D.将铁钉加入足量的硫酸铜溶液中
A、A B、B C、C D、D二、填空题
-
17. 我国利用“天问一号”火星探测器对火星的大气和土壤进行科考研究,发现其中含有多种中学常见的化学物质,如氮气、金属氧化物和各种盐类,用化学用语回答下列问题。(1)、3个氮气分子。(2)、镁离子的结构示意图为。(3)、火星土壤中含MgSiO3、CaSiO3等硅酸盐,这些硅酸盐的阴离子符号为。(4)、地球是我们的家园,地壳中含量最高的金属元素和非金属元素组成的化合物的化学式为。
三、综合题
-
18. 水是生命之源,我们应该爱护水资源。某同学收集到一瓶浑浊的河水,要模拟自来水厂的净水过程,最终制成自来水。其实验过程如下所示:
 (1)、操作①的名称是。(2)、操作②主要是利用(填物质名称)吸附掉一些溶解的杂质,除去臭味。(3)、操作③中一般会加入氯气、臭氧或二氧化氯(ClO2)等物质,它们的作用是。(4)、爱护水资源,是每个公民应尽的责任和义务。下列做法有利于保护水资源的是____(填字母)。A、大量使用化肥农药 B、工业废水处理达标后排放 C、使用含磷洗衣粉 D、生活污水直接排放19. 化学与能源、环保等方面密切相关,请回答下列问题。(1)、目前我国的能源结构仍以化石燃料为主,化石燃料包含煤、和天然气,它们属于(填“可再先”或“不可再生”)能源。(2)、燃煤工厂会在煤中加入石灰石除去燃烧时生成的SO2 , 其中涉及的一步反应如下: , 则X的化学式为。(3)、甲烷可制成合成气,反应的微观示意图如下,则生成物中丙和丁的质量比为(最简整数比)。
(1)、操作①的名称是。(2)、操作②主要是利用(填物质名称)吸附掉一些溶解的杂质,除去臭味。(3)、操作③中一般会加入氯气、臭氧或二氧化氯(ClO2)等物质,它们的作用是。(4)、爱护水资源,是每个公民应尽的责任和义务。下列做法有利于保护水资源的是____(填字母)。A、大量使用化肥农药 B、工业废水处理达标后排放 C、使用含磷洗衣粉 D、生活污水直接排放19. 化学与能源、环保等方面密切相关,请回答下列问题。(1)、目前我国的能源结构仍以化石燃料为主,化石燃料包含煤、和天然气,它们属于(填“可再先”或“不可再生”)能源。(2)、燃煤工厂会在煤中加入石灰石除去燃烧时生成的SO2 , 其中涉及的一步反应如下: , 则X的化学式为。(3)、甲烷可制成合成气,反应的微观示意图如下,则生成物中丙和丁的质量比为(最简整数比)。 20. 利用空气制取氮肥的流程如图所示:
20. 利用空气制取氮肥的流程如图所示: (1)、I中是利用氧气和氮气的沸点不同分离液态空气,发生的是(填“物理变化”或“化学变化”)。(2)、单质X是一种常见气体,其化学式是。(3)、反应II为工业上合成氨的反应,在不同条件下得到的氨的含量如图所示,由此可知,合成氨的最佳条件是| (填序号)。
(1)、I中是利用氧气和氮气的沸点不同分离液态空气,发生的是(填“物理变化”或“化学变化”)。(2)、单质X是一种常见气体,其化学式是。(3)、反应II为工业上合成氨的反应,在不同条件下得到的氨的含量如图所示,由此可知,合成氨的最佳条件是| (填序号)。 A、300℃、200大气压 B、500℃、200大气压 C、300℃、400大气压 D、500℃、400大气压(4)、产品硝酸铵(NH4NO3)可用于汽车安全气囊,在受到猛烈撞击后气囊中硝酸铵会发生分解,生成大量的一氧化二氮(N2O)气体和另一种氧化物,该分解反应的化学方程式是。21. 金属及金属材料在生产生活中有着广泛的运用,请回答:(1)、用铜制作导线主要是利用铜具有良好的性。(2)、人们大量使用的合金有更多优良性能,如钢比纯铁硬度(填“大”或“小”)。(3)、金属资源很多都可以回收利用,如从废旧手机的某些部件中可以回收银和铜,其操作流程如图所示。
A、300℃、200大气压 B、500℃、200大气压 C、300℃、400大气压 D、500℃、400大气压(4)、产品硝酸铵(NH4NO3)可用于汽车安全气囊,在受到猛烈撞击后气囊中硝酸铵会发生分解,生成大量的一氧化二氮(N2O)气体和另一种氧化物,该分解反应的化学方程式是。21. 金属及金属材料在生产生活中有着广泛的运用,请回答:(1)、用铜制作导线主要是利用铜具有良好的性。(2)、人们大量使用的合金有更多优良性能,如钢比纯铁硬度(填“大”或“小”)。(3)、金属资源很多都可以回收利用,如从废旧手机的某些部件中可以回收银和铜,其操作流程如图所示。
①步骤I发生反应的化学方程式为(写一个即可),步骤II加入硝酸银的目的是。
②金属X可从硝酸铜溶液中得到铜,该金属可以是(填化学式,一种即可)。
22. 现有下列实验装置示意图,结合实验装置图回答有关问题。 (1)、写出仪器名称:①。(2)、若以高锰酸钾为原料,选用乙装置制取O2 , 反应的化学方程式为;若用丙装置收集O2 , 气体应从进入(填“m或n”)。(3)、如实验室只有稀硫酸、大理石、Na2CO3粉末,利用甲装置制取CO2的化学方程式为 , 测定生成的CO2体积可选用丁装置,若测定出来的气体体积明显大于理论值,可能的原因是(填序号)。
(1)、写出仪器名称:①。(2)、若以高锰酸钾为原料,选用乙装置制取O2 , 反应的化学方程式为;若用丙装置收集O2 , 气体应从进入(填“m或n”)。(3)、如实验室只有稀硫酸、大理石、Na2CO3粉末,利用甲装置制取CO2的化学方程式为 , 测定生成的CO2体积可选用丁装置,若测定出来的气体体积明显大于理论值,可能的原因是(填序号)。A.反应一开始产生气体就通入丁中 B.等气体平稳产生时才通入丁中
C.装置气密性不好 D.收集气体前丁装置中植物油上方原本有空气
23. 为探究影响双氧水分解的因素,某课外活动小组的同学完成了下列实验:以下是相关实验数据。实验序号
H2O2溶液浓度%
H2O2溶液体积/mL
温度/℃
MnO2的质量/g
收集氧气的体积/mL
反应所需的时间/s
①
5
25
20
0.3
10
34.42
②
15
25
20
0.3
10
21.52
③
15
25
35
0.3
10
17.72
(1)、为准确测定收集10mL氧气所需的时间,实验时宜采用方法来收集氧气。(2)、通过对比实验①和②,可以知道,双氧水浓度越(填“大”或“小”),分解速率越快。(3)、从实验(填实验序号)的对比可知,化学反应速率还与温度有关。通过对比得到的结论,用一定量15%的过氧化氢溶液制氧气通过的方法可以减小反应速率。(4)、继续探究催化剂的种类对双氧水分解速率的影响,实验数据如下表:*表中的待测数据指测量收集相同体积的氧气所需的时间。
编号
H2O2溶液质量(g)
催化剂
催化剂质量(g)
待测数据(s)
实验1
100.0
MnO2
0.2
t1
实验2
100.0
CuO
X
t2
Ⅰ.表中X的数值应是。
Ⅱ.若t1t2(选填“>”、“<”或“=”),则MnO2的催化效果优于CuO。
四、计算题
-
24. 化学兴趣小组对某种黄铜(铜锌合金)样品中铜的含量进行了测定。如图所示,称取20g该黄铜样品置于烧杯(烧杯质量为58.8g)中,加入100g足量稀硫酸,待完全反应后,称得烧杯及烧杯中剩余物质的总重量为178.4g。
 (1)、反应过程中产生氢气的质量为g。(2)、计算该黄铜样品中铜的质量分数。(写出计算过程及结果)
(1)、反应过程中产生氢气的质量为g。(2)、计算该黄铜样品中铜的质量分数。(写出计算过程及结果)
-