浙教版八下科学 第二章 微粒的模型与符号 单元检测
试卷更新日期:2023-03-08 类型:单元试卷
一、单选题
-
1. 模型法是学习科学的重要方法。下列不属于模型的是( )A、
 光线
B、
光线
B、 磁感线
C、
磁感线
C、 水分子
D、
水分子
D、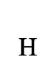 氢元素
2. 提起压在容器中水面上方的活塞,容器中的水汽化,如图所示。下列选项中,最能表示水汽化后相同空间内粒子分布的是( )
氢元素
2. 提起压在容器中水面上方的活塞,容器中的水汽化,如图所示。下列选项中,最能表示水汽化后相同空间内粒子分布的是( ) A、
A、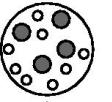 B、
B、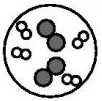 C、
C、 D、
D、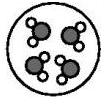 3. 推理是研究和学习科学的一种重要方法。正电子、负质子都是反粒子,它们跟通常所说的电子、质子相比较,质量相等,电性相反。科学家已发现反氢原子。你推测反氢原子的结构可能是( )A、由1个带负电荷的质子和1个带正电荷的电子构成 B、由1个质子和1个电子构成 C、由1个带负电荷的质子和1个电子构成 D、由1个质子和1个带正电荷的电子构成4. 如图为地壳中元素含量分布图,其中能代表氧元素的是( )
3. 推理是研究和学习科学的一种重要方法。正电子、负质子都是反粒子,它们跟通常所说的电子、质子相比较,质量相等,电性相反。科学家已发现反氢原子。你推测反氢原子的结构可能是( )A、由1个带负电荷的质子和1个带正电荷的电子构成 B、由1个质子和1个电子构成 C、由1个带负电荷的质子和1个电子构成 D、由1个质子和1个带正电荷的电子构成4. 如图为地壳中元素含量分布图,其中能代表氧元素的是( ) A、① B、② C、③ D、④5. 单质和化合物的区别在于( )A、是否由同种分子构成 B、是否由同种物质组成 C、是否由同种元素组成 D、是否由同种离子构成6. 下图摘自元素周期表,据此判断下列叙述错误的是( )
A、① B、② C、③ D、④5. 单质和化合物的区别在于( )A、是否由同种分子构成 B、是否由同种物质组成 C、是否由同种元素组成 D、是否由同种离子构成6. 下图摘自元素周期表,据此判断下列叙述错误的是( ) A、氧的相对原子质量为16.00 B、硫原子的核外电子数为16 C、氧和硫都属于非金属元素 D、氧和硫在元素周期表中位于同一周期7. 下列符号既能表示1种元素,又能表示这种元素的1个原子,还能表示1种单质的是 ( )A、S B、C60 C、H D、Fe2O38. 科学家最近制得了一种新型的氧分子O4 , 下列叙述正确的是( )A、O2、O4都是由氧元素组成的单质 B、O4由4个氧元素组成 C、1个该新型分子(O4)由2个氧气分子构成 D、O4是由O2组成的混合物9. 明矾石广泛用于造纸、制革、化工等工业,其化学式为KAl3(SO4)2(OH)x。其中x的值是 ( )A、5 B、6 C、7 D、810. 下列物质中指定元素按化合价由高至低的顺序排列的是( )A、锰元素:MnO2 K2MnO4 KMnO4 B、氧元素:O2 H2O H2O2 C、碳元素:CO2 CO C D、氯元素:KClO3 KCl Cl211. 某阳离子Mn+的核外电子共有x个电子,核内有y个中子,则M的相对原子质量约为 ( )A、x+y B、x+n-y C、x-n+y D、x+y+n12. 葡萄糖溶液是将葡萄糖(化学式为C6H12O6)溶于水形成的。某温度下一定质量的葡萄糖溶液中氢元素的质量分数为10%,则该溶液中碳元素的质量分数为( )A、5% B、10% C、25% D、60%13. 已知某元素的原子与碳-12原子的质量比为9∶1,则该元素的相对原子质量为( )A、108 B、1.33 C、108 g D、1.33 g14. 下列元素分类正确的是( )A、金属元素:金、银、铜、汞 B、非金属元素:碳、氮、磷、钾 C、固态非金属元素:碳、氧、硫、磷 D、稀有元素:氦、氢、氖、氯15. 1911年卢瑟福团队用一束α粒子(带正电荷)轰击金箔时发生了如图所示的实验现象。由实验得出的结论不合理的是( )
A、氧的相对原子质量为16.00 B、硫原子的核外电子数为16 C、氧和硫都属于非金属元素 D、氧和硫在元素周期表中位于同一周期7. 下列符号既能表示1种元素,又能表示这种元素的1个原子,还能表示1种单质的是 ( )A、S B、C60 C、H D、Fe2O38. 科学家最近制得了一种新型的氧分子O4 , 下列叙述正确的是( )A、O2、O4都是由氧元素组成的单质 B、O4由4个氧元素组成 C、1个该新型分子(O4)由2个氧气分子构成 D、O4是由O2组成的混合物9. 明矾石广泛用于造纸、制革、化工等工业,其化学式为KAl3(SO4)2(OH)x。其中x的值是 ( )A、5 B、6 C、7 D、810. 下列物质中指定元素按化合价由高至低的顺序排列的是( )A、锰元素:MnO2 K2MnO4 KMnO4 B、氧元素:O2 H2O H2O2 C、碳元素:CO2 CO C D、氯元素:KClO3 KCl Cl211. 某阳离子Mn+的核外电子共有x个电子,核内有y个中子,则M的相对原子质量约为 ( )A、x+y B、x+n-y C、x-n+y D、x+y+n12. 葡萄糖溶液是将葡萄糖(化学式为C6H12O6)溶于水形成的。某温度下一定质量的葡萄糖溶液中氢元素的质量分数为10%,则该溶液中碳元素的质量分数为( )A、5% B、10% C、25% D、60%13. 已知某元素的原子与碳-12原子的质量比为9∶1,则该元素的相对原子质量为( )A、108 B、1.33 C、108 g D、1.33 g14. 下列元素分类正确的是( )A、金属元素:金、银、铜、汞 B、非金属元素:碳、氮、磷、钾 C、固态非金属元素:碳、氧、硫、磷 D、稀有元素:氦、氢、氖、氯15. 1911年卢瑟福团队用一束α粒子(带正电荷)轰击金箔时发生了如图所示的实验现象。由实验得出的结论不合理的是( ) A、 多数α粒子直接穿过,说明原子核外是空的,不存在其他粒子 B、少数α粒子发生偏移,说明原子核带正电 C、极少数α粒子被反弹,说明原子核体积很小、质量相对较大 D、α粒子的质量比核外电子的质量大得多
A、 多数α粒子直接穿过,说明原子核外是空的,不存在其他粒子 B、少数α粒子发生偏移,说明原子核带正电 C、极少数α粒子被反弹,说明原子核体积很小、质量相对较大 D、α粒子的质量比核外电子的质量大得多二、填空题
-
16. 常见分子模型的形象表示方法有两种:球棍模型、比例模型。(1)、请你写出图中乙烷对应的模型分别属于哪种表示方法。
 (2)、能清楚地反映乙烷分子中碳、氢原子的大小和相对位置的是 。A、球棍模型 B、比例模型17. 下图表示的是液态水和气态水的状态模型,“
(2)、能清楚地反映乙烷分子中碳、氢原子的大小和相对位置的是 。A、球棍模型 B、比例模型17. 下图表示的是液态水和气态水的状态模型,“ ”表示水分子。
”表示水分子。  (1)、图中表示气态水的是。(2)、温度降低时液态的水会变成态的冰,而温度升高时会变成态的水蒸气。(3)、从图中我们可以看出,水在状态变化时,水分子之间的发生了变化。18. 根据图,回答下列问题。
(1)、图中表示气态水的是。(2)、温度降低时液态的水会变成态的冰,而温度升高时会变成态的水蒸气。(3)、从图中我们可以看出,水在状态变化时,水分子之间的发生了变化。18. 根据图,回答下列问题。 (1)、过氧化氢分子中有种原子,甲醛分子中有种原子;1个甲烷分子中有个原子,1个甲醛分子中有个原子,1个水分子中有个原子。(2)、比较氢分子与水分子,可得出的结论为。(3)、比较过氧化氢分子和水分子、乙炔分子和甲烷分子,可得出的结论为。19. 人类对原子结构的认识永无止境。请根据所学知识回答下列问题。(1)、道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,如今这些观点均(填“正确”或“错误”)。(2)、卢瑟福进行α粒子散射实验后,认为原子符合“行星模型”,即原子由原子核和核外电子构成。如图2-Z-11甲是卢瑟福用α粒子轰击金箔产生散射的实验,在分析实验结果的基础上,他提出了图乙所示的原子核式结构,卢瑟福的这一研究过程是个 。
(1)、过氧化氢分子中有种原子,甲醛分子中有种原子;1个甲烷分子中有个原子,1个甲醛分子中有个原子,1个水分子中有个原子。(2)、比较氢分子与水分子,可得出的结论为。(3)、比较过氧化氢分子和水分子、乙炔分子和甲烷分子,可得出的结论为。19. 人类对原子结构的认识永无止境。请根据所学知识回答下列问题。(1)、道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,如今这些观点均(填“正确”或“错误”)。(2)、卢瑟福进行α粒子散射实验后,认为原子符合“行星模型”,即原子由原子核和核外电子构成。如图2-Z-11甲是卢瑟福用α粒子轰击金箔产生散射的实验,在分析实验结果的基础上,他提出了图乙所示的原子核式结构,卢瑟福的这一研究过程是个 。 A、建立模型的过程 B、得出结论的过程 C、提出问题的过程 D、验证证据的过程20. 如图所示是四位同学替4种元素进行的自我介绍,请你根据所学知识回答下列问题。
A、建立模型的过程 B、得出结论的过程 C、提出问题的过程 D、验证证据的过程20. 如图所示是四位同学替4种元素进行的自我介绍,请你根据所学知识回答下列问题。 (1)、写出上述4种元素的元素符号。
(1)、写出上述4种元素的元素符号。甲: , 乙: , 丙: , 丁:。
(2)、上述4种元素的根本区别是(填“质子数”或“中子数”)不同。21. 元素周期表是学习和研究科学的重要工具,试根据图回答相应问题。 (1)、图甲是铯元素在元素周期表中的信息,则铯元素属于(填“金属”或“非金属”)元素,该元素原子的核外电子数为。(2)、图乙为元素周期表的一部分,X、Y、Z代表三种不同元素,以下判断正确的是 (填字母)。A、原子序数:Z>Y B、核外电子数:X=Y22. 用化学符号或符号的意义填空。(1)、5N。(2)、n个二氧化碳分子。(3)、4个氯离子。(4)、氧化铜中氧元素的化合价为-2。(5)、2Na+。(6)、 。23.(1)、举重、体操运动员比赛都要用“白粉”,其主要成分为碳酸镁(MgCO3),其中镁离子的符号是。(2)、运动员用于补充能量的葡萄糖(C6H12O6)中碳、氢元素的质量比是。24. 啤酒、红酒和白酒中都含有一定量的乙醇(C2H5OH),饮酒后乙醇可进入人体血液中。科学实验表明,当乙醇在人体血液中的含量超过80 mg/100 mL血(每100 mL血中含有80 mg乙醇)时,便会影响人驾车或操作机器的能力。已知饮用某啤酒1大杯(0.56 L),会使血液中乙醇含量升高30 mg/100 mL血,回答下列问题。(1)、乙醇中含有种元素。(2)、乙醇分子中碳、氢、氧三种原子的个数比是.(3)、李明饮用了3大杯上述啤酒后,其体内每100 mL血液中乙醇的含量理论上升高mg,(填“影响”或“不影响”)其驾车或操作机器的能力。25. 元素在自然界中的分布情况:按质量分数计算在地壳中含量最多的元素是(填元素符号,下同);含量最多的金属元素是。
(1)、图甲是铯元素在元素周期表中的信息,则铯元素属于(填“金属”或“非金属”)元素,该元素原子的核外电子数为。(2)、图乙为元素周期表的一部分,X、Y、Z代表三种不同元素,以下判断正确的是 (填字母)。A、原子序数:Z>Y B、核外电子数:X=Y22. 用化学符号或符号的意义填空。(1)、5N。(2)、n个二氧化碳分子。(3)、4个氯离子。(4)、氧化铜中氧元素的化合价为-2。(5)、2Na+。(6)、 。23.(1)、举重、体操运动员比赛都要用“白粉”,其主要成分为碳酸镁(MgCO3),其中镁离子的符号是。(2)、运动员用于补充能量的葡萄糖(C6H12O6)中碳、氢元素的质量比是。24. 啤酒、红酒和白酒中都含有一定量的乙醇(C2H5OH),饮酒后乙醇可进入人体血液中。科学实验表明,当乙醇在人体血液中的含量超过80 mg/100 mL血(每100 mL血中含有80 mg乙醇)时,便会影响人驾车或操作机器的能力。已知饮用某啤酒1大杯(0.56 L),会使血液中乙醇含量升高30 mg/100 mL血,回答下列问题。(1)、乙醇中含有种元素。(2)、乙醇分子中碳、氢、氧三种原子的个数比是.(3)、李明饮用了3大杯上述啤酒后,其体内每100 mL血液中乙醇的含量理论上升高mg,(填“影响”或“不影响”)其驾车或操作机器的能力。25. 元素在自然界中的分布情况:按质量分数计算在地壳中含量最多的元素是(填元素符号,下同);含量最多的金属元素是。三、实验探究题
-
26. 碘是一种由碘分子构成的物质。小明同学利用碘进行如下实验:①把少量的固体碘放在湿润的馒头上,发现馒头会变成蓝色;②再取少量的碘溶解在酒精中,取少量碘酒滴在馒头上,发现馒头也会变蓝色。请回答以下问题。(1)、如果取少量的碘放入烧杯中,用酒精灯加热,碘升华成碘蒸气,把湿润的馒头放在碘蒸气中,馒头会有什么变化,请预测实验现象为 , 并阐述理由。(2)、现在市场上买来的食盐大多是加碘盐,将少量食盐水滴在馒头上,馒头不变蓝。那么加碘盐中(填“有”或“没有”)碘分子。27. 人类对原子结构的认识,经历了汤姆生、卢瑟福和玻尔等提出的模型的过程。
 (1)、卢瑟福核式结构模型是在α粒子轰击金箔实验的基础上提出的。把一束高速运动的α粒子(带 2 个单位正电荷), 射向一片极薄的金箔。他惊奇的发现,过去一直认为原子是“实心球”,而由这种“实心球”紧密排列成的金箔, 竟为大多数α粒子畅通无阻得通过,就像金箔不在那儿似的,但也有极少数的α粒子发生偏转,或笔直的弹回。
(1)、卢瑟福核式结构模型是在α粒子轰击金箔实验的基础上提出的。把一束高速运动的α粒子(带 2 个单位正电荷), 射向一片极薄的金箔。他惊奇的发现,过去一直认为原子是“实心球”,而由这种“实心球”紧密排列成的金箔, 竟为大多数α粒子畅通无阻得通过,就像金箔不在那儿似的,但也有极少数的α粒子发生偏转,或笔直的弹回。根据上述实验现象能得出关于金箔中金原子结构的一些结论,试写出其中的一点:;
(2)、从原子结构模型建立的过程中,我们发现 (填序号)。A、科学模型的建立是一个不断完善、不断修正的过程 B、模型在科学研究中起着很重要的作用 C、玻尔的原子模型的建立,使人们对原子结构的认识达到了完美的境界 D、人类借助模型的建立,对原子的认识逐渐接近本质28. 核事故中往往泄漏出污染物131I(具有放射性的碘原子)。为避免核辐射,需一次性口服100 mg 127I(不具放射性的碘原子),使人体甲状腺中的碘达到饱和而不再吸收外界的碘,从而起到保护作用。请回答下列问题:
(1)、131I是一种质子数为53、中子数为78的碘原子。该原子核外电子数为。(2)、131I与127I的关系是 (填字母)。A、同种元素 B、同种物质 C、同种分子 D、同种原子(3)、假设所处的环境已受污染,通过服用加碘食盐(注:加碘食盐中的碘为碘元素)的方法能否有效起到避免核辐射的目的呢?[查阅资料]成人每天食用食盐的质量通常为6 g,
某种加碘食盐的标签如图所示。

[问题分析]500 g该品牌食盐中,含碘的最大质量是;若要使人体甲状腺中的碘达到饱和,至少需要一次性食用该品牌碘盐。
[结论]日常服用加碘食盐(填“能”或“不能”)起到避免核辐射的目的,原因是。
(4)、专家指出,服用碘片(有效成分为KI)可以治疗”131I造成的辐射,但服用碘酒(有效成分为I2)却会引起碘中毒。KI和I2性质不同的原因是。29. 探究原子结构的奥秘:【情景提供】19世纪以前,人们一直以为原子是不可分的,直到1887年,汤姆生发现了带负电的电子后,才引起人们对原子结构模型的探索。
【提出问题】电子带负电,原子不带电,说明原子内存在带正电荷的部分,它们是均匀分布还是集中分布的呢?
【进行实验】1910年英国科学家卢瑟福进行了著名的粒子轰击金箔实验。实验做法如图所示:
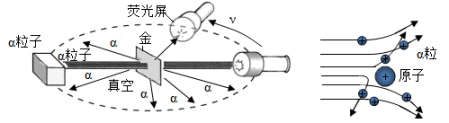
①放射源——放射性物质放出粒子(带正电荷),质量是电子质量的7000倍;
②金箔——作为靶子,厚度1μm,重叠了3000层左右的原子;
③荧光屏——粒子打在上面发出闪光;
④显微镜——通过显微镜观察闪光,且通过360度转动可观察不同角度粒子的到达情况。
【收集证据】绝大多数粒子穿过金箔后仍沿原来的方向前进,但是有少数粒子却发生了较大的偏转,并且有极少数粒子的偏转超过90°,有的甚至几乎达到180°,像是被弹了回来。
【猜想与假设】粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生之明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
【解释与结论】
若原子质量、正电荷在原子内均匀分布,则极少数粒子就(填“会”或“不会”)发生大角度散射。卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是。
30. 常用塑化剂的学名“邻苯二甲酸二辛酯”,化学式为C24H38O4 , 它是一种无色透明的液体,有特殊气味,不溶于水,溶于大多数有机溶剂,有毒。常用作各种塑料制品的工业添加剂,不可食用。可是不法商人为了牟取暴利竟然其将添加到多种饮料、果冻、果酱和方便面等食品中。若长期食用含塑化剂的食品可能对生殖系统、免疫系统造成危害,大量摄入还可能致癌。请分析上述信息,回答下列问题:
(1)、根据常用塑化剂的化学式计算:①相对分子质量;
②氧元素的质量分数为(计算结果精确到0.1%)。
(2)、下列做法,可以使我们远离塑化剂的是。①少喝各种饮料,日常饮水以白开水为主
②经常吃方便面、面包等速食食品以适应我们快节奏的生活
③尽量少用塑料制品直接接触热的、含油脂的食物
④呼吁政府完善食品安全监督检验机制,严惩不法黑心业者
(3)、写出该塑化剂的两条物理性质:、。四、解答题
-
31. 大型电动车使用的磷酸亚铁锂(LiFePO4)电池,具有体积小、成本低、充电快、输出功率高、循环寿命长等优点。请计算:(1)、磷酸亚铁锂中磷元素与氧元素的原子个数比为。(2)、磷酸亚铁锂中锂、磷元素的质量比为。(3)、磷酸亚铁锂中铁元素的质量分数(精确到0.1%)。32. 1989年世界卫生组织把铝列为食品污染源之一,每人每日对铝的摄入量应控制在0.004 g以下。
[提示:明矾的化学式为KAl(SO4)2·12H2O](1)、人从食物中摄入的铝指的是 (填字母)。A、铝元素 B、铝单质 C、铝合金 D、只有明矾(2)、明矾中各元素的质量比为m(K)∶m(Al)∶m(S)∶m(O)∶m(H)=;铝元素的质量分数为(计算结果精确到0.1%)。(3)、如果某人一天吃了100 g某食品(1 kg该食品中加入明矾2 g),通过计算说明其摄入的铝的量是否超过安全摄入量?33. 儿童缺锌会引起食欲不振、发育不良等症状。如图为某补锌口服液说明书的部分信息,回答下列问题。×××牌补锌口服液
主要成分:葡萄糖酸锌
化学成分:C12H22O14Zn
含锌:5.0 mg/支
质量:10.0 g/支
(1)、葡萄糖酸锌由种元素组成。(2)、葡萄糖酸锌的相对分子质量为。(3)、要满足儿童身体正常发育的需要,在某一时间段需要适量补锌。若儿童1 kg体重每日需要0.5 mg的锌,每天从食物中只能摄入所需锌的一半,则体重为20 kg的儿童,理论上一天还需服用该口服液多少支?34. 由碳、氢元素组成的物质种类繁多,烷烃就是其中一类重要的物质,下表中列出了烷烃的一些信息。名称
甲烷
乙烷
丙烷
丁烷
戊烷
十一烷
十六烷
化学式
CH4
C2H6
C3H8
?
C5H12
C11H24
C16H34
沸点/℃
-164
-88.6
-42.1
-0.5
36.1
194.5
287.5
相对密度
0.466
0.572
0.585
0.579
0.626
0.741
0.774
分析上表中的信息,回答下列问题。
(1)、写出表中丁烷的化学式:。(2)、烷烃的命名与分子中原子个数有关。(3)、总结一条有关烷烃物理性质的变化规律:。五、综合说理题
-
35. 食盐(化学式为NaCl)对人类的生存至关重要,也是烹饪中常用的调味料,但氯气(化学式为Cl2)具有毒性,侵入人体对呼吸道黏膜造成伤害,可见,NaCl和Cl2两种物质化学性质存在明显差异。从微观角度对上述结论作简要的解释。