河北省九师联盟2022-2023学年高三下学期2月开学考试化学试题
试卷更新日期:2023-03-06 类型:开学考试
一、选择题:本大题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 化学与生活、生产密切相关。下列说法错误的是( )A、石墨烯液冷散热技术是华为公司首创,其中石墨烯是有机高分子材料 B、北斗卫星导航系统所用计算机芯片的主要材料是单晶硅 C、我国成功研制出的新冠疫苗需要采用冷链运输,以防止蛋白质变性 D、我国研发的特高强度铝合金——7Y69,属于金 属材料2. 下列有关化学用语表示错误的是( )A、乙醇的结构简式:CH3CH2OH B、H2O的电子式:
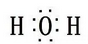 C、基态Cu原子的价电子排布式:[Ar]3d104s-1
D、质子数为88,中子数为138的镭(Ra)原子:
3. 异甘草素具有抗肿瘤、抗病毒等药物功效。合成中间体Z的部分路线如下(已知手性碳原子是连有四个不同基团的碳原子):
C、基态Cu原子的价电子排布式:[Ar]3d104s-1
D、质子数为88,中子数为138的镭(Ra)原子:
3. 异甘草素具有抗肿瘤、抗病毒等药物功效。合成中间体Z的部分路线如下(已知手性碳原子是连有四个不同基团的碳原子):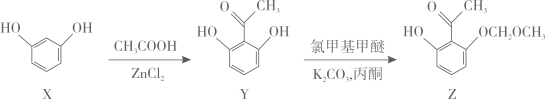
下列有关化合物X、Y和Z的说法正确的是( )
A、X分子中的所有原子一定共平面 B、Y能发生加成、氧化和消去反应 C、Z与足量的氢气加成后的产物分子中含有4个手性碳原子 D、相同物质的量的X与Y分别与足量溴水反应消耗的Br2的物质的量相等4. X、Y、Z、W是原子半径依次增大的短周期主族元素,其中X元素与其他元素不在同一周期,Y的一种核素常用于测定文物年代,基态Z原子中S能级与p能级上的电子总数相等。下列说法错误的是( )A、W单质可以与水反应生成气体 B、Z、W所在周期内,Z、W元素第一电离能大小相邻 C、X与Y组成的化合物沸点可能比水的高 D、X、Y、Z、W的单质均可以在空气中燃烧5. 实验室用下列装置模拟侯氏制碱法。下列说法错误的是( )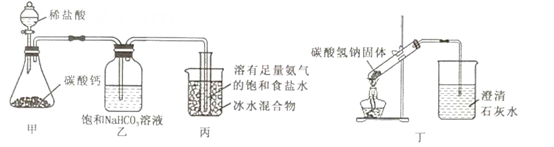 A、装置甲制取CO2 B、装置乙中饱和NaHCO3溶液可除去CO2中的少量HCl C、装置丙中冰水浴有利于析出NaHCO3固体 D、装置丁加热NaHCO3制取纯碱6. 铜及其化合物的转化具有广泛应用。下列说法正确的是( )A、铜粉和硫粉混合加热可得CuS B、Cu2O晶胞(如图所示)中Cu+的配位数为4
A、装置甲制取CO2 B、装置乙中饱和NaHCO3溶液可除去CO2中的少量HCl C、装置丙中冰水浴有利于析出NaHCO3固体 D、装置丁加热NaHCO3制取纯碱6. 铜及其化合物的转化具有广泛应用。下列说法正确的是( )A、铜粉和硫粉混合加热可得CuS B、Cu2O晶胞(如图所示)中Cu+的配位数为4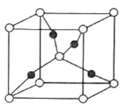 C、离子半径:Cu2+>Cl->S2-
D、新制的Cu(OH)2悬浊液可用于尿液中葡萄糖的检验
7. 由下列实验及现象不能推出相应结论的是( )
C、离子半径:Cu2+>Cl->S2-
D、新制的Cu(OH)2悬浊液可用于尿液中葡萄糖的检验
7. 由下列实验及现象不能推出相应结论的是( )实验
现象
结论
A
向2 mL0.1 mol·L-1KI溶液中滴加5滴0.1 mol·L-1的FeCl3溶液,振荡,再滴加1~2滴KSCN溶液
溶液呈血红色
FeCl3与KI的反应是可逆反应
B
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
CO2具有氧化性
C
加热乙醇与浓硫酸的混合溶液,将产生的气体通入少量酸性KMnO4溶液
溶液紫红色褪去
有乙烯生成
D
向5 mL0.1 mol·L-1ZnSO4溶液中加入1 mL0.1 mol·L-1 Na2S溶液,再滴加几滴CuSO4溶液
先有白色沉淀生成,后转化为黑色沉淀
Ksp(CuS)<Ksp(ZnS)
A、A B、B C、C D、D8. 我国科研人员通过控制光沉积的方法构建Cu2O-Pt/SiC/IrOx型复合材料光催化剂,其中Fe2+和Fe3+渗透Nafion膜可协同CO2、H2O分别反应,构建了一个人工光合作用体系,其反应机理(hv为光照条件)如图。下列说法正确的是( )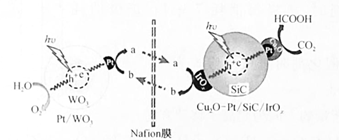 A、图中a、b分别代表Fe3+、Fe2+ B、反应过程中光能全部转化为化学能 C、总反应方程式为2CO2+2H2O 2HCOOH+O2 D、反应过程中涉及到非极性键、极性键的断裂和形成9. 一种富集烟气(水蒸气、SO2、CO2等)中CO2的原理示意图如下。下列说法错误的是( )
A、图中a、b分别代表Fe3+、Fe2+ B、反应过程中光能全部转化为化学能 C、总反应方程式为2CO2+2H2O 2HCOOH+O2 D、反应过程中涉及到非极性键、极性键的断裂和形成9. 一种富集烟气(水蒸气、SO2、CO2等)中CO2的原理示意图如下。下列说法错误的是( )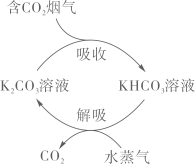 A、CO2分子的空间构型为直线形 B、中碳原子的杂化方式为sp2 C、SO2的键角小于SO3的键角 D、SO2易溶于水是因为SO2分子能与H2O分子形成分子间氢键10. 环己烷有多种不同构象,其中椅式、半椅式、船式、扭船式较为典型。各构象的相对能量图(位能)如图所示。下列说法正确的是( )
A、CO2分子的空间构型为直线形 B、中碳原子的杂化方式为sp2 C、SO2的键角小于SO3的键角 D、SO2易溶于水是因为SO2分子能与H2O分子形成分子间氢键10. 环己烷有多种不同构象,其中椅式、半椅式、船式、扭船式较为典型。各构象的相对能量图(位能)如图所示。下列说法正确的是( )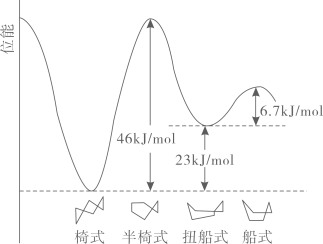 A、相同条件下扭船式环己烷最稳定 B、C6H12 (椅式)的燃烧热大于C6H12(船式) C、C6H12(半椅式)=C6H12(船式) △H=+39.3kJ·mol-1 D、环己烷的扭船式结构一定条件下可自发转化成椅式结构11. 铁、铜及其化合物之间的转化具有重要应用。下列说法正确的是( )A、FeO粉末在空气中受热,迅速被氧化成Fe2O3 B、将废铜屑加入FeCl3溶液中,可以制取铁粉 C、铜盐能杀死细菌,并能抑制藻类生长,因此游泳馆常用硫酸铜作游泳池中水的消毒剂 D、向Fe(NO3)2溶液中滴加稀硫酸酸化,再滴加KSCN溶液,溶液变成血红色,说明Fe(NO3)2溶液已变质12. NO在催化剂条件下可被H2还原为无害物质,反应为2H2(g)+2NO(g)N2(g)+2H2O(g) △H<0。下列说法正确的是( )A、上述反应△S>0 B、上述反应的平衡常数表达式K= C、上述反应中生成1 mol N2 , 转移电子的数目为2×6.02×1023 D、上述反应中,充入水蒸气增大压强可以提高NO的平衡转化率13. 新型Li- CO2电池用碳化钥(Mo2C)作Li极催化剂时正极产物为LiC2O,装置如图所示。若用Au一多孔碳作Li极催化剂,则正极产物为Li2CO3和C。下列说法正确的是( )
A、相同条件下扭船式环己烷最稳定 B、C6H12 (椅式)的燃烧热大于C6H12(船式) C、C6H12(半椅式)=C6H12(船式) △H=+39.3kJ·mol-1 D、环己烷的扭船式结构一定条件下可自发转化成椅式结构11. 铁、铜及其化合物之间的转化具有重要应用。下列说法正确的是( )A、FeO粉末在空气中受热,迅速被氧化成Fe2O3 B、将废铜屑加入FeCl3溶液中,可以制取铁粉 C、铜盐能杀死细菌,并能抑制藻类生长,因此游泳馆常用硫酸铜作游泳池中水的消毒剂 D、向Fe(NO3)2溶液中滴加稀硫酸酸化,再滴加KSCN溶液,溶液变成血红色,说明Fe(NO3)2溶液已变质12. NO在催化剂条件下可被H2还原为无害物质,反应为2H2(g)+2NO(g)N2(g)+2H2O(g) △H<0。下列说法正确的是( )A、上述反应△S>0 B、上述反应的平衡常数表达式K= C、上述反应中生成1 mol N2 , 转移电子的数目为2×6.02×1023 D、上述反应中,充入水蒸气增大压强可以提高NO的平衡转化率13. 新型Li- CO2电池用碳化钥(Mo2C)作Li极催化剂时正极产物为LiC2O,装置如图所示。若用Au一多孔碳作Li极催化剂,则正极产物为Li2CO3和C。下列说法正确的是( )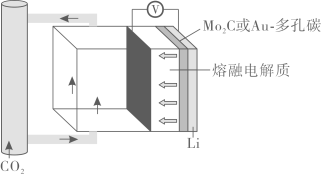 A、该电池负极区可以选用Li2C2O4水溶液作为电解质溶液 B、用Mo2C作催化剂时,负极每消耗7gLi,正极消耗22 g CO2 C、用Au一多孔碳作催化剂时正极反应式为4Li++4e-+3CO2=2Li2CO3+C D、熔融电解质中箭头所指的方向为阴离子移动方向14. 已知草酸为二元弱酸:H2C2O4 +H+ Ka1; -+H+ Ka2 , T℃时,向一定浓度的草酸溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、、三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。下列说法正确的是( )
A、该电池负极区可以选用Li2C2O4水溶液作为电解质溶液 B、用Mo2C作催化剂时,负极每消耗7gLi,正极消耗22 g CO2 C、用Au一多孔碳作催化剂时正极反应式为4Li++4e-+3CO2=2Li2CO3+C D、熔融电解质中箭头所指的方向为阴离子移动方向14. 已知草酸为二元弱酸:H2C2O4 +H+ Ka1; -+H+ Ka2 , T℃时,向一定浓度的草酸溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、、三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。下列说法正确的是( ) A、T℃时,Ka1=10-4.2 B、pH=1.2的溶液中:c(K+)<c(H2C2O4) C、pH=2.7的溶液中:=100 D、向草酸溶液中不断滴加KOH溶液至过量,水的电离度一直增大
A、T℃时,Ka1=10-4.2 B、pH=1.2的溶液中:c(K+)<c(H2C2O4) C、pH=2.7的溶液中:=100 D、向草酸溶液中不断滴加KOH溶液至过量,水的电离度一直增大二、非选择题:本大题共4小题,共58分。
-
15. 利用软锰矿(主要成分是MnO2 , 其中还含有少量CaO、MgO、SiO2、Al2O3等杂质)制取高纯硫酸锰的工艺流程如下图所示。
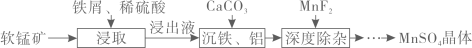
已知:常温下,一些金属氢氧化物沉淀时的pH如下表:
氢氧化物
Fe(OH)3
Fe(OH)2
Mn(OH)2
Al(OH)3
开始沉淀pH
1.5
6.5
7.7
3.8
沉淀完全pH
3.7
9.7
9.8
5.2
常温下,一些难溶电解质的溶度积常数如下表:
难溶电解质
MnF2
CaF2
MgF2
KSp
5.3×10-3
51.5×10-10
7.4×10-11
回答下列问题:
(1)、“浸取”时,铁屑与MnO2反应生成Fe3+的离子方程式为;“浸出液”需要鼓入一段时间空气后,再进行“沉铁”的原因是。(2)、“沉铁、铝”时,加CaCO3控制溶液pH的范围是;完全沉淀时,金属离子浓度为1×10-5 mol·L-1 , 则常温下Ksp[Fe(OH)3]=(3)、深度除杂中加入MnF2可以除去钙离子、镁离子的原因是(用平衡原理解释,已知:K>105可以认为反应几乎完全进行)。(4)、用石墨和金属Mn作电极,电解硫酸锰溶液可以制取金属锰,其中金属Mn应与电源(填“正”或“负”)极相连;阳极产生标准状况下体积为4.48 L气体时,理论上可以制取gMn。16. 三氯化硼(BCl3 , 熔点为-107.3 ℃,沸点为12.5℃)是重要的化学品,主要用作半导体硅的掺杂源或有机合成的催化剂。以硼砂(Na2B4O2·10H2O)为原料制备BCl3的工艺流程如图所示。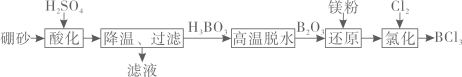
回答下列问题:
(1)、硼砂(Na2B4O7·10H2O)写成氧化物的形式为。(2)、实验室“高温脱水”可以在(填仪器名称)中进行。(3)、“还原”应在保护气氛围中进行,下列气体可以作为保护气的是 (填字母)。A、N2 B、He C、CO2(4)、制备BCl3的实验装置如图所示(已知2B+6HCl2BCl3+3H2)。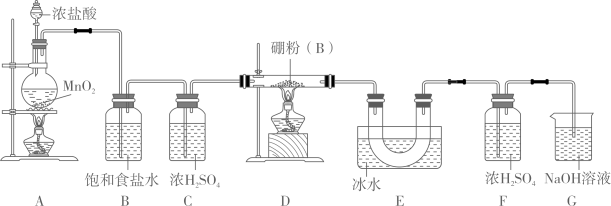
①装置A中发生反应的离子方程式为。
②实验时,如果拆去B装置,可能的后果是。
③为使实验装置简便,可用一个装置代替F和G装置,该装置的名称是 , 所装试剂是。
④实验时先点燃A处酒精灯,一段时间后再点燃D处酒精灯,其理由是。
17. 有机物M是有机合成的重要中间体,制备M的一种合成路线如下:
已知:①A的相对分子质量为76,1 mol A与足量Na反应生成1 mol H2 , 且核磁共振氢谱中有3组峰;
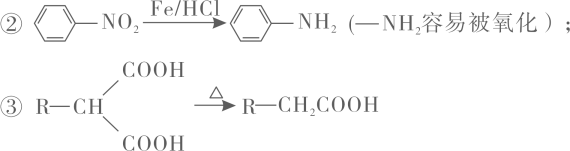
回答下列问题:
(1)、A分子中杂化方式为sp3的原子数为 , C→D的反应类型为。(2)、E中含有的官能团名称为 , I的结构简式为。(3)、F→G的化学方程式为。(4)、写出同时满足下列条件的G的同分异构体:。①能发生水解反应,水解产物之一是α-氨基酸;
②核磁共振氢谱有6组峰,且峰面积之比为3:2:2:2:1:1。
(5)、参照上述合成路线,以 为原料,设计制备
为原料,设计制备 的合成路线:(无机试剂任选)。 18. 二氧化碳有效转化是“碳中和”的重要研究方向,CO2与H2在催化剂条件下可转化为C2H4、CH3OH。回答下列问题:(1)、Ⅰ.转化为CH(g)的反应方程式为2CO2(g)+6H2(g) C2H(g)+4H2O(g) △H<0。
的合成路线:(无机试剂任选)。 18. 二氧化碳有效转化是“碳中和”的重要研究方向,CO2与H2在催化剂条件下可转化为C2H4、CH3OH。回答下列问题:(1)、Ⅰ.转化为CH(g)的反应方程式为2CO2(g)+6H2(g) C2H(g)+4H2O(g) △H<0。在恒压密闭容器中,起始充人2 mol CO2(g)和6 mol H2(g)发生反应,该反应在不同的温度下达到平衡时,各组分的体积分数随温度的变化如图1所示。

①图中表示CO2的体积分数随温度变化的曲线是(填字母)。357℃时可以证明反应达到平衡状态的标志为(填字母)。
a. v正(CO2)=2v逆(H2O)
b.容器中H2的体积分数保持不变
c.混合气体的密度保持不变
②A、B、C三点对应的化学平衡常数分别为KA、KB、KC , 则三者从大到小的排列顺序为。
③B点反应达到平衡后,CO2的平衡转化率为(计算结果保留一位小数),若平衡时总压为P,则平衡常数Kp=(列出计算式,以分压表示,气体分压=总压×气体的物质的量分数)。
(2)、其他条件相同,分别在X、Y两种催化剂作用下,将2 mol CO2(g)和6 mol H2(g)充入体积为1 L的密闭容器内,测得反应相同时间时CO2的转化率与温度的关系如图2所示。
使用催化剂X,当温度高于320℃时,CO2的转化率逐渐下降,其原因是 。根据图像,(填“能”或“不能”)计算280℃时该反应的平衡常数,其理由是。
(3)、Ⅱ. CO2与H2在催化剂作用下可转化为CH3OH。主要反应如下:反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H1=-49 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41kJ·mol-1
则CO(g)和H2(g)反应生成CH3OH(g)的热化学方程式为。