广东省佛山市2023届普通高中教学质量检测(一)化学试题
试卷更新日期:2023-03-02 类型:高考模拟
一、单选题
-
1. 中国文物具有鲜明的时代特征。下列文物的主要成分不属于硅酸盐的是




A.新石器时代·红陶兽形器
B.北燕·鸭形玻璃柱
C.明·象牙雕佛坐像
D.清·五彩花卉瓷盖碗
A、A B、B C、C D、D2. 工业制备硫酸可通过反应制得。下列说法正确的是A、的电子数为26 B、的电子式为 C、属于离子化合物,仅含离子键 D、的空间填充模型为 3. 实验室模拟侯氏制碱法的装置如图所示,其中正确且能达到目的的是
3. 实验室模拟侯氏制碱法的装置如图所示,其中正确且能达到目的的是



A.制备CO2
B.制备NaHCO3
C.加热NaHCO3固体
D.检测产品中是否含有NaHCO3
A、A B、B C、C D、D4. 莲花清瘟胶囊的有效成分大黄素的结构如图所示,该成分有很强的抗炎抗菌药理活性,
关于大黄素的说法正确的是
A、分子式为 B、分子中所有原子可能共平面 C、该物质最多能与氢氧化钠反应 D、可以发生氧化、取代、加成反应5. 莲花清瘟胶囊的有效成分大黄素的结构如图所示,该成分有很强的抗炎抗菌药理活性,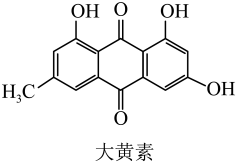
基于结构视角,下列说法正确的是
A、该分子中碳原子的杂化类型均为 B、分子中所含元素的电负性 C、基态氧原子核外电子的空间运动状态有8种 D、该分子为非极性分子6. 碳酸盐约占海水盐分的0.34%,一种海水脱硫的新工艺如图所示。下列说法错误的是 A、排入大气易引起酸雨 B、海水吸收二氧化硫时可能有逸出 C、处理后的海水增大 D、海水脱硫工艺简单,投资及运行费用低7. 食醋有效成分主要为醋酸(用HAc表示),常温下HAc的。下列说法错误的是
A、排入大气易引起酸雨 B、海水吸收二氧化硫时可能有逸出 C、处理后的海水增大 D、海水脱硫工艺简单,投资及运行费用低7. 食醋有效成分主要为醋酸(用HAc表示),常温下HAc的。下列说法错误的是选项
实验操作
结论
A
加热醋酸水溶液(忽略溶质的挥发)
溶液的导电能力、HAc的电离程度均增大
B
常温下测得NH4Ac水溶液
NH4Ac溶于水不发生水解
C
加入NaOH溶液与醋酸溶液恰好中和
中和后:
D
常温下,HAc溶液与NaOH溶液混合,测得溶液pH为4.76
反应后:
A、A B、B C、C D、D8. 下列反应的离子方程式正确的是A、向溶液中滴加溶液: B、向中投入固体: C、向溶液通入: D、用醋酸溶解石灰石:9. 化学是以实验为基础的学科。下列实验操作能达到对应目的的是选项
实验操作
目的
A
乙醇与浓硫酸混合迅速加热到
制备乙烯
B
分别测定饱和溶液的
比较的酸性
C
铁锈溶于稀盐酸,再滴加酸性高锰酸钾溶液
检验铁锈中是否含
D
溶液中依次滴加过量氯水、淀粉溶液
比较氧化性
A、A B、B C、C D、D10. X、Y、Z为短周期元素且原子序数依次增大,其中Y、Z为同一周期元素,X为周期表中电负性最强的元素,三者可以形成Y3ZX6配合物。下列说法正确的是A、原子半径: B、Y和Z最高价氧化物对应的水化物可以相互反应 C、X的氢化物为强酸,可与反应 D、该配合物在水中的电离方程式为11. 向1L的恒容密闭容器中加入1molX和3molY,发生反应X(g)+3Y(g)2Z(g),X的转化率随温度t的变化如图所示(不同温度下的转化率均为反应第10min数据)。下列说法正确的是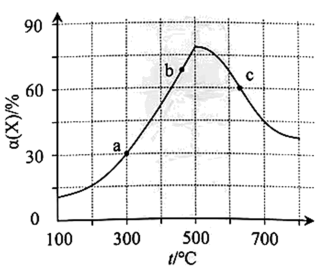 A、a点的反应速率 B、a、b、c点对应的大小关系为: C、c点时,每消耗的同时,消耗 D、若将容器体积扩大为2倍,则c点对应温度下的增大12. 一种全氢电池的工作原理如图所示。下列说法正确的是
A、a点的反应速率 B、a、b、c点对应的大小关系为: C、c点时,每消耗的同时,消耗 D、若将容器体积扩大为2倍,则c点对应温度下的增大12. 一种全氢电池的工作原理如图所示。下列说法正确的是 A、X极为全氢电池的正极 B、该电池将化学能转化成电能 C、电极Y的电极反应式为: D、反应一段时间后左室增大
A、X极为全氢电池的正极 B、该电池将化学能转化成电能 C、电极Y的电极反应式为: D、反应一段时间后左室增大二、综合题
-
13. HNO3是重要的化工原料,浓HNO3与Cu反应的装置如图1所示:
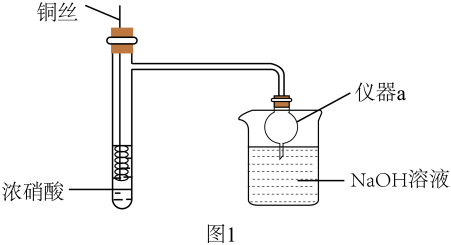
回答下列问题:
(1)、仪器a的名称是 , 在该实验中的作用为。(2)、关于该实验下列说法错误的是_______。A、该反应需要加热才能进行 B、可通过抽动铜丝控制反应开始和停止 C、反应后迅速生成大量红棕色气体 D、烧杯中仅发生中和反应(3)、某小组同学发现Cu与浓HNO3反应所得混合溶液为绿色,Cu与稀HNO3反应所得混合溶液为蓝色,针对绿色产生的原因展开探究。【提出猜想】
猜想a:Cu(NO3)2浓度大
猜想b:NO2溶解在Cu(NO3)2溶液中
【实验验证】
实验i:配制饱和Cu(NO3)2溶液,溶液呈色,证明猜想a不成立。
实验ii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到 , 5min后,溶液完全变为蓝色,证明猜想b成立。
 (4)、另一组同学查阅资料发现:NO2能与水反应生成HNO2 , 进而发生下述反应:
(4)、另一组同学查阅资料发现:NO2能与水反应生成HNO2 , 进而发生下述反应:①由此该组同学认为通过实验说明猜想b成立不严谨,理由是。
②写出NO2与水反应生成HNO2的化学方程式。
③该组同学改进后设计了新的实验:
实验iii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。对比实验ii与实验iii,可推测Cu(NO3)2溶液为绿色的原因主要是。
14. 镍是重要的战略金属资源,一种从某高镁低品位铜镍矿(主要成分为CuFeS2、FeS2、3NiO●4SiO2●H2O、3MgO●4SiO2●H2O等)中回收Cu、Ni的工艺流程如图所示: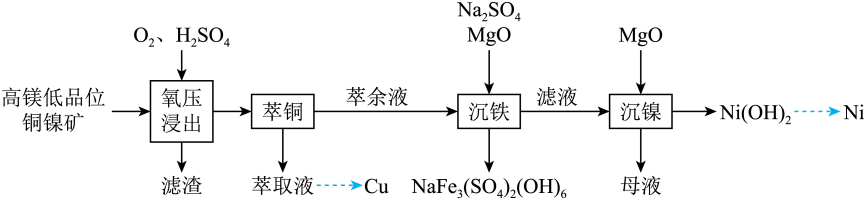
回答下列问题:
(1)、 中,元素的化合价为。(2)、为提高“氧压浸出”的速率,可行的操作有(任填一个)。(3)、“氧压浸出”的滤渣有S和 , 该环节中发生的化学反应方程式为。(4)、“萃铜”时的反应为:(有机相)(水相)(有机相)(水相),下列说法正确的有_______。A、向萃取液中加入稀硫酸进行“反萃取”,可得到单质 B、萃余液中的阳离子为: C、一定条件下,萃取平衡时, , 则的萃取率为80% D、为提高的萃取率,可适当提高溶液(5)、已知 , “滤液”中 , “沉镍”时,控制为8.50,此时的沉淀率为 , “沉镍”后的母液,含有的主要溶质为(填化学式)。15. 有机物X是合成一种治疗细胞白血病药物的前体,其合成路线如图所示:
回答下列问题:
(1)、Ⅱ的结构简式为。(2)、 ,则W的化学式为。(3)、由Ⅵ生成Ⅶ的化学方程式为。(4)、Ⅷ的化学名称为 , Ⅸ中所含官能团的名称为。(5)、Ⅲ的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。①苯环上有二个取代基;
②能发生银镜反应,不能发生水解反应;
③核磁共振氢谱显示有5种不同化学环境的氢原子,且峰面积之比为3∶2∶2∶1∶1。
(6)、参照上述合成路线,设计由Ⅲ和1,3-丁二烯合成 的路线(其它无机试剂任选)。 16. 碳中和是我国的重要战略目标,以和为原料合成受到广泛关注。
的路线(其它无机试剂任选)。 16. 碳中和是我国的重要战略目标,以和为原料合成受到广泛关注。该过程主要涉及以下反应:
反应I
反应II
回答下列问题:
(1)、已知: , 反应I的0(填“>”、“<”或“=”),反应I和II的吉布斯自由能与热力学温度(T)之间的关系如图所示,。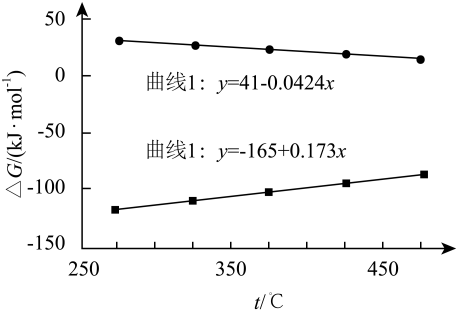 (2)、向密闭容器中充入、反应合成 , 平衡时各组分的体积分数随温度变化如图所示。
(2)、向密闭容器中充入、反应合成 , 平衡时各组分的体积分数随温度变化如图所示。
①在工业上,常选用作为合成温度,原因是。
②时对甲烷的选择性=(保留2位有效数字,已知:选择性=生成的物质的量/参与反应的的物质的量),该温度下反应II的。(保留2位有效数字,已知:分压=组分物质的量分数×总压)
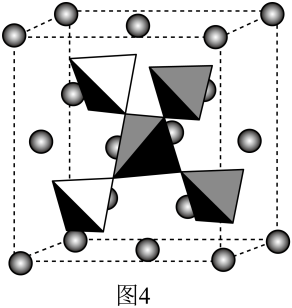
(3)、光催化剂在光能作用下,电子发生跃迁,形成类似于电解池的阴阳极,将转变为。酸性环境下该过程的电极反应式为。17. 我国提取的月壤样品主要是由硅酸盐组成的辉石、斜长石,回答下列问题:(1)、基态硅原子的价电子排布图为。(2)、CO2与SiO2是同主族氧化物,但熔沸点差距很大,其原因是。(3)、硅酸盐阴离子的基本结构单元如图1所示,其化学式;图2阴离子由两个图1单元共用1个顶角氧组成,其所带的负电荷数为;图3是角项氧相连的硅氧四面体形成螺旋上升的长链,其、O原子的个数比为。 (4)、Mg和Cu形成的晶体中,也存在四面体结构,Mg以金刚石方式堆积,剩余的4个四面体空隙放置Cu4四面体,如图4所示。Cu4四面体结构的镁配位数为 , 已知晶胞参数为 , 为阿伏加德罗常数的值,则该晶体的密度为(列出计算表达式)。
(4)、Mg和Cu形成的晶体中,也存在四面体结构,Mg以金刚石方式堆积,剩余的4个四面体空隙放置Cu4四面体,如图4所示。Cu4四面体结构的镁配位数为 , 已知晶胞参数为 , 为阿伏加德罗常数的值,则该晶体的密度为(列出计算表达式)。