河南省郑州市2023届高三下学期一模考试化学试题
试卷更新日期:2023-03-02 类型:高考模拟
一、单选题
-
1. 化学与生活密切相关。下列说法正确的是A、使用医用酒精对物体表面消毒时,医用酒精的浓度是95% B、《清明上河图》原作是在绢上作画,绢的主要成分是纤维素 C、四氯乙烯是目前使用最普遍的干洗溶剂,在衣物上残留对人体无害 D、北京冬奥会采用银离子抗菌技术制作的速滑服,可有效防护细菌侵入2. 化学学科的特征是从宏观和微观两个角度认识物质,以符号形式表征物质,在不同层面创造物质。下列化学用语表达错误的是A、乙烯的结构简式: B、一氯甲烷的分子球棍模型:
 C、硒(Se)原子的结构示意图:
C、硒(Se)原子的结构示意图: D、的电子式:
D、的电子式: 3. 摩尔日(Mole Day)是一个流传于化学家之间的节日,通常在10月23日的上午6:02到下午6:02之间庆祝,被记为6:02 10/23,恰似阿伏加德罗常数。设为阿伏加德罗常数的值,下列说法正确的是A、0.1mol肼含有的孤电子对数为 B、固体中含有个阳离子 C、电解饱和食盐水时,若阴阳两极产生气体的总体积为44.8L,则转移电子数为 D、与足量充分反应,生成个分子4. 价类二维图是基于核心元素的化合价和物质类别研究物质性质的一种模型。下图是硫元素的价类二维图。下列说法正确的是
3. 摩尔日(Mole Day)是一个流传于化学家之间的节日,通常在10月23日的上午6:02到下午6:02之间庆祝,被记为6:02 10/23,恰似阿伏加德罗常数。设为阿伏加德罗常数的值,下列说法正确的是A、0.1mol肼含有的孤电子对数为 B、固体中含有个阳离子 C、电解饱和食盐水时,若阴阳两极产生气体的总体积为44.8L,则转移电子数为 D、与足量充分反应,生成个分子4. 价类二维图是基于核心元素的化合价和物质类别研究物质性质的一种模型。下图是硫元素的价类二维图。下列说法正确的是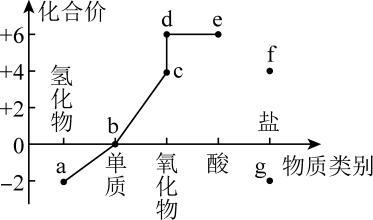 A、硫化亚铁与稀硝酸反应可用来制取a B、从价态角度分析,a、b、c、g、都具有还原性 C、c通入溴水中,溴水褪色,证明c有漂白性 D、b在足量的纯氧中燃烧,可一步转化为d5. 下图原电池装置中,用盐桥连接两烧杯中的电解质溶液。盐桥中阳、阴离子的电迁移率应尽可能地相近。(电迁移率用表示,单位:)。下列有关说法错误的是
A、硫化亚铁与稀硝酸反应可用来制取a B、从价态角度分析,a、b、c、g、都具有还原性 C、c通入溴水中,溴水褪色,证明c有漂白性 D、b在足量的纯氧中燃烧,可一步转化为d5. 下图原电池装置中,用盐桥连接两烧杯中的电解质溶液。盐桥中阳、阴离子的电迁移率应尽可能地相近。(电迁移率用表示,单位:)。下列有关说法错误的是阳离子
阴离子

已知:左、右烧杯中溶液体积相同
4.07
4.61
5.19
7.40
6.59
7.91
7.62
8.27
A、盐桥中的电解质可以为 B、盐桥中的阳离子进入右侧烧杯溶液中 C、电流计读数不变时,向右侧烧杯中加入硫酸铁固体,指针会继续偏转 D、电池反应一段时间后,测得左侧溶液中增加了 , 则右侧溶液中为6. 2022年9月,我国学者张德清课题组与赵睿课题组开展了以四苯乙烯为关键骨架的靶向生物探针方面的研究,实现了对高恶性脑肿瘤细胞增殖的有效抑制。最近,两个课题组共同设计合成了具有顺反异构转化的四苯乙烯化合物(T—P)(如图)。下列有关四苯乙烯化合物(T—P)说法正确的是 A、分子中的官能团只含有碳碳双键、酯基和羟基 B、1mol T—P分子最多能和2mol NaOH反应 C、能发生加成反应、取代反应和水解反应 D、与碳碳双键相连的四个苯环上的碳原子,一定在同一平面上7. 下列实验中,所采取的实验方法与对应原理都正确的是
A、分子中的官能团只含有碳碳双键、酯基和羟基 B、1mol T—P分子最多能和2mol NaOH反应 C、能发生加成反应、取代反应和水解反应 D、与碳碳双键相连的四个苯环上的碳原子,一定在同一平面上7. 下列实验中,所采取的实验方法与对应原理都正确的是选项
实验目的
实验方法
实验原理
A
分离乙酸乙酯和乙醇
用分液漏斗分液
乙酸乙酯和乙醇的密度不同
B
除去中少量的
用饱和溶液洗气
能与反应生成
C
检验溶液中的
滴加稀盐酸,产生无色无味且能使澄清石灰水变浑浊气体
D
得到纯净的
将混有HCl的通过饱和食盐水
HCl极易溶于水
A、A B、B C、C D、D8. 某化学兴趣小组探究催化分解制取氧气,小组成员闻到制得的氧气有轻微的刺激性气味。下列有关分析推理错误的是A、反应后所得固体除外,还可能含有KCl、 B、催化分解,降低了反应的活化能,加快分解速率 C、标准状况下制得22.4L氧气,反应中转移电子4mol D、将制得的气体通入溶液,可能会产生不溶于硝酸的白色沉淀9. W、X、Y、Z四种元素组成的化合物是新能源汽车电池的正极材料,W、X、Y、Z的原子序数依次增大,W和Z是两种金属元素,Z单质是用途最广泛的金属,X、Y形成的有50个电子。下列说法正确的是A、W的简单离子半径大于的半径 B、在同周期元素的氢化物中,X的氢化物沸点最高 C、Y的最高价氧化物对应的水化物的酸性强于碳酸 D、Z元素在化合物中只有+2、+3价10. 硫代碳酸钠在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子。其制备原理为:。下列说法错误的是A、该制备反应属于熵增反应 B、与性质相似,不能被氧化 C、制备的反应属于非氧化还原反应 D、与盐酸反应,生成NaCl、和11. 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯
溴
溴苯
密度
0.88
3.10
1.50
沸点/℃
80
59
156
水中溶解度
微溶
微溶
微溶
下列有关溴苯制备的说法正确的是
A、图中仪器a是玻璃棒 B、反应过程中三颈烧瓶内有白雾,是由生成HBr气体形成的酸雾 C、烧杯中NaOH溶液的作用吸收生成的溴苯,同时除去HBr气体 D、分离操作后得到的粗溴苯,要进一步提纯,必须进行过滤操作12. 以铁硼矿(主要成分为和 , 还有少量、FeO、CaO、和等)为原料制备硼酸的工艺流程如图所示: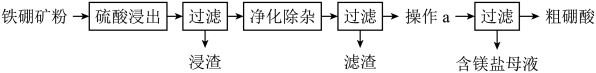
下列说法错误的是
A、浸渣中的物质是、和 B、“净化除杂”需先加溶液再调节溶液的pH C、操作a为蒸发浓缩、冷却结晶 D、“粗硼酸”中的主要杂质是氢氧化铝13. 已知反应 , 在716K时向密闭容器中充入一定量的HI气体,平衡时气体混合物中碘化氢的物质的量分数为78%。测得和的关系如图所示。
下列结论错误的是
A、该反应的压力平衡常数约为0.02 B、增大体系压强,平衡不发生移动,平衡常数不变 C、温度降低,、均减小,平衡向逆反应方向移动 D、温度升高,反应重新达到平衡时,图中表示平衡的点可能是A和D14. 钠离子电池以其低成本、高安全性等成为锂离子电池的首选“备胎”,其工作原理为:。下列说法正确的是 A、放电时,嵌入铝箔电极上,Mn元素被氧化 B、放电时,外电路中每转移 , 理论上碳基材料质量增加4.6g C、充电时,b极为阴极,其电极反应为 D、该电池在充放电过程中,依靠钠离子在两极反复脱嵌和嵌入,未发生氧化还原反应15. 25℃时,向溶液中滴加相同浓度盐酸,体系中粒子浓度的对数值、反应物的物质的量之比与pH的关系如图所示。下列说法错误的是
A、放电时,嵌入铝箔电极上,Mn元素被氧化 B、放电时,外电路中每转移 , 理论上碳基材料质量增加4.6g C、充电时,b极为阴极,其电极反应为 D、该电池在充放电过程中,依靠钠离子在两极反复脱嵌和嵌入,未发生氧化还原反应15. 25℃时,向溶液中滴加相同浓度盐酸,体系中粒子浓度的对数值、反应物的物质的量之比与pH的关系如图所示。下列说法错误的是 A、b点溶液显酸性,是因为存在水解平衡 B、m、n分别表示、变化曲线 C、25℃时,BOH的电离平衡常数为 D、a点对应的溶液中存在:
A、b点溶液显酸性,是因为存在水解平衡 B、m、n分别表示、变化曲线 C、25℃时,BOH的电离平衡常数为 D、a点对应的溶液中存在:二、综合题
-
16. 有机玻璃的化学名称为聚甲基丙烯酸甲酯,俗称明胶玻璃、亚克力,具有较好的透明性、化学稳定性,易染色,易加工,外观优美等优点。由链烃A制备有机玻璃的一种合成路线如下:

回答如下问题:
(1)、写出A的结构简式。(2)、E中官能团的名称为。(3)、反应1和反应2的反应类型分别为、。(4)、写出F转化为G的化学反应方程式。17. 已知A、B、C、D、E、F六种物质存在如下图所示转化关系(部分生成物和反应条件略去) (1)、若A,C均为氧化物
(1)、若A,C均为氧化物①D溶液中滴加KSCN溶液显红色,写出B→D的离子方程式。
②若F是正盐,其水溶液呈碱性,D是一种温室气体,写出E的一条用途。
(2)、若C为人体须臾不可离开的气体,则F的化学式可能为(至少写两种)。(3)、若C是一种白色沉淀,E是引起酸雨的主要气体,则A与反应的化学方程式可能为。18. 是一种安全稳定、高效低毒的广谱型消毒剂,它易溶于水、难溶于有机溶剂,高浓度的气体易爆炸。与纯净的反应可制得和NaCl。实验室用制备和收集一定量的的装置如下图(夹持装置略),其中装置F为的收集装置。 (1)、装置A中使用X滴加浓盐酸的优点是。(2)、装置D中玻璃仪器的名称为。(3)、请写出圆底烧瓶中发生反应的离子方程式。(4)、装置E中所盛试剂是 , 其作用为。(5)、葡萄糖、氯酸钾和适量的溶液反应可以得到 , 反应中生成的起稀释的作用,大大提高了生产、储存和运输的安全性,其化学方程式为。19. 一种利用废脱硝催化剂(含、、等成分)提取钛、钒的工艺流程如下图所示。
(1)、装置A中使用X滴加浓盐酸的优点是。(2)、装置D中玻璃仪器的名称为。(3)、请写出圆底烧瓶中发生反应的离子方程式。(4)、装置E中所盛试剂是 , 其作用为。(5)、葡萄糖、氯酸钾和适量的溶液反应可以得到 , 反应中生成的起稀释的作用,大大提高了生产、储存和运输的安全性,其化学方程式为。19. 一种利用废脱硝催化剂(含、、等成分)提取钛、钒的工艺流程如下图所示。
已知:①钛酸钠难溶于水;
②溶液的酸性较强时,价钒主要以的形式存在;
③溶液中某离子浓度 , 认为该离子沉淀完全。
回答下列问题:
(1)、上述流程中,发生的氧化还原反应有个。(2)、“高温碱浸”中生成钛酸钠的离子方程式是。(3)、将氢氧化钙加入钨酸钠溶液中可得到钨酸钙,已知 , , 当溶液中沉淀完全时,溶液中最大值为。(4)、“沉钒”过程中,一般要加入过量 , 其原因是。(5)、沉钒过程中,沉钒率随溶液pH的变化如图所示。沉钒率随溶液pH的增加先升高后降低的原因可能是。 (6)、取固体加热时,固体减少的质量随温度的变化曲线如图所示。加热到200℃时,产生气体的分子式为。
(6)、取固体加热时,固体减少的质量随温度的变化曲线如图所示。加热到200℃时,产生气体的分子式为。 20. 2022年11月30日,神舟十五号与神舟十四号乘组在“太空会师”。太空生命保障系统利用电解水供氧,生成的氢气与宇航员呼出的二氧化碳在催化剂作用下生成水和甲烷,水可循环使用。(1)、已知
20. 2022年11月30日,神舟十五号与神舟十四号乘组在“太空会师”。太空生命保障系统利用电解水供氧,生成的氢气与宇航员呼出的二氧化碳在催化剂作用下生成水和甲烷,水可循环使用。(1)、已知写出与反应生成和的热化学方程式。
(2)、一定条件下,反应达到平衡状态。①下列操作中,能提高比平衡转化率的是。
a.加入催化剂||| b.降低反应温度
c.移除 d.恒温恒压下通入惰性气体
②某科研小组在一定温度下模拟该反应,向容积为5L的抽空的密闭容器中通入和 , 反应平衡后测得的转化率为50%,则该反应的平衡常数为。
(3)、在相同条件下,与还会发生以下副反应: , 该副反应的发生不利于氧循环,原因是。(4)、已知反应 , 。为了提高甲醇的选择性,某科研团队研制了一种具有反应和分离双功能的分子筛膜催化反应器,原理如图所示。
保持压强为3MPa,温度为260℃,向密闭容器中按投料比投入一定量和 , 不同反应模式下的平衡转化率和甲醇的选择性的相关实验数据如下表所示。
实验组
反应模式
温度/℃
的平衡转化率/%
的选择性/%
Ⅰ
普通催化反应器
3
260
21.9
67.3
Ⅱ
分子筛膜催化反应器
3
260
36.1
100
①双功能的分子筛膜催化反应器模式下,恒温恒容时发生反应 , 不能说明反应达到化学平衡状态的是。
a.的浓度不变 b.混合气体的平均相对分子质量不变
c.混合气密度不变 d.断裂3mol H—H键的同时断裂2mol O—H键
②由表中数据可知,双功能的分子筛膜催化反应器模式下,的转化率明显提高,可能的原因是:。
21. 金属锌具有储量丰富、电池理论容量高、氧化还原电位低、对环境友好等诸多优势;锌的化合物在防腐、电镀、医学、纺织等领域有诸多应用。(1)、一种水性电解液离子选择双隔膜电池如图所示。放电结束后对左侧电极片进行紫外测试,可观测到在765nm处有一个较强的吸收峰,在615nm处有一个肩峰,与标准图像吻合。(注:可溶于水,强碱性环境下最终转化为)。
①该电池中b膜为离子交换膜。(填“阴”或“阳”)
②该电池正极的电极反应式为;当电路中转移1mol电子时,电极质量减少g。
(2)、的浓溶液可形成配合酸 , 因此浓溶液常用作除锈剂。的溶液的酸性就相当千的酸。根据以上信息,请写出的浓溶液除铁锈的化学方程式。(3)、已知难溶于水,在强碱溶液中发生反应 , 下图是二价锌在水溶液中的存在形式与pH的关系,其中c为或浓度的值。
①。
②向的溶液中加入等体积的HCl后,体系中的Zn元素主要以(写微粒符号)形式存在。