广东省广州市天河区2023届高三二模化学试题
试卷更新日期:2023-03-02 类型:高考模拟
一、单选题
-
1. 化学与生产、生活、环境等密切相关。下列说法正确的是A、用于清洗伤口、杀菌、消毒的医用酒精有强氧化性 B、中国天眼使用的防腐蚀材料磷酸钡属于合金 C、被称为“黑金”的新型纳米材料石墨烯属于有机化合物 D、工业然煤中加入生石灰可以减少酸雨的形成2. 我国古代四大发明是古代劳动人民智慧的结晶。下列说法正确的是
选项
四大发明
制作简介
成分分析
A
黑火药
硝石、木炭和硫磺
爆炸时木炭作还原剂
B
活字印刷
胶泥由等组成
都属于金属氧化物
C
宣纸
由青檀树皮及稻草制作而成
主要成分为蛋白质
D
指南针
由天然磁石制成
主要成分是
A、A B、B C、C D、D3. 《医学入门》中记载我国传统中医提纯铜绿的方法:“水洗净,细研水飞,去石澄清,慢火熬干,”其中未涉及的操作是( )A、洗涤 B、粉碎 C、萃取 D、蒸发4. 某小组同学用下图装置验证的性质,培养皿中①、②、③三个塑料瓶盖内盛有不同物质。向固体上滴加适量稀 , 迅速用玻璃片将培养皿盖严,实验记录如下。下列说法错误的是实验装置
瓶盖
物质
实验现象

①
酸性溶液
紫色褪去
②
蘸有品红溶液的棉花
红色褪去
③
蒸馏水
无明显变化
A、产生的离子方程式: B、瓶盖①中的实验现象证明具有还原性 C、瓶盖②中的实验现象证明具有漂白性 D、瓶盖③中的实验现象证明和水不反应5. 下列各组离子在给定溶液中一定能大量共存的是A、在的氨水中: B、在的氯化钠溶液中: C、在的醋酸溶液中: D、时,的溶液中:6. 下列装置用于实验室制取NO并回收Cu(NO3)2·6H2O,能达到实验目的的是( ) A、用装置甲制NO气体 B、用装置乙除NO中的少量NO2 C、用装置丙收集NO气体 D、用装置丁蒸干Cu(NO3)2溶液制Cu(NO3)2·6H2O7. 下列劳动项目与所述的化学知识没有关联的是
A、用装置甲制NO气体 B、用装置乙除NO中的少量NO2 C、用装置丙收集NO气体 D、用装置丁蒸干Cu(NO3)2溶液制Cu(NO3)2·6H2O7. 下列劳动项目与所述的化学知识没有关联的是选项
劳动项目
化学知识
A
用铁盐净水
水解得到胶体
B
面包师用小苏打作发泡剂烘焙面包
可与酸反应
C
工人将模具干燥后再注入熔融钢水
铁与高温下会反应
D
在钢铁设施上安装镁合金
镁比铁活泼,可防止铁被腐蚀
A、A B、B C、C D、D8. 部分含氯物质的分类与相应氯元素的化合价的关系如图所示。下列说法错误的是 A、②和④都有漂白性,可使有色物质褪色 B、用化学方程式表示浓氨水检查输送②的管道是否漏气: C、用电子式表示⑤的形成过程:
A、②和④都有漂白性,可使有色物质褪色 B、用化学方程式表示浓氨水检查输送②的管道是否漏气: C、用电子式表示⑤的形成过程: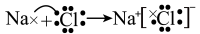 D、用离子方程式表示与①的浓溶液制备②:
9. 用方法可将汽车尾气中的和转化为无污染的气体。下列说法正确的是
D、用离子方程式表示与①的浓溶液制备②:
9. 用方法可将汽车尾气中的和转化为无污染的气体。下列说法正确的是 A、过程中作催化剂 B、过程Ⅰ只发生还原反应,过程Ⅱ只发生氧化反应 C、为直线型非极性分子,一个分子内存在4个键 D、该过程的总反应为:10. 臭氧分解2O3⇌3O2的反应历程包括以下反应:
A、过程中作催化剂 B、过程Ⅰ只发生还原反应,过程Ⅱ只发生氧化反应 C、为直线型非极性分子,一个分子内存在4个键 D、该过程的总反应为:10. 臭氧分解2O3⇌3O2的反应历程包括以下反应:反应①:O3→O2+O• (快)
反应②:O3+O•→2O2 (慢)
大气中的氯氟烃光解产生的氯自由基(Cl•)能够催化O3分解,加速臭氧层的破坏。下列说法正确的是( )
A、活化能:反应①>反应② B、O3分解为O2的速率主要由反应②决定 C、Cl•主要参与反应①,改变O3分解的反应历程 D、Cl•参与反应提高了O3分解为O2的平衡转化率11. 设为阿伏加德罗常数的值。下列叙述正确的是A、标准状况下,溶于水生成的数目为 B、时,的溶液中水电离出的数目为 C、等物质的量的分别与足量盐酸和溶液反应,转移的电子数均为 D、常温常压下,羟基所含的电子数目为12. 下列实验过程能达到预期目的的是选项
实验操作和现象
实验目的
A
向盛有碱石灰的试管中加入某浓溶液,再将湿润的红色石蕊试纸置于试管口附近,试纸变蓝
证明此溶液一定为铵盐溶液
B
向溶液中加入溶液,观察到有白色沉淀生成
证明结合的能力强于
C
将碳酸钙与6mol/L盐酸产生的气体直接通入硅酸钠溶液,产生白色胶状沉淀
证明C的非金属性强于Si
D
向2mL0.1mol/L的NaOH溶液中滴加2滴0.1mol/L的溶液,再滴加2滴0.1mol/L的溶液,白色沉淀转化为红褐色沉淀
证明
A、A B、B C、C D、D13. 我国科学家合成一种比硫酸酸性更强的超强酸M,广泛应用于有机合成,M的结构式如图所示。其中R、X、Y、Z、W为原子序数依次增大的短周期主族元素,Y和W位于同族。下列说法正确的是 A、简单离子半径: B、最简单氢化物的稳定性: C、M中含有极性键和非极性键 D、R、X、Y只能组成一种三元化合物14. X、Y、Z、N是原子序数依次增大的4种短周期元素,其元素性质或原子结构如下表。下列说法正确的是
A、简单离子半径: B、最简单氢化物的稳定性: C、M中含有极性键和非极性键 D、R、X、Y只能组成一种三元化合物14. X、Y、Z、N是原子序数依次增大的4种短周期元素,其元素性质或原子结构如下表。下列说法正确的是元素
元素性质或原子结构
X
原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能低于同周期相邻元素
Y
原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能高于同周期相邻元素
Z
其价电子中,在不同形状的原子轨道中运动的电子数相等
N
只有一个不成对电子
A、原子半径: B、元素的电负性: C、元素的第一电离能: D、X的基态原子的电子轨道表示式: 15. 电池实现了对的高效利用,其原理如图所示。下列说法错误的是
15. 电池实现了对的高效利用,其原理如图所示。下列说法错误的是 A、多孔纳米片为正极,电极上发生还原反应 B、电极反应式为: C、a为 , b为 D、当外电路通过时,双极膜中离解水的物质的量为16. 时,用溶液调节醋酸溶液的 , 实验测得溶液中、的分布系数与的关系如图所示。其中。下列说法正确的是
A、多孔纳米片为正极,电极上发生还原反应 B、电极反应式为: C、a为 , b为 D、当外电路通过时,双极膜中离解水的物质的量为16. 时,用溶液调节醋酸溶液的 , 实验测得溶液中、的分布系数与的关系如图所示。其中。下列说法正确的是 A、曲线1代表 B、 , 的电离常数 C、 D、溶液中始终存在
A、曲线1代表 B、 , 的电离常数 C、 D、溶液中始终存在二、综合题
-
17. 已知为可逆反应,某小组设计实验测定该反应平衡常数并探究影响化学平衡移动的因素。(1)、配制溶液和溶液。
基态核外电子排布式为 , 实验中所需的玻璃仪器有容量瓶、量筒和。(从下图中选择,写出名称)
 (2)、常温下,测定该反应的平衡常数K。
(2)、常温下,测定该反应的平衡常数K。资料卡片
ⅰ.;
ⅱ.为9~l1.5条件下和磺基水杨酸生成稳定的黄色络合物 , 可以通过测定吸光度得知其浓度。
将溶液与溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液。(忽略反应引起的溶液体积变化)
①甲同学通过测定滤液中浓度测得K。取滤液,用标准溶液滴定滤液中 , 至滴定终点时消耗标准溶液。滴定终点的现象为 , 反应的平衡常数。(用含、、V的计算式表示)
②乙同学通过测定滤液中浓度测得K。取滤液,加入磺基水杨酸溶液,加入为9~11.5的缓冲溶液,测定吸光度。测得溶液中浓度为 , 则的平衡常数。(用含c的计算式表示)
(3)、该小组进一步研究常温下稀释对该平衡移动方向的影响。用溶液和溶液,按下表配制总体积相同的系列溶液,测定平衡时浓度,记录数据。
序号
Ⅰ
10
10
Ⅱ
2
a
b
a= , b=。和存在的关系是(用含和的不等式表示),该关系可以作为判断稀释对该平衡移动方向影响的证据。
18. 铬广泛应用于冶金、化工、航天等领域。工业上以铬铁矿(主要成分为 , 含有少量)为原料制备金属铬的工艺流程如图所示:
回答下列问题:
(1)、中为价,的化合价为 , “焙烧”中反应的化学方程式为。(2)、“沉铝”中所得滤渣的成分为 , 需控制的原因为。(3)、“酸化”中反应的离子方程式为 , 若该反应的平衡常数 , 已知:酸化”后溶液中 , 则溶液中。(4)、氧铬酸钙是一种常见含铬矿石,其立方晶胞如图所示。
①氧铬酸钙的化学式为。
②1个钙原子与个氧原子最近且等距离。
③该晶体密度为(列出计算式即可。已知和O的最近距离为 , 代表阿伏加德罗常数)
19. 丙烯是重要的有机化工原料之一,丙烷直接脱氢制丙烯是一条绿色生产丙烯的途径。主反应:
副反应:
(1)、恒压下,主反应的随温度变化如图1所示,0(填”、“<”或=”),判断的理由是。 (2)、恒压下,在不同温度下的平衡体积分数如图2所示,图中表示的体积分数的曲线为(填“a”或“b”),时,的体积分数为。
(2)、恒压下,在不同温度下的平衡体积分数如图2所示,图中表示的体积分数的曲线为(填“a”或“b”),时,的体积分数为。 (3)、下列关于工艺说法正确的是A、的物质的量分数不再改变,反应体系已达平衡 B、采用合适的催化剂能提高主反应的平衡转化率,促使丙烯的产率提高 C、反应达到平衡后,增加压强,不变 D、升高温度,生成的速率加快,生成其他副产物的速率减慢(4)、丙烷氧化脱氢制丙烯 , 相比 , 该途径生产丙烯的好处是。(5)、用下图所示装置电解二氧化碳酸性溶液也可制得丙烯。
(3)、下列关于工艺说法正确的是A、的物质的量分数不再改变,反应体系已达平衡 B、采用合适的催化剂能提高主反应的平衡转化率,促使丙烯的产率提高 C、反应达到平衡后,增加压强,不变 D、升高温度,生成的速率加快,生成其他副产物的速率减慢(4)、丙烷氧化脱氢制丙烯 , 相比 , 该途径生产丙烯的好处是。(5)、用下图所示装置电解二氧化碳酸性溶液也可制得丙烯。
①Y极与电源(填“正”或“负”)极相连。
②X极的电极反应式为。
③理论上,。
20. 2021年新型口服抗新冠药物帕罗韦德获批上市。下图是合成帕罗韦德的重要中间体之一(Ⅰ)的合成路线。


回答下列问题:
(1)、的原子利用率 , A的名称 , B中碳原子的杂化类型。(2)、的反应类型 , E中官能团的名称。(3)、F的分子式 , G的结构简式。(4)、写出转化第一步反应的离子方程式。(5)、芳香化合物N为I的同分异构体,写出满足下列条件N的结构简式。①能与溶液发生显色反应;
②最多消耗;
③核磁共振氢谱中有4组峰,其峰面积之比为;
(6)、结合以上流程,设计以乙炔和乙醇为原料制备 的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。