安徽省2023届皖南八校第二次大联考理科综合化学卷
试卷更新日期:2023-03-02 类型:高考模拟
一、单选题
-
1. 紫薯含、等多种矿物元素,富含维生素C(具有较强还原性)等维生素,特别是含有大量花青素(花青素与石蕊类似,是一种天然指示剂)。下列叙述正确的是A、紫薯熬粥颜色很深,滴加几滴老陈醋,搅拌一下,粥就变成了红色 B、是一种对人有益的过渡元素,适量的有利于提高人体免疫力 C、将紫薯煮熟,趁热滴加碘水,紫薯会变蓝 D、紫薯所含淀粉和纤维素属于同分异构体2. 化学知识与科技、生产、生活有密切的关系。下列叙述错误的是A、利用作灭火剂,是因为铵盐易分解且吸热,同时分解产物不支持燃烧 B、红酒中添加 , 利用了的还原性和杀菌消毒的能力 C、是一种绿色消毒剂,可用于自来水杀菌消毒 D、利用制取K,该反应可以说明Na的金属性强于K3. 有机锗被称为“生命的奇效元素”,其主要保健功效包括延缓衰老、增强免疫力、调节代谢性疾病。图为含锗有机物。下列叙述正确的是
 A、Ge原子核外有17种空间运动状态不同的电子 B、该有机物含有四个手性碳原子 C、名叫锗烷,也属于烷烃 D、有机锗和草酸性质相似,属于同系物4. 对下列粒子组在溶液中能否大量共存的判断和分析均正确的是
A、Ge原子核外有17种空间运动状态不同的电子 B、该有机物含有四个手性碳原子 C、名叫锗烷,也属于烷烃 D、有机锗和草酸性质相似,属于同系物4. 对下列粒子组在溶液中能否大量共存的判断和分析均正确的是选项
粒子组
判断和分析
A
、、、
不能大量共存,因发生反应:
B
、、、
不能大量共存,与可发生氧化还原反应
C
、、、
能大量共存,钠盐、铵盐都溶于水
D
、、、
不能大量共存,、会发生氧化还原反应
A、A B、B C、C D、D5. 实验目的、实验操作及现象、结论都正确的是选项
实验目的
实验及现象
结论
A
判断强酸和弱酸
溶液显碱性,溶液显酸性
可以确定是弱酸,无法判断是否为弱酸
B
改变反应物的浓度对平衡的影响
向溶液中加入溶液,达到平衡,然后再加入 , 溶液红色加深
说明增加反应物浓度,化学平衡正向移动
C
验证的氧化性
向黄绿色的氯水加入溶液,溶液黄绿色褪去
有强氧化性
D
验证菠菜中含有铁元素
将新鲜菠菜剪碎、研磨、溶解、过滤,向滤液中加入几滴溶液,溶液不变红
说明菠菜中不含铁元素
A、A B、B C、C D、D6. 钛合金耐高温,被称之为“航天金属”。工业上可以在℃时电解制得钛,装置如图所示,下列叙述错误的是 A、的作用之一是降低的熔点 B、常温下为液体,可直接电解液体制钛 C、阳极可能会产生有毒的气 D、石墨电极需要定期更换7. 向一个的绝热刚性容器中通入和 , 在一定条件下发生反应 , 正反应速率随时间变化的示意图如下,下列结论正确的是
A、的作用之一是降低的熔点 B、常温下为液体,可直接电解液体制钛 C、阳极可能会产生有毒的气 D、石墨电极需要定期更换7. 向一个的绝热刚性容器中通入和 , 在一定条件下发生反应 , 正反应速率随时间变化的示意图如下,下列结论正确的是 A、升高温度,该反应的平衡常数将增大 B、从反应开始到达到平衡,逆反应速率先增大后减小 C、体系压强不再变化,说明反应达到平衡 D、从容器中分离出少量后,增加,减小,平衡正向移动
A、升高温度,该反应的平衡常数将增大 B、从反应开始到达到平衡,逆反应速率先增大后减小 C、体系压强不再变化,说明反应达到平衡 D、从容器中分离出少量后,增加,减小,平衡正向移动二、综合题
-
8. 无水氯化铜是一种用途广泛的化学试剂,乙醇溶解减压脱水法制备装置如图所示。

回答下列问题:
(1)、圆底烧瓶中盛放的试剂是。(2)、在常压下,圆底烧瓶中液体的恒沸温度为78℃,本实验中恒温槽中最佳水温是℃。a.0 b.60 c.78 d.100
(3)、干燥塔中装有足量的无水 , 其作用是。(4)、实验结束后,关闭真空泵,在卸下圆底烧瓶前,必须进行的操作是。(5)、直接加热无法制得 , 而是分解得到。该反应的化学方程式是。(6)、采用佛尔哈德返滴定法测定样品中氯化铜的含量的反应原理为: , 。取样品于锥形瓶中,加入的溶液,再加指示剂:用的溶液滴定,消耗溶液。①滴定选用的指示剂是。
a.甲基橙 b.酚酞 c.淀粉溶液 d.溶液
②样品中的含量为%。
9. 铬及其化合物在生活中有很多用途。(1)、可检验司机酒后驾车,请写出酸性溶液与酒精反应的离子方程式。的价电子排布式为。铬元素和锰元素的第二电离能分别为 , , 的原因是。(2)、为研究铬的性质,设计如图装置。装置甲中铜电极上产生大量的无色气体;而装置乙中铜电极上无气体产生,铬电极上产生大量红棕色气体。由此可得到的结论是。 (3)、某化工厂从湿法炼锌的铜铬渣(主要含有锌、铜、铁、铬、钻等单质)中回收铬的流程如图所示:
(3)、某化工厂从湿法炼锌的铜铬渣(主要含有锌、铜、铁、铬、钻等单质)中回收铬的流程如图所示: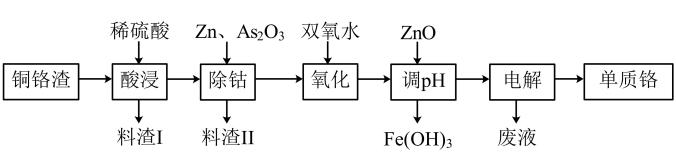
①酸浸时形成的金属离子的价态均相同。加入双氧水时铁、铬形成的离子均被氧化,写出氧化铬形成的离子方程式为。
②“电解”时,阴极的电极反应式为:。
③三价铬离子能形成多种配位化合物。中提供电子对形成配位键的原子分别是(填元素符号),中心离子的配位数为。
④304不锈钢是生活中常见的一种不锈钢,业内也叫做不锈钢,指必须含有以上的铬,以上的镍的不锈钢。铬和镍能形成多种配合物,如为正四面体构型、、为正方形构型、、为正八面体构型等,下列有关说法正确的是(填选项字母)。
A.中含有共价键和离子键
B.304不锈钢不可长时间盛放盐、酱油、醋、菜汤等,不能用304不锈钢锅煲中药
C.不锈钢不会生锈,哪怕在潮湿恶劣的环境
D.和中,镍原子均为杂化
10. 氨既是重要的化工产品,又是染料、医药等工业的重要原料。回答下列问题:(1)、“哈伯—博施法”合成氨反应的能量变化如图(a)所示,则合成氨的热化学方程式为:。 (2)、在不同条件下达到平衡,设体系中氨气的物质的量分数为 , 在下的与p、在下的与T关系如图(b)所示。
(2)、在不同条件下达到平衡,设体系中氨气的物质的量分数为 , 在下的与p、在下的与T关系如图(b)所示。
①(填“曲线a”或“曲线b”)表示的是下的与p关系图像。
②当时,反应条件可能是。
(3)、Fe表面催化循环合成氨机理如下(*代表空白活性位,吸附在活性位上的物种用*标注,如),其中的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。a. b.
c. d.
e. f.
g.
①反应f为。实际生产中,原料气中和物质的量之比为。如此操作的原因有两点:、。
②已知:当2个原子被1个活性位吸附,这2个原子就容易成键。反应a~d中被1个活性位吸附的微粒是(填标号)。
A. B.H C. D.N E.
③研究表明,某些物质(例如硫)能使催化剂永久中毒。依据上述反应机理分析催化剂中毒原因:。
11. 化合物K具有多种有益的生物活性,在医学领域有广泛应用。其合成路线如下:
已知:


回答下列问题:
(1)、B的名称为。从A到B用到了浓硝酸和浓硫酸,请从物质结构角度解释浓硝酸易挥发,浓硫酸难挥发的原因。(2)、A→B的反应方程式是。(3)、D→E反应类型是。(4)、I的结构简式是。(5)、J→K的步骤中,在反应温度一定的条件下,改变的用量,一定时间内反应产率结果显示:的用量与反应中双键及所脱甲基的个数有关,由此说明的用量为(填“催化用量”或“物质的量用量”)。(6)、F有多种同分异构体,其中既能发生水解反应,也能与溶液发生显色反应的有种,写出其中核磁共振氢谱显示5组峰的同分开构体的结构简式。