吉林省长春市高新区2022年5月中考模拟化学试题
试卷更新日期:2023-03-02 类型:中考模拟
一、单选题
-
1. 空气中含量虽少,但可制成多种用途的电光源是( )A、氮气 B、氧气 C、稀有气体 D、二氧化碳2. 赏中华诗词、寻文化基因、品生活之美。《醉翁亭记》中主要体现化学变化的是( )A、日出而林霏开 B、水落而石出 C、泉香而酒洌 D、酿泉为酒3. 全国生态环境保护大会要求“坚决打好污染防治攻坚战”。下列做法符合环保要求的是( )
A、野外焚烧垃圾 B、回收废弃塑料 C、任意排放污水 D、随意丢弃电池4. 施肥是农业增产的重要手段,下列化肥中,属于复合肥的是()A、NH4HCO3 B、Ca(H2PO4)3 C、K2SO4 D、(NH4)2HPO45. 运动型功能饮料含有下列营养素,其中主要用于补充能量的是( )A、葡萄糖 B、维生素 C、水 D、无机盐6. 下图所示实验操作正确的是( )A、 稀释浓硫酸
B、
稀释浓硫酸
B、 倾倒液体
C、
倾倒液体
C、 读取液体体积
D、
读取液体体积
D、 点燃酒精灯
7. 多角度看问题有利于我们在终身学习中赢得未来。甲酸(HCOOH)具有清洁制氢的巨大潜力,其反应 的微观示意图如下,下列说法错误的是( )
点燃酒精灯
7. 多角度看问题有利于我们在终身学习中赢得未来。甲酸(HCOOH)具有清洁制氢的巨大潜力,其反应 的微观示意图如下,下列说法错误的是( ) A、从反应类型看:该反应属于分解反应 B、从微观构成看:三种物质均由分子构成 C、从物质分类看:只有物质乙属于氧化物 D、从表示方法看:反应的化学方程式为8. 北宋沈括在《梦溪笔谈》中记载了用“苦泉水”制取铜的方法,其主要生产流程如图所示。下列解释合理的是( )
A、从反应类型看:该反应属于分解反应 B、从微观构成看:三种物质均由分子构成 C、从物质分类看:只有物质乙属于氧化物 D、从表示方法看:反应的化学方程式为8. 北宋沈括在《梦溪笔谈》中记载了用“苦泉水”制取铜的方法,其主要生产流程如图所示。下列解释合理的是( ) A、①通过蒸发溶剂可获得晶体 B、②是通过复分解反应获得铜 C、③所得硫酸铜溶液一定是饱和的 D、④说明铁元素变成了铜元素9. 下列实验中,实验原理和主要操作方法都符合实验目的的是( )
A、①通过蒸发溶剂可获得晶体 B、②是通过复分解反应获得铜 C、③所得硫酸铜溶液一定是饱和的 D、④说明铁元素变成了铜元素9. 下列实验中,实验原理和主要操作方法都符合实验目的的是( )实验目的
实验原理
主要操作方法
A
除去粗盐中的泥沙
各成分的溶解性差异
蒸发
B
除去CO2中的CO
可燃性差异
点燃
C
鉴别稀盐酸和稀硫酸
酸根离子的化学性质差异
加碳酸钠溶液,观察产生气泡的快慢
D
除去FeSO4溶液中的CuSO4
金属活动性差异
加过量铁粉,充分反应后过滤
A、A B、B C、C D、D10. 人类常利用化学反应得到所需要的物质。如图是X、Y、Z、W四种物质的转化关系(都能通过一步反应实现),则X、Y、Z、W依次可能是( )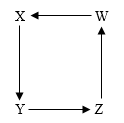 A、C、CO、CO2、H2CO3 B、HCl、NaCl、Na2CO3、NaOH C、CaO、Ca(OH)2、CaCl2、CaCO3 D、Cu、CuO、Cu(OH)2、CuSO4
A、C、CO、CO2、H2CO3 B、HCl、NaCl、Na2CO3、NaOH C、CaO、Ca(OH)2、CaCl2、CaCO3 D、Cu、CuO、Cu(OH)2、CuSO4二、填空题
-
11. 用化学用语回答下列问题。(1)、氢元素的符号;(2)、氢气的化学式;(3)、氢离子。12. 锂是密度最小的金属,广泛应用于电池、贮氢等领域,锂在化合物中通常显+1价。依据下图回答问题:
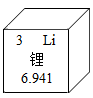 (1)、锂的相对原子质量为;(2)、锂属于(选填“金属”、“非金属”或“稀有气体”)元素;(3)、写出氯化锂的化学式。13. 回答下列与水有关的问题:(1)、在过滤、吸附、蒸馏三种操作中,能将硬水转化成纯净水的是;(2)、通过电解水实验并验证其生成物,可以证明水是由两种元素组成的;(3)、H2O和H2O2元素组成相同,但化学性质不同,其原因是它们的不同。
(1)、锂的相对原子质量为;(2)、锂属于(选填“金属”、“非金属”或“稀有气体”)元素;(3)、写出氯化锂的化学式。13. 回答下列与水有关的问题:(1)、在过滤、吸附、蒸馏三种操作中,能将硬水转化成纯净水的是;(2)、通过电解水实验并验证其生成物,可以证明水是由两种元素组成的;(3)、H2O和H2O2元素组成相同,但化学性质不同,其原因是它们的不同。三、综合题
-
14. 截止2021年10月,长春轨道交通运营线路共有5条,运营里程104.53千米。(1)、乘坐地铁时,不要在车厢内食用榴莲、臭豆腐等有异味的食物,请从分子的角度解释原因;(2)、地铁站台两侧铁护栏器件喷涂油漆,目的是防止Fe与发生反应而生锈;(3)、铝和氧化铁高温条件下的置换反应会释放出大量的热,在地铁施工中用来焊接钢轨缝隙,试写出该反应的化学方程式。15. 下图是某同学设计的实验室制取氧气的发生和收集装置。请完成下列问题。
 (1)、写出图中a仪器的名称:;(2)、锥形瓶底部应放入的药品是 , 该装置的优点是;(3)、发生和收集装置的连接方法是b接 (填“c”或“d”)。16. 根据图所示的NaCl和KNO3溶解度曲线,回答下列问题。
(1)、写出图中a仪器的名称:;(2)、锥形瓶底部应放入的药品是 , 该装置的优点是;(3)、发生和收集装置的连接方法是b接 (填“c”或“d”)。16. 根据图所示的NaCl和KNO3溶解度曲线,回答下列问题。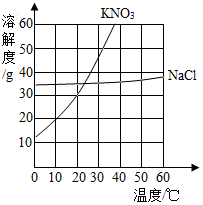 (1)、两种盐比较,溶解度受温度影响变化大的是;(2)、30℃时,将NaCl、KNO3各40g加入到100g水中,充分搅拌后过滤,能 得到饱和溶液的是;(3)、将氯化钠的饱和溶液转化为不饱和溶液,通常采用的方法是。17. 我国科学家研究出碳化钼(Mo2C)负载金原子组成的高效吸附催化体系,使水煤气中的CO和H2O在120℃下发生反应,其微观模型如下图。回答该反 应过程中的相关问题。
(1)、两种盐比较,溶解度受温度影响变化大的是;(2)、30℃时,将NaCl、KNO3各40g加入到100g水中,充分搅拌后过滤,能 得到饱和溶液的是;(3)、将氯化钠的饱和溶液转化为不饱和溶液,通常采用的方法是。17. 我国科学家研究出碳化钼(Mo2C)负载金原子组成的高效吸附催化体系,使水煤气中的CO和H2O在120℃下发生反应,其微观模型如下图。回答该反 应过程中的相关问题。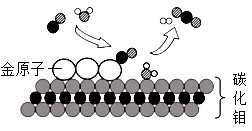 (1)、构成催化剂的各原子(填“有”或“没有”)变化;(2)、金原子对(填“CO”或“H2O”)起吸附催化作用;(3)、反应的化学方程式为;(4)、催化反应体系除钼外还涉及种元素。18. 某化学兴趣小组用如图装置测定空气中氧气的含量。
(1)、构成催化剂的各原子(填“有”或“没有”)变化;(2)、金原子对(填“CO”或“H2O”)起吸附催化作用;(3)、反应的化学方程式为;(4)、催化反应体系除钼外还涉及种元素。18. 某化学兴趣小组用如图装置测定空气中氧气的含量。
【实验步骤】
①实验前,先检查装置的性,然后夹紧止水夹,导气管一端放入盛有50mL水的量筒中;
②将装有白磷的试管浸入热水中,使白磷燃烧;
③待装置冷却至室温后打开止水夹,观察到量筒中的水回流至试管中,停止回流后,取出导气管,读取剩余水的体积。
【数据分析】
设空气中氧气体积分数为20%,量筒中剩余的水的体积理论为mL,实际发现量筒中剩余的水比理论值大很多,可能的原因是。
19. 某同学对自热食品发热包进行了如下探究。食品专用发热包
禁止食用
主要成分:生石灰、碳酸钠、铝粒
储存条件∶存放于阴凉、干燥处。
使用方法∶撕去塑料袋后、放入适量冷水中。
注意事项:
①请勿湿手接触发热包
②使用过程中、禁止使用热水。小心高温烫,注意通风并远离明火
③使用前后,如有发现破袋污染食品,请勿食用。
④如有发热包内物质误入口、眼、鼻,请立即使用清水冲选、催吐或医院就医。
⑤未成年人请勿独自使用。
XXXX科技有限责任公司
【查阅资料】I.标签信息如图;II.铝遇强碱溶液生成氢气;
【进行实验1】取出发热包按说明使用,观察到剧烈反应,有气泡, 放出大量的热,同时发热包内固体物质变硬、结块。
(1)、【分析与解释】①放热的主要反应为:氧化钙与水化合生成氢氧化钙,其化学反应方程式为;
②氢氧化钙跟碳酸钠反应后溶液碱性增强的原因是;
③远离明火的原因是生成了(填气体化学式);
(2)、【提出问题】使用后的发热包中结块固体是否含有碳酸盐、Al粉?【分析与设计】取结块固体加入过量稀盐酸,通过分析产生的气体成分,可以判断碳酸盐、铝粉是否存在。
【猜想与假设】猜想I:气体是H2 , 判断结块固体中只有存在;
猜想II:气体是 , 判断结块固体中只有碳酸盐存在;
猜想III:气体中含有H2和CO2 , 判断结块固体中碳酸盐和Al粉都存在。
(3)、【进行实验2】按图示装置实验
甲装置中出现的实验现象,同时丁装置中黑色的粉末逐渐变为红色,试管口有水珠产生,证明猜想III正确。若甲、乙装置交换位置能否确定气体中含有CO2 , (填“能”“不能”);
(4)、【总结与反思】通过以上探究,小明做出如下反思:a.发热包应密封防潮保存
b.能与水混合放出热量的物质均可做发热包的发热材料
c.使用后的发热包应包好按照垃圾分类投放
你认为其中正确的是。
20. 调味精盐为改善口味常加入适量的食用硫酸镁。小明欲测定某精盐中硫酸镁的质量分数,进行了如下实验(忽略其它杂质)。
【实验过程】称量40.0g精盐溶于适量的水配得溶液,非等速滴加10%的氢氧化钠溶液,观察沉淀变化情况,同时用pH计监测溶液酸碱度,绘制了溶液pH随时间变化图像。过滤、洗涤、干燥后测得生成沉淀的质量为1.74g。
【数据分析】
(1)、该精盐溶液呈酸性的判断依据是 , 已知 NaCl、Na2SO4溶液呈中性,你判断该溶液呈酸性是由精盐中离子溶于水造成的。(2)、你判断Mg(OH)2沉淀生成对应着图像的段(填字母序号)a.A—B b.B—C c.C—D d.B—D
(3)、请补全求精盐中硫酸镁的质量分数的计算过程。解:设硫酸镁质量为x,
写出相关量①
列出比例式
答:硫酸镁的质量分数为。