江苏省淮安市2022年中考化学真题
试卷更新日期:2023-03-02 类型:中考真卷
一、单选题
-
1. 下列变化中,属于物理变化的是( )A、滴水成冰 B、花生霉变 C、蜡烛燃烧 D、葡萄酿酒2. 储存易燃物和易爆物的厂房需要有明显的安全标志。下列图标不属于消防安全标志的是( )A、
 B、
B、 C、
C、 D、
D、 3. 下列常见物品所用材料属于无机非金属材料的是( )A、塑料脸盆 B、陶瓷花瓶 C、不锈钢刀叉 D、机动车轮胎4. “端午到,粽香飘”。对闻到粽子香气的解释合理的是( )A、分子的数目变多 B、分子的体积变大 C、分子在不断运动 D、分子发生了分解5. 在探究“铜绿”性质的实验中,下列操作错误的是( )A、添加“铜绿”
3. 下列常见物品所用材料属于无机非金属材料的是( )A、塑料脸盆 B、陶瓷花瓶 C、不锈钢刀叉 D、机动车轮胎4. “端午到,粽香飘”。对闻到粽子香气的解释合理的是( )A、分子的数目变多 B、分子的体积变大 C、分子在不断运动 D、分子发生了分解5. 在探究“铜绿”性质的实验中,下列操作错误的是( )A、添加“铜绿” B、倾倒盐酸
B、倾倒盐酸 C、点燃酒精灯
C、点燃酒精灯 D、洗涤试管
D、洗涤试管 6. 下列关于空气及其成分的说法错误的是( )A、空气中各成分含量相对稳定 B、CO2含量过高影响人体健康 C、N2用作粮食、瓜果的保护气 D、O2可以支持所有的物质燃烧7. 胰蛋白酶是我国自主研发新冠疫苗的原料之一,其中一种胰蛋白酶的化学式为C6H15O12P3。下列关于这种胰蛋白酶的说法正确的是( )A、该物质由四种元素组成 B、该物质由碳、氢、氧、磷原子构成 C、该物质的相对分子质量为372g D、该物质中碳、氧元素的质量比为2:18. 下列实验方案设计不合理的是( )
6. 下列关于空气及其成分的说法错误的是( )A、空气中各成分含量相对稳定 B、CO2含量过高影响人体健康 C、N2用作粮食、瓜果的保护气 D、O2可以支持所有的物质燃烧7. 胰蛋白酶是我国自主研发新冠疫苗的原料之一,其中一种胰蛋白酶的化学式为C6H15O12P3。下列关于这种胰蛋白酶的说法正确的是( )A、该物质由四种元素组成 B、该物质由碳、氢、氧、磷原子构成 C、该物质的相对分子质量为372g D、该物质中碳、氧元素的质量比为2:18. 下列实验方案设计不合理的是( )选项
实验目的
实验方案
A
比较铝和锌的金属活动性强弱
将铝片和锌粒分别放入硫酸铜溶液中,观察现象
B
除去氧化钙中少量的碳酸钙
将固体混合物高温煅烧至质量不再减少
C
鉴别化肥氯化钾和氯化铵
取少量样品,分别加入熟石灰研磨,闻气味
D
检验氢氧化钠溶液是否变质
取少量样品,滴加澄清石灰水,观察是否产生沉淀
A、A B、B C、C D、D9. 推理是学习和研究化学常用的方法。下列推理合理的是( )A、碱溶液能使紫色石蕊变蓝,则使紫色石蕊变蓝的都是碱溶液 B、石墨和金刚石都含有碳元素,则石墨和金刚石性质完全相同 C、灼烧蛋白质有烧焦羽毛气味,则灼烧羊毛也有烧焦羽毛气味 D、洗洁精除油污的原理是乳化,则汽油除油污的原理也是乳化10. 神舟十三号实现了迄今为止我国时间最长的一次载人航天飞行,三位宇航员日均消耗的1650升氧气,主要用于体内葡萄糖(C6H12O6)的缓慢变化。为保障宇航员在太空中正常生活,启用了生物再生生命保障系统(如图所示)。下列有关说法错误的是( ) A、水电解系统能将电能转化为化学能 B、此系统中的水全部参与循环,没有损耗 C、此系统可实现有机物与无机物的相互转化 D、此系统解决了宇航员因呼吸需携带大量氧气的难题
A、水电解系统能将电能转化为化学能 B、此系统中的水全部参与循环,没有损耗 C、此系统可实现有机物与无机物的相互转化 D、此系统解决了宇航员因呼吸需携带大量氧气的难题二、填空题
-
11. 从下列选项中选择一种适当物质填空(填序号)。
A.淀粉 B.干冰 C.小苏打
(1)、生活中可用于治疗胃酸过多的物质是。(2)、用于人工降雨、制造舞台云雾的物质是。(3)、在面条上滴1滴碘水,观察到表面呈蓝色,说明面条中含有。12. “绿水青山就是金山银山”是建设生态文明的重要理念。(1)、保护洪泽湖水资源,建设优美的生态环境。下列措施可行的是____。A、清理水中废弃物 B、游船使用清洁能源 C、随意捕捞水产品(2)、二氧化氯(ClO2)是一种常用的消毒剂,可用X与SO2反应制备。该反应的化学方程式为 ,其中X的化学式是。(3)、请你列举一条生活中节水的具体措施。13. 硝酸钾、硝酸钠、氯化钠的溶解度曲线如图所示。回答下列问题: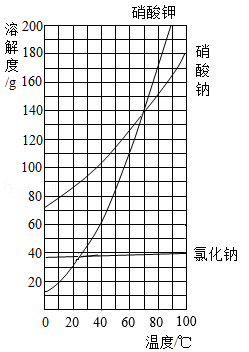 (1)、氯化钠以离子形式分散在水中,氯化钠中带正电荷的离子是(填离子符号)。(2)、60℃时,硝酸钾的溶解度是g。(3)、20℃时,将40g硝酸钠加入50g水中,形成溶液(填“饱和”或“不饱和”)。(4)、60℃时,将等质量的硝酸钾和氯化钠的饱和溶液分别降温至20℃。下列判断正确的是____。A、析出晶体质量:硝酸钾>氯化钠 B、所得溶液中溶剂质量:硝酸钾>氯化钠 C、所得溶液中溶质质量分数:硝酸钾>氯化钠
(1)、氯化钠以离子形式分散在水中,氯化钠中带正电荷的离子是(填离子符号)。(2)、60℃时,硝酸钾的溶解度是g。(3)、20℃时,将40g硝酸钠加入50g水中,形成溶液(填“饱和”或“不饱和”)。(4)、60℃时,将等质量的硝酸钾和氯化钠的饱和溶液分别降温至20℃。下列判断正确的是____。A、析出晶体质量:硝酸钾>氯化钠 B、所得溶液中溶剂质量:硝酸钾>氯化钠 C、所得溶液中溶质质量分数:硝酸钾>氯化钠三、综合题
-
14. 淮安有丰富的盐矿资源,化学兴趣小组同学称取一定质量粗盐样品(含有泥沙),用如图所示装置进行初步提纯。回答下列问题:
 (1)、操作①中,发现天平指针向右偏,接下来的操作是。(2)、操作④中,滤液仍然浑浊,可能的原因是____。A、滤纸破损 B、滤纸未紧贴漏斗内壁 C、漏斗内液面高于滤纸边缘(3)、操作⑤中,待蒸发皿内出现时,停止加热。15. 某氮肥厂用煤、空气和水为原料合成氨气(NH3),同时可得到副产品碳酸氢铵。其工艺流程如图所示:
(1)、操作①中,发现天平指针向右偏,接下来的操作是。(2)、操作④中,滤液仍然浑浊,可能的原因是____。A、滤纸破损 B、滤纸未紧贴漏斗内壁 C、漏斗内液面高于滤纸边缘(3)、操作⑤中,待蒸发皿内出现时,停止加热。15. 某氮肥厂用煤、空气和水为原料合成氨气(NH3),同时可得到副产品碳酸氢铵。其工艺流程如图所示: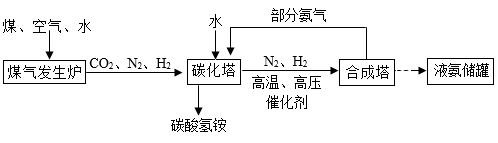
回答下列有关问题:
(1)、煤加入煤气发生炉前需经过粉碎处理,其目的是。(2)、“合成塔”中发生反应的化学方程式是。(3)、部分氨气通入“碳化塔”的目的是。(4)、氨气被广泛认为是未来理想的零碳燃料,其燃烧的微观示意图如图所示。
①参加反应的甲、乙分子个数比是。
②该反应属于(填基本反应类型)反应。
16. 根据如图所示气体制取装置,回答下列问题: (1)、组装A时,依据酒精灯(填“外焰”或“内焰”)的高度调节试管位置。(2)、实验室用双氧水和二氧化锰制备氧气,应选择的发生装置是(填序号),该反应的化学方程式是。(3)、通常情况下,二氧化碳能溶于水。实验室若采用排水法收集二氧化碳气体,为减少其损耗,应选择的装置是(填序号)。17. 阅读下面短文,回答问题。
(1)、组装A时,依据酒精灯(填“外焰”或“内焰”)的高度调节试管位置。(2)、实验室用双氧水和二氧化锰制备氧气,应选择的发生装置是(填序号),该反应的化学方程式是。(3)、通常情况下,二氧化碳能溶于水。实验室若采用排水法收集二氧化碳气体,为减少其损耗,应选择的装置是(填序号)。17. 阅读下面短文,回答问题。铁是生活中使用最广泛的金属,活泼性较强,铁元素属于人体必需微量元素之一。
我国在春秋时期就开始了铁的冶炼,汉代出现了最早的炼铁高炉。
“苟利国家生死以,岂因祸福避趋之。”林则徐修筑洪泽湖大堤,所展现出的勤政爱民、甘于奉献是其一生赤子情怀的缩影。林则徐用生铁铸成铁锅(如图1),放在条石的齿槽之间,再浇上由糯米汁与熟石灰搅拌而成的砂浆,使得条石与条石牢牢地黏合在一起,不留丝毫缝隙,做到了针插不进、水泼不进。他还在每一块铁锔上刻上自己的名字,以表示对其修筑的工程终身负责。如今一百九十多年过去了,洪泽湖大堤依然固若金汤。
 (1)、人体缺乏铁元素,会影响健康,易得____(填序号)。A、佝偻病 B、贫血症 C、甲状腺疾病(2)、工业上用赤铁矿石(主要成分:Fe2O3)冶炼生铁,Fe2O3与CO反应的化学方程式是。(3)、利用铁锔和砂浆将条石与条石牢牢黏合在一起,使大堤固若金汤。
(1)、人体缺乏铁元素,会影响健康,易得____(填序号)。A、佝偻病 B、贫血症 C、甲状腺疾病(2)、工业上用赤铁矿石(主要成分:Fe2O3)冶炼生铁,Fe2O3与CO反应的化学方程式是。(3)、利用铁锔和砂浆将条石与条石牢牢黏合在一起,使大堤固若金汤。①说明铸造铁锔的生铁具有的物理性质是。
②砂浆中的熟石灰与空气接触,发生反应的化学方程式是。
(4)、从条石中取出的铁锔暴露在空气中一段时间后,表面因生锈而腐蚀。导致铁腐蚀的因素有多种,化学兴趣小组同学对此开展以下探究:取四份质量均为0.15g的生铁粉末,分别放入如图2所示装置中进行四次实验。内容记录如下表所示: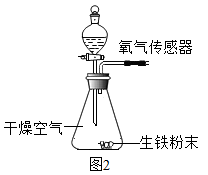
序号
实验操作
3分钟时氧气的含量
Ⅰ
/
21%
Ⅱ
打开分液漏斗活塞,滴加2mL蒸馏水,关闭活塞
15%
Ⅲ
打开分液漏斗活塞,滴加2mL食盐水,关闭活塞
8%
Ⅳ
打开分液漏斗活塞,滴加2mL溶质质量分数为10%的稀盐酸,关闭活塞
13%
①由实验Ⅱ、Ⅲ可知,加速铁生锈的物质是。
②能说明铁生锈需要水的证据是。
③实验Ⅳ中氧气含量下降的原因可能是。
18. 硫酸是世界上产量最大、用途最广的酸,被称为“化学工业之母”。化学兴趣小组同学对硫酸进行了多角度的研究。(1)、【物质制备】工业上采用接触法制硫酸:先煅烧黄铁矿得到SO2 , 再将SO2经过一系列变化得到硫酸。SO2中硫元素的化合价是。
(2)、【物质性质】用温度计的水银球一端蘸取浓硫酸,取出后在空气中放置一段时间,观察到温度计示数上升,是因为浓硫酸能吸收 , 并放出热量。
(3)、请利用下图提供的仪器与药品,探究稀硫酸与氢氧化钠溶液的反应。
①取(填“A”或“B”)中的氢氧化钠溶液5mL加入烧杯中,并插入pH计。
②从另一试剂瓶中取出稀硫酸逐滴加入①的溶液中,并用(填仪器名称)不断搅拌。反应过程中溶液pH变化的部分数据如下表所示:
稀硫酸体积/mL
0
2
4
6
8
……
溶液pH
13.1
12.8
12.3
11.5
10.4
……
③在pH=12.8时,溶液中的溶质是(填化学式)。
④滴加稀硫酸过程中,溶液pH不断减小的原因有:
a.硫酸与氢氧化钠发生了反应;
b.
⑤为证明溶液pH从13.1减小到10.4的过程中,④中原因a起主要作用,需设计的实验方案是。
(4)、【定量研究】某工厂现有含碳酸钠的废水需要处理。为测定废水中碳酸钠的质量分数,化学兴趣小组同学取废水样品100g,加入溶质质量分数为10%的硫酸溶液9.8g,恰好完全反应,反应的化学方程式: (此废水中其他物质不与硫酸反应)。计算废水中碳酸钠的质量分数(写出计算过程)。