黑龙江省大庆市龙凤区2021-2022学年九年级下学期期中化学试题
试卷更新日期:2023-03-01 类型:期中考试
一、单选题
-
1. 我们的衣食住行中蕴含着丰富的化学知识。下列说法错误的是( )A、加碘食盐和铁强化酱油都可补充人体必需常量元素 B、食品添加剂可改善食品品质,但不是添加得越多越好 C、建造高楼大厦时所用到的钢和生铁都是铁的两种合金 D、公交车、出租车用天然气代替汽油作燃料可减少空气污染2. 下列物质敞口放置在空气中,质量都会改变,其中只发生物理变化的是( )A、碱石灰 B、无水硫酸铜 C、浓盐酸 D、潮湿的铁钉3. 下列图示中实验操作错误的是( )A、
 除去CO中的CO2
B、
除去CO中的CO2
B、 检查装置的气密性
C、
检查装置的气密性
C、 稀释浓硫酸
D、
稀释浓硫酸
D、 制取氧气
4. 下列化学方程式与对应反应类型均正确的是( )A、已知稀有金属锰(Mn)在金属活动性顺序中位于铝和锌之间:Mg +MnSO4=MgSO4+Mn 置换反应 B、用含Al(OH)3的药物中和过多的胃酸: Al(OH)3+3HCl═AlCl3+H2O 复分解反应 C、正常酸雨显酸性的原因:SO2+H2O=H2SO3 化合反应 D、高炉炼铁原理:Fe2O3+3CO=2Fe+3CO2 ↑ 复分解反应5. 下列表述错误的是( )A、带电的原子是离子 B、纤维素作为六大基本营养素可以被人体消化吸收 C、实验室中常将固体药品配成溶液进行化学反应,以提高反应速率 D、用托盘天平称量8.1g氯化钠固体6. 下列除杂方案(括号内为杂质)正确的是( )
制取氧气
4. 下列化学方程式与对应反应类型均正确的是( )A、已知稀有金属锰(Mn)在金属活动性顺序中位于铝和锌之间:Mg +MnSO4=MgSO4+Mn 置换反应 B、用含Al(OH)3的药物中和过多的胃酸: Al(OH)3+3HCl═AlCl3+H2O 复分解反应 C、正常酸雨显酸性的原因:SO2+H2O=H2SO3 化合反应 D、高炉炼铁原理:Fe2O3+3CO=2Fe+3CO2 ↑ 复分解反应5. 下列表述错误的是( )A、带电的原子是离子 B、纤维素作为六大基本营养素可以被人体消化吸收 C、实验室中常将固体药品配成溶液进行化学反应,以提高反应速率 D、用托盘天平称量8.1g氯化钠固体6. 下列除杂方案(括号内为杂质)正确的是( )选项
物质
除杂方案
A
CO2(HCl)
通过盛有 NaOH溶液的洗气瓶
B
KClO3固体(KCl)
加热至不再产生气体
C
KNO3溶液(KOH)
加入适量CuSO4溶液,过滤、蒸发
D
MgCl2溶液(NaCl)
加入过量KOH溶液,过滤、洗涤,向所得固体中加入适量稀盐酸至固体恰好溶解
A、A B、B C、C D、D7. 如图是甲、乙、丙三种固体物质的溶解度曲线(变温时不考虑溶剂蒸发),下列说法错误的是( ) A、t1℃时,甲、丙的饱和溶液,溶剂质量可能相等 B、t3℃时,等质量的甲、乙、丙的溶液,溶质的质量可能相等 C、将t3℃时甲、乙、丙的混合溶液降温至t1℃,析出的固体中可能只有乙 D、将t1℃时乙、丙的饱和溶液升温至t2℃,两种溶液中溶质的质量分数可能相等8. 下列图象能正确反映对应变化关系的是( )
A、t1℃时,甲、丙的饱和溶液,溶剂质量可能相等 B、t3℃时,等质量的甲、乙、丙的溶液,溶质的质量可能相等 C、将t3℃时甲、乙、丙的混合溶液降温至t1℃,析出的固体中可能只有乙 D、将t1℃时乙、丙的饱和溶液升温至t2℃,两种溶液中溶质的质量分数可能相等8. 下列图象能正确反映对应变化关系的是( )



A.在一定量的CaCl2溶液中通入CO2气体
B.将浓硫酸露置在空气中
C.足量粉末状金属分别与等质量、等浓度的稀盐酸反应
D.一定质量的饱和石灰水中加入生石灰
A、A B、B C、C D、D9. 下列说法合理的有( )①电木插座破裂后能热修补
②不用其他试剂就能将NaCl、FeCl3、KOH、(NH4)2SO4、H2SO4五种溶液一一区分
③探究Zn、Fe、Ag的金属活动性,可将Fe和Ag分别放入ZnSO4溶液中
④Na2CO3溶液和Ba(OH)2溶液充分反应后,得到白色沉淀A和溶液B,向溶液B中加入少量稀盐酸,无明显现象。则溶液B中不含Na2CO3
⑤有MgSO4和H2SO4的混合溶液100g,先向其中滴加BaCl2溶液,再滴加NaOH溶液,产生沉淀质量与加入溶液质量关系如图所示。则原混合溶液中镁、硫元素的质量比为3:10
 A、2个 B、3个 C、4个 D、5个10. 回收含铜废料(主要成分为Cu)中的铜,部分实验流程如下:
A、2个 B、3个 C、4个 D、5个10. 回收含铜废料(主要成分为Cu)中的铜,部分实验流程如下:
注:灼烧后得到黑色固体和残留物,残留物不溶于水和稀硫酸。
下列关于该流程的说法,错误的是( )
A、“灼烧”的主要目的是将Cu转变为CuO B、滤液X中的溶质为FeSO4 C、“酸溶”和“还原”过程中发生的反应均为置换反应 D、将Cu、Fe混合物加入足量稀硫酸中,充分反应后过滤得Cu二、填空题
-
11. 运用所学知识回答问题(1)、写出地壳中含量最多的金属元素和非金属元素组成的物质的化学式,并标出金属元素的化合价。(2)、硫在氧气中燃烧发出色火焰。(3)、画出镁离子的结构示意图。(4)、由于氦气的化学性质稳定且密度小,因此可用作。(5)、向滴加两滴酚酞试剂的氢氧化钠溶液中,逐滴滴加稀硫酸至过量,可观察到的现象__。12. 运用所学知识回答问题(1)、宏观、微观和符号之间建立联系是学习化学的重要思维方法。如图是某汽车尾气处理过程中发生的一个反应,请写出它的化学方程式。
 (2)、被称为“杂交水稻之父”的中国科学院院士袁隆平先生于2021年5月去世。他为解决世界粮食问题做出了卓越的贡献,他的逝世是中国乃至世界的重大损失。稻谷被加工成大米。从营养角度考虑,大米能给人类提供的主要营养素为(填序号)。
(2)、被称为“杂交水稻之父”的中国科学院院士袁隆平先生于2021年5月去世。他为解决世界粮食问题做出了卓越的贡献,他的逝世是中国乃至世界的重大损失。稻谷被加工成大米。从营养角度考虑,大米能给人类提供的主要营养素为(填序号)。a.蛋白质 b.糖类 c.油脂 d.无机盐
李明在水稻生长过程中发现部分水稻有叶片发黄和倒伏现象,他需要及时施加的一种肥料是(填序号)。
a.KCl b.NH4NO3 c.KNO3 d.NH4H2PO4
(3)、在化学反应中,只要物质所含元素的化合价发生了变化的反应就是氧化还原反应。例如:2Na+Cl22NaCl,反应前后,Na元素、Cl元素的化合价分别发生了变化,该反应是氧化还原反应。根据化合价是否发生变化分析,下列反应(部分反应条件略去)中属于氧化还原反应的是(填序号)。①C+O2CO2②CaO+H2O=Ca(OH)2③CaCO3CaO+CO2↑
④2H2O22H2O+O2↑ ⑤CO+CuOCu+CO2⑥HCl+NaOH=NaCl+H2O
通过进一步定量分析上述氧化还原反应的化合价变化发现:氧化还原反应中元素化合价升高总数(填“大于”、“等于”或“小于”)元素化合价降低总数。根据氧化还原反应的概念,置换反应一定属于氧化还原反应,那么复分解反应(填“一定属于”、“一定不属于”或“可能属于”)氧化还原反应。
三、综合题
-
13. 某小组利用如图装置制备CO2 , 并模拟自然界中CO2的循环。回答下列问题。
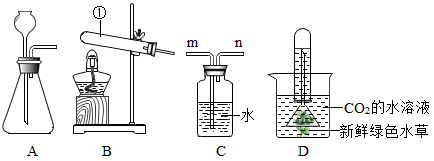 (1)、装置B中仪器①的名称是。(2)、实验室用稀盐酸和石灰石制取CO2 , 反应的化学方程式为 , 发生装置是(填字母序号)。(3)、为制得CO2的水溶液,CO2应从装置C的(填“m”或“n”)端通入。(4)、将CO2的水溶液转移至烧杯,并组装装置如图D所示,置于阳光下一段时间,观察到有气泡产生,检验该气体的方法是。14. 图中A~H为初中化学常见的物质,且分别由C、H、O、Cl、S 、Ca、Cu、Fe、Al中的一种或几种元素组成。A是大理石的主要成分;H在空气中表面生成一层致密的氧化膜,具有很好的抗腐蚀性能;G、E、H均为单质,且E可以被磁铁吸引;C、D、E中含有同一种金属元素;F、D中只含有一种相同的非金属元素。图中“→”表示转化关系,“—”表示相互之间能发生反应(部分反应物、生成物以及反应条件省略。
(1)、装置B中仪器①的名称是。(2)、实验室用稀盐酸和石灰石制取CO2 , 反应的化学方程式为 , 发生装置是(填字母序号)。(3)、为制得CO2的水溶液,CO2应从装置C的(填“m”或“n”)端通入。(4)、将CO2的水溶液转移至烧杯,并组装装置如图D所示,置于阳光下一段时间,观察到有气泡产生,检验该气体的方法是。14. 图中A~H为初中化学常见的物质,且分别由C、H、O、Cl、S 、Ca、Cu、Fe、Al中的一种或几种元素组成。A是大理石的主要成分;H在空气中表面生成一层致密的氧化膜,具有很好的抗腐蚀性能;G、E、H均为单质,且E可以被磁铁吸引;C、D、E中含有同一种金属元素;F、D中只含有一种相同的非金属元素。图中“→”表示转化关系,“—”表示相互之间能发生反应(部分反应物、生成物以及反应条件省略。 (1)、G的化学式;(2)、写出D与H反应生成E的化学方程式;(3)、写出F与H反应的化学方程式;(4)、写出B→A的化学方程式。15. 实验室中现有一种固体混合物,其中可能含有Cu(OH)2、Cu、CuO、NaOH、Na2CO3、CaCl2六种物质中的两种或多种。按下图所示进行实验,出现的现象如图中所述。试根据实验过程和发生的现象判断:
(1)、G的化学式;(2)、写出D与H反应生成E的化学方程式;(3)、写出F与H反应的化学方程式;(4)、写出B→A的化学方程式。15. 实验室中现有一种固体混合物,其中可能含有Cu(OH)2、Cu、CuO、NaOH、Na2CO3、CaCl2六种物质中的两种或多种。按下图所示进行实验,出现的现象如图中所述。试根据实验过程和发生的现象判断: (1)、产生的气体D是(写化学式,下同)。(2)、混合物A中,一定存在的物质是;一定不存在的物质是 , 原因是。(3)、若滤液F呈蓝色,则滤液中一定存在的溶质是。(4)、写出过程③中可能发生的化学反应中的一个化学方程式: , 属于(填基本反应类型)。16. 铁及其化合物在生产生活中发挥着重要作用。(1)、 (一)铁的冶炼和应用
(1)、产生的气体D是(写化学式,下同)。(2)、混合物A中,一定存在的物质是;一定不存在的物质是 , 原因是。(3)、若滤液F呈蓝色,则滤液中一定存在的溶质是。(4)、写出过程③中可能发生的化学反应中的一个化学方程式: , 属于(填基本反应类型)。16. 铁及其化合物在生产生活中发挥着重要作用。(1)、 (一)铁的冶炼和应用早在春秋战国时期,我国就开始生产和使用铁器。工业上炼铁的原理是利用一氧化碳和氧化铁的反应。某化学兴趣小组利用下图装置进行实验探究,请按要求填空:

写出炼铁的反应方程式。
(2)、实验中盛澄清石灰水的试管中可观察到的现象是;右边导气管口放置点燃的酒精灯的目的是。(3)、实验开始时要先通入CO,把装置中的空气排尽后再加热,以防发生爆炸。检验装置中的空气已排尽的方法是。(4)、钢是通过生铁炼制而成的,在炼钢的过程中用纯氧而不用空气的原因是。(5)、(二)铁红( Fe2O3)的制备用工业烧渣(含有Fe2O3、FeO和SiO2)制备化工原料铁红的实验流程如图1:

酸溶前将烧渣粉碎,目的是。
(6)、氧化时发生的反应为2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O反应温度不宜太高,原因是。(7)、(三)铁触媒的制备铁触媒是工业合成氨的催化剂(主要成分为Fe3O4)。用下列装置对铁触媒的制备进行研究。取 48.00g铁红置于装置A中,控制不同的温度对其加热,测得装置B和C的质量变化如表。

表:装置B和C的质量变化
温度/℃
装置B/g
装置C/g
室温
300.00
400.00
500
300.45
400.55
600
300.90
401.10
650
301.80
402.20
资料:①实验室中浓硫酸用于吸收水分,碱石灰用于吸收二氧化碳和水分。
②加热到500℃以上,Fe2O3和CH4开始反应,生成铁的其他氧化物、CO2和H2O。温度高于700℃,生成Fe。
加热前后及过程中均需通入CH4 , 加热前通CH4的目的是。
(8)、用铁红制取铁触媒,装置A应控制的适宜温度为℃。17. 室温下(20℃),某化学兴趣小组同学将二氧化碳通入氢氧化钠的饱和溶液中,观察到有白色沉淀生成,过滤得到白色固体。他们对白色固体的成分进行如下探究。【查阅资料】①Na2CO3+H2O+CO2=2NaHCO3
②20℃时NaOH、Na2CO3、NaHCO3在水中的溶解度:
物质
NaOH
Na2CO3
NaHCO3
溶解度
109g
21.5g
9.6g
③通常情况下,CaCl2溶液与NaHCO3的稀溶液混合无明显现象;
④碳酸氢钠受热易分解:
(1)、【提出问题】白色固体的成分是什么?【作出猜想】猜想一:Na2CO3;猜想二:;猜想三:Na2CO3和NaHCO3
(2)、【实验探究】实验操作
实验现象
实验结论
实验一
取少量白色固体于试管中,加足量水溶解,再加入过量CaCl2溶液
产生白色沉淀
猜想①不成立。
实验二
取实验一中的上层清液滴加适量稀盐酸
②。
猜想三成立
写出实验二中发生反应的化学方程式。
(3)、【拓展延伸】为进一步确定白色固体中Na2CO3的质量分数,兴趣小组另取5.00g白色固体完成如下实验。
①装置B中盛装的药品是。
②装置D的作用是。
(4)、【反思与评价】兴趣小组的成员小明认为:取5.00g白色固体,充分加热至质量不再改变,隔绝空气冷却后,只需称量剩余固体的质量,也可测定白色固体中Na2CO3的质量分数。你认为小明的实验方案是否合理(填“合理”或“不合理”)。四、计算题
-
18. 小敏对实验室用石灰石和稀盐酸制取二氧化碳后的废液,进行溶质成分鉴定.取废液上层清液50克,逐滴加入质量分数为26.5%的碳酸钠溶液,出现气泡,滴加至10克开始出现白色沉淀.继续滴加至沉淀不再产生,过滤,测得沉淀的质量为5克,并绘制了图象.(1)、滴加的溶液中溶质属于(选填“盐”或“碱”).(2)、10克碳酸钠溶液中含有的溶质质量是克.(3)、图象中的a点数值是 .(4)、废液中含有的溶质是(写化学式).(5)、通过计算说明,图象横坐标中的b点表示的溶液的质量是多少克?
