安徽省滁州市定远县吴圩片区2021-2022学年九年级下学期期中化学试题
试卷更新日期:2023-03-01 类型:期中考试
一、单选题
-
1. 安徽不仅山清水秀、景色迷人,而且特产也非常著名。以下特产制作的部分过程中涉及到化学变化的是( )A、
 酿酒
B、
酿酒
B、 剪纸
C、
剪纸
C、 锡雕
D、
锡雕
D、 竹编
2. 下列涉及学科观点的有关说法正确的是( )A、微粒观:氯化钠是由钠原子和氯原子构成的 B、转化观:氧气和二氧化碳在一定条件下可以相互转化 C、结构观:氦原子和镁原子最外层电子数相同,所以它们的化学性质相似 D、守恒观:10mL质量分数20%的稀硫酸加10mL水稀释后,溶质的质量分数变为10%3. 2022年我国环境日的主题为“共建清洁美丽世界”,以下行动不符合这一主题的是( )A、双面使用纸张,节约森林资源 B、重复使用购物袋,减缓“白色污染” C、提倡私家车出行,防止交叉感染 D、分享“清洁行动”,宣传环保意识4. 农业上常用溶质质量分数为16%的氯化钠溶液进行选种,实验室用氯化钠固体配制100g溶质质量分数为16%的氯化钠溶液。下列说法正确的是( )A、所配溶液溶质和溶剂质量之比为16:100 B、称量氯化钠时砝码生锈了,所配溶液的溶质质量分数偏大 C、装瓶时的标签为“NaCl溶液100g” D、用量筒量取水时仰视读数,所配溶液的溶质质量分数偏大5. 如图甲是元素周期表中氯元素的部分信息,图乙是氯原子的结构示意图,则下列说法正确的是( )
竹编
2. 下列涉及学科观点的有关说法正确的是( )A、微粒观:氯化钠是由钠原子和氯原子构成的 B、转化观:氧气和二氧化碳在一定条件下可以相互转化 C、结构观:氦原子和镁原子最外层电子数相同,所以它们的化学性质相似 D、守恒观:10mL质量分数20%的稀硫酸加10mL水稀释后,溶质的质量分数变为10%3. 2022年我国环境日的主题为“共建清洁美丽世界”,以下行动不符合这一主题的是( )A、双面使用纸张,节约森林资源 B、重复使用购物袋,减缓“白色污染” C、提倡私家车出行,防止交叉感染 D、分享“清洁行动”,宣传环保意识4. 农业上常用溶质质量分数为16%的氯化钠溶液进行选种,实验室用氯化钠固体配制100g溶质质量分数为16%的氯化钠溶液。下列说法正确的是( )A、所配溶液溶质和溶剂质量之比为16:100 B、称量氯化钠时砝码生锈了,所配溶液的溶质质量分数偏大 C、装瓶时的标签为“NaCl溶液100g” D、用量筒量取水时仰视读数,所配溶液的溶质质量分数偏大5. 如图甲是元素周期表中氯元素的部分信息,图乙是氯原子的结构示意图,则下列说法正确的是( ) A、氯元素原子核内的质子数为35.45 B、氯原子核外第一层有7个电子 C、化学反应中氯原子易得到电子变成Cl- D、氯元素属于金属元素6. 设计对比实验,控制变量是学习化学的重要方法。下列实验中没有使用对比方法的是( )
A、氯元素原子核内的质子数为35.45 B、氯原子核外第一层有7个电子 C、化学反应中氯原子易得到电子变成Cl- D、氯元素属于金属元素6. 设计对比实验,控制变量是学习化学的重要方法。下列实验中没有使用对比方法的是( )选项
A
B
C
D
实验
装置




实验
目的
探究分子的运动
探究二氧化锰对过氧化氢反应速率的影响
探究空气中
氧气的含量
探究氧气的浓度对硫燃烧的影响
A、A B、B C、C D、D7. 我国科学家在世界上首次实现了用二氧化碳人工合成淀粉,合成过程中碳原子变化为:CO2→C,(有机物X)→C3→C6→Cn(即淀粉),下图为制备有机物X的微观过程,下列说法错误的是( ) A、反应前后原子的种类和数目都不变 B、参加反应的二氧化碳和氢气分子个数比为1:4 C、有机物X的化学式为CH4O D、人工合成淀粉可缓解粮食危机8. 下列依据证据得出的结论,错误的是( )
A、反应前后原子的种类和数目都不变 B、参加反应的二氧化碳和氢气分子个数比为1:4 C、有机物X的化学式为CH4O D、人工合成淀粉可缓解粮食危机8. 下列依据证据得出的结论,错误的是( )选项
证据
结论
A
铁在干燥的空气中不生锈,在潮湿的空气中生锈
铁生锈需要水蒸气
B
向某无色溶液中滴入酚酞,酚酞变红
该溶液一定呈碱性
C
两种物质反应生成盐和水
该反应一定是中和反应
D
铜能将硝酸银溶液中的银置换出来
铜的金属活动性比银强
A、A B、B C、C D、D9. 某小组利用如图装置进行创新实验,向右缓慢推动注射器活塞后发现白碳燃烧。下列有关该实验的说法错误的是( ) A、证明燃烧需要温度达到着火点 B、注射器中氧气可以换成空气 C、细沙和纸棒可以阻止白磷随水流动 D、气球可以缓冲气压减少污染10. 对图象的分析正确的是( )A、
A、证明燃烧需要温度达到着火点 B、注射器中氧气可以换成空气 C、细沙和纸棒可以阻止白磷随水流动 D、气球可以缓冲气压减少污染10. 对图象的分析正确的是( )A、 气体溶解度随温度、压强的变化关系,可知P2>P1
B、
气体溶解度随温度、压强的变化关系,可知P2>P1
B、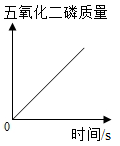 一定量的红磷在空气中燃烧
C、
一定量的红磷在空气中燃烧
C、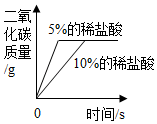 等质量的碳酸钠粉末分别与足量的不同浓度的稀盐酸反应
D、
等质量的碳酸钠粉末分别与足量的不同浓度的稀盐酸反应
D、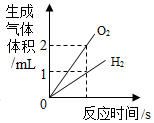 电解水生成的气体体积关系
11. 在一密闭容器中有CO2、H2O、O2和物质R,在一定条件下充分燃烧,测得反应前后各物质的质量如表。下列说法正确的是( )
电解水生成的气体体积关系
11. 在一密闭容器中有CO2、H2O、O2和物质R,在一定条件下充分燃烧,测得反应前后各物质的质量如表。下列说法正确的是( )物质
R
O2
CO2
H2O
反应前质量/g
2.3
10.0
0.3
0.5
反应后质量/g
0
5.2
4.7
x
A、x的值为3.7 B、R的化学式为C2H6 C、该反应属于分解反应 D、该反应中CO2与H2O的化学计量数之比为2∶312. NaCl是重要的资源,其应用与生产如下图所示。下列说法错误的是( ) A、应用①操作的主要步骤为:计算、称量、溶解、装瓶、贴标签 B、应用②在制备烧碱的过程中,水参与了反应 C、应用③为提高产率应先通NH3 , 再通CO2 , 制备过程中还能得到一种化肥 D、生产中提纯粗盐时可依次加入过量的BaCl2、NaOH、Na2CO3溶液,再过滤、蒸发
A、应用①操作的主要步骤为:计算、称量、溶解、装瓶、贴标签 B、应用②在制备烧碱的过程中,水参与了反应 C、应用③为提高产率应先通NH3 , 再通CO2 , 制备过程中还能得到一种化肥 D、生产中提纯粗盐时可依次加入过量的BaCl2、NaOH、Na2CO3溶液,再过滤、蒸发二、科普阅读题
-
13. 阅读下列科技短文,回答问题。
北京冬奥会成功举办。吉祥物“冰墩墩”深受大家欢迎,其外壳由环保PVC(聚氯乙烯)及PC(聚碳酸酯)材料制作而成。火炬“飞扬”秉持绿色、可持续理念,以氢气作为燃料,火炬外壳以碳纤维材质为主。
碳纤维是由碳元素组成的一种新型纤维材料,其密度比铝小,强度是铁的20倍,具有抗电磁辐射、耐腐蚀的特点,化学性质与碳相似。为提高碳纤维的强度,须将碳纤维原丝进行预氧化处理,测得碳纤维强度与热处理温度的关系如图所示。
 (1)、文中涉及到的有机合成材料有(填1种即可,下同),金属材料有。(2)、下列说法正确的是(填字母序号)。
(1)、文中涉及到的有机合成材料有(填1种即可,下同),金属材料有。(2)、下列说法正确的是(填字母序号)。a.碳纤维是一种新型的化合物
b.碳纤维不可燃
c.碳纤维可用作电磁辐射屏蔽材料
(3)、由图可知,碳纤维强度与热处理温度的关系是。(4)、氢气完全燃烧时反应的化学方程式。三、综合题
-
14. 根据下列实验装置图,回答问题:
 (1)、数字标号①的仪器名称:;(2)、实验室用氯酸钾和二氧化锰制取O2 , 反应的化学方程式为 , 应选用的发生装置是。(3)、排空气法收集O2验满的操作方法是:。(4)、如使用右图所示的装置收集O2 , 应由口进入;如将装置中充满了水,O2由口进入。
(1)、数字标号①的仪器名称:;(2)、实验室用氯酸钾和二氧化锰制取O2 , 反应的化学方程式为 , 应选用的发生装置是。(3)、排空气法收集O2验满的操作方法是:。(4)、如使用右图所示的装置收集O2 , 应由口进入;如将装置中充满了水,O2由口进入。 (5)、实验室加热高锰酸钾制氧气,用排水法收集,有以下主要操作步骤:①把药品装入试管中并固定仪器 ②加热;③连接仪器,检查装置的气密性;④用排水法收集气体;⑤停止加热;⑥从水槽中取出导气管。请回答该实验的相关以下问题:
(5)、实验室加热高锰酸钾制氧气,用排水法收集,有以下主要操作步骤:①把药品装入试管中并固定仪器 ②加热;③连接仪器,检查装置的气密性;④用排水法收集气体;⑤停止加热;⑥从水槽中取出导气管。请回答该实验的相关以下问题:A.正确的操作顺序为(写序号):。
B.该反应的化学方程式为。若选择上图A装置做反应发生装置,还需要添加的实验用品是。
C.在步骤④中,收集氧气的适宜时刻是。
(6)、氢气是一种用途较广泛的气体,在实验室中是用锌粒与稀硫酸这种液体反应制取氢气。那么实验室制取氢气的发生装置是(填字母,下同);收集装置是。15. 黄钠铁矾[NaFex(SO4)y(OH)z]是一种高效净水剂。(1)、Ⅰ.黄钠铁矾的制备:用废铁屑(主要成分为Fe,含少量Fe2O3和FeCO3)制备黄钠铁矾的主要流程如图所示: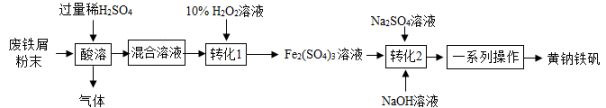
酸溶前将废铁屑研磨成粉末的目的是。
(2)、酸溶时,发生置换反应的化学方程式是。(3)、Ⅱ.黄钠铁矾组成的探究:称取9.70g黄钠铁矾,用如图所示的装置对黄钠铁矾进行加热分解实验。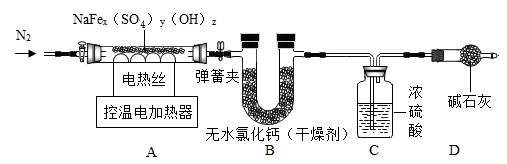
【查阅资料】
【资料】①黄钠铁矾在T1℃分解生成H2O,提高温度至T2℃继续分解生成SO3气体,并生成Fe2O3和Na2SO4。
②浓硫酸可用于吸收SO3。
③碱石灰是氢氧化钠和生石灰的混合物。
装配好实验装置后,先要。
(4)、分别控制温度在T1℃、T2℃对A中固体加热。①控制温度在T1℃加热,实验后测得B装置质量增加1.08g。
②用D装置替换B装置,控制温度在T2℃,加热至反应完全。
③T1℃时,加热后通入一段时间N2。
反应完全后,将A装置中固体溶于足量的水,过滤.洗涤.烘干得4.80g Fe2O3 , 将滤液蒸干得1.42g Na2SO4。结论:实验后D装置质量增加g。NaFex(SO4)y(OH)z中,x:y:z=。
反思:若该实验过程中缺少C装置,则x:z的值(填“偏大”“偏小”或“不变”)。
16. 为解决温室效应,有科学家提出“绿色自由”构想,其原理是把二氧化碳含量高的气体用氢氧化钠溶液吸收,然后再通过化学反应放出二氧化碳,并将二氧化碳储存利用,流程如图所示。 (1)、二氧化碳捕捉室中发生反应的化学方程式是。(2)、流程中没有涉及到的基本反应类型是。(3)、反应、分离室温度升高,其原因是。(4)、反应、分离室中的分离操作是。(5)、流程中可循环利用的物质有。
(1)、二氧化碳捕捉室中发生反应的化学方程式是。(2)、流程中没有涉及到的基本反应类型是。(3)、反应、分离室温度升高,其原因是。(4)、反应、分离室中的分离操作是。(5)、流程中可循环利用的物质有。四、计算题
-
17. 天然气的主要成分是甲烷,甲烷完全燃烧的化学方程式是:CH4+2O2CO2+2H2O,请计算:(1)、48g甲烷完全燃烧,生成二氧化碳的质量为多少?(要求写出计算过程)(2)、在氧气不足的情况下,甲烷不完全燃烧生成一氧化碳、二氧化碳和水,若现有一定质量的甲烷不完全燃烧,生成一氧化碳、二氧化碳和水的总质量为208g,其中水的质量为108g,则参加反应的氧气的质量是g。
-