山东省烟台市2021-2022学年九年级(五四制)下学期期中化学试题
试卷更新日期:2023-03-01 类型:期中考试
一、单选题
-
1. 从《中国成语大会》到《中国诗词大会》,中国诗词文化大放异彩,很多成语、诗词中蕴含着丰富的科学道理,下列叙述错误的是( )A、"百炼成钢”与“沙里淘金”所涉及的变化相同 B、"一畦春韭绿,十里稻花香”是因为分子在不断地运动 C、"真金不怕火炼”说明黄金的化学性质非常稳定 D、"釜底抽薪”与“钻木取火”都体现了燃烧的条件2. 下列有关空气各成分的说法错误的是( )A、空气中氩气的体积分数约为0.934% B、O2在低温、高压时能变为蓝色液体或固体 C、液态氮气是很好的制冷剂,可用于冷藏血液 D、二氧化碳在空气中含量增多会引起温室效应,属于空气污染物3. 镁被称为国防元素。据图回答,下列说法错误的是( )
 A、图1中,当x=0时,表示的符号为Mg2+ B、图2中,当y=18时,其表示的元素与镁元素位于同一周期 C、图2中,当y-z<10时,该粒子是阳离子 D、镁的相对原子质量为24.314. 某同学配制100g质量分数为11%的葡萄糖溶液,下列操作会导致所配溶液浓度偏高的是( )A、用托盘天平称葡萄糖时,砝码放在左盘 B、转移葡萄糖时,纸上有少量残留 C、用量筒量取水时,俯视液面 D、配好溶液装入试剂瓶时,有少量洒出5. 下列关于物质组成与构成的说法,错误的是( )A、原子中核外电子,特别是最外层电子,是决定原子构成物质的关键因素 B、原子在分子中的配置(原子的种类、数量和排列方式)决定了分子的种类 C、化学元素只有一百多种,却组成了所有的化学物质 D、原子得失电子变成离子后,元素的种类发生了改变6. 控制变量是实验探究的重要方法。下列实验设计不能达到实验目的的是( )
A、图1中,当x=0时,表示的符号为Mg2+ B、图2中,当y=18时,其表示的元素与镁元素位于同一周期 C、图2中,当y-z<10时,该粒子是阳离子 D、镁的相对原子质量为24.314. 某同学配制100g质量分数为11%的葡萄糖溶液,下列操作会导致所配溶液浓度偏高的是( )A、用托盘天平称葡萄糖时,砝码放在左盘 B、转移葡萄糖时,纸上有少量残留 C、用量筒量取水时,俯视液面 D、配好溶液装入试剂瓶时,有少量洒出5. 下列关于物质组成与构成的说法,错误的是( )A、原子中核外电子,特别是最外层电子,是决定原子构成物质的关键因素 B、原子在分子中的配置(原子的种类、数量和排列方式)决定了分子的种类 C、化学元素只有一百多种,却组成了所有的化学物质 D、原子得失电子变成离子后,元素的种类发生了改变6. 控制变量是实验探究的重要方法。下列实验设计不能达到实验目的的是( )



A.探究铁、镁金属活动性强弱
B.探究二氧化碳与水是否发生反应
C.探究不同溶剂中物质溶解性大小
D.探究温度对分子运动快慢的影响
A、A B、B C、C D、D7. 河道两旁有甲、乙两厂,它们排放的工业废水中共含有H+、Na+、Ba2+、Cl-、SO、CO六种离子。两厂废水中各含三种离子,其中甲厂的废水明显呈酸性,甲厂废水中的离子是( )A、H+、Na+、Ba2+ B、H+、Ba2+、Cl- C、Na+、SO、CO D、H+、SO、CO8. 下列化学符号中数字“2”表示的意义错误的是( )A、2Fe3+:两个铁离子 B、O2:一个氧分子中含有两个氧原子 C、2He:2个氦元素 D、 :氧化铜中铜元素的化合价为+2价9. 化学与生活息息相关,下列描述全部正确的一组是( )A.化学与生活
B.化学与健康
①人被蚊虫叮咬后涂抹白醋可减轻痒痛
②打开瓶盖放一段时间变酸的牛奶更有营养
①多食用含维生素C的食物可以治贫血病
②霉变不严重的花生米煮熟后也不能食用
C.化学与材料
D.化学与能源
①玻璃钢是一种复合材料
②合金、塑料、合成纤维都属于合成材料
①燃气灶火焰出现黄色,可增大灶具进风口
②太阳能、氢能等新能源的开发和利用让人们的生活更加丰富多彩
A、A B、B C、C D、D10. 某溶液中含有Ba2+、Ag+、Cu2+ , 现有①NaOH溶液②Na2SO4溶液③盐酸,将三种离子逐一沉淀并加以分离,则加入试剂的顺序正确的是( )A、①②③ B、③②① C、②③① D、②①③11. 下列实验能达到实验目的的是( )A、分离Zn和Cu的固体混合物:加适量的Cu(NO3)2溶液,过滤 B、除去CaCl2溶液中少量的HCl:加过量的Ca(OH)2固体,过滤 C、制备Cu(OH)2:将CuSO4溶液和适量Ba(OH)2溶液混合,过滤 D、验证BaSO4中含有BaCO3:取样,加适量稀盐酸后观察是否有气体产生12. 下列图象能正确反映对应变化关系的是( )A、 将表面生锈的铁钉放入稀盐酸中
B、
将表面生锈的铁钉放入稀盐酸中
B、 红磷在密闭容器中燃烧
C、
红磷在密闭容器中燃烧
C、 向硫酸铜溶液中加入锌粉
D、
向硫酸铜溶液中加入锌粉
D、 向稀盐酸中滴加硝酸银溶液
向稀盐酸中滴加硝酸银溶液
二、多选题
-
13. 疫情防控期间用到一种免洗手消毒凝胶,其中含有正丙醇(化学式为C3H8O)。下列有关正丙醇的说法,正确的是( )A、属于有机物 B、一个分子含12个原子 C、相对分子质量为60g D、碳、氢元素的质量比为3:814. 下图为某化学反应的微观模拟示意图,下列说法中,错误的是( )
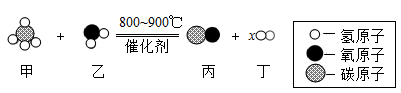 A、乙、丙不属于氧化物 B、图示中x的数值为3 C、反应前后氢元素的化合价发生了改变 D、反应中甲、丙两物质的质量比为2:715. 如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。下列说法正确的是( )
A、乙、丙不属于氧化物 B、图示中x的数值为3 C、反应前后氢元素的化合价发生了改变 D、反应中甲、丙两物质的质量比为2:715. 如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。下列说法正确的是( ) A、三种物质的溶解度大小关系为甲>乙>丙 B、t2℃时,将20g丙物质放入50g水中,得到65g溶液 C、t3℃时,分别用等质量的甲、乙、丙固体配成饱和溶液,需要水的质量大小关系是乙>甲>丙 D、将t2℃的甲、乙、丙三种物质的饱和溶液分别降温到t1℃,所得溶液中溶质的质量分数大小关系为乙>丙>甲
A、三种物质的溶解度大小关系为甲>乙>丙 B、t2℃时,将20g丙物质放入50g水中,得到65g溶液 C、t3℃时,分别用等质量的甲、乙、丙固体配成饱和溶液,需要水的质量大小关系是乙>甲>丙 D、将t2℃的甲、乙、丙三种物质的饱和溶液分别降温到t1℃,所得溶液中溶质的质量分数大小关系为乙>丙>甲三、填空题
-
16. 化学就在我们身边,人类的生活、生产离不开化学。(1)、“杂交水稻之父”袁隆平成功培育出了适宜在盐碱地上种植的“海水稻”。
①水稻中富含的营养素是。
②“海水稻”富含硒,硒是人体必需的(选填“微量”“常量”)元素。
(2)、醋酸,其化学式为CH3COOH,在水中能解离出CH3COO-和H+。现有某醋酸溶液与氢氧化钠溶液作用,该反应前后不变的微粒是;中和反应的实质是。(3)、铝合金在火箭制造中被广泛应用。①铝合金中的铝化学性质活泼,从微观结构上看,原因是。
②铝在岩石圈中以化合物形式存在,工业采用电解氧化铝的方法冶炼铝,写出反应的化学方程式。
(4)、下图是对城市生活污水集中处理的一种装置。
①厌氧池中厌氧菌降解污水中的有机物,获得生命活动所需能量,并生成水和CO2等;有机物降解过程中(选填“吸收”“放出”)能量。
②砂石层所起的作用是。
③植物浮床系统可吸收污水中的N、P、K等营养元素,既能防止水质富营养化,又能减少植物生长所需肥料的施用。请列举一例复合肥。(填化学式)
④到达出水口处流水,(选填“能”或“不能”)达标排放,理由是(写出一条即可)。
17. 垃圾分类就是新时尚。(1)、生活垃圾可分为可回收垃圾、餐厨垃圾、有害垃圾等。
①空饮料瓶、废旧报纸应放置于贴有标志(填字母序号,下同)的垃圾箱中。
②废旧电池中含有铅、镉、汞等有害金属,如果将其随意丢弃,这些金属渗出会造成土壤及污染,威胁健康,应将其放入废旧电池专用收集箱。
③餐厨垃圾是生活垃圾的主要来源。下列有关说法合理的是。
A.餐厨垃圾沥干水分后放入家用垃圾袋
B.部分餐厨垃圾可作为沼气池中发酵的原料
C.外出就餐提倡“光盘行动”
(2)、垃圾是“放错了地方的资源”。①塑料属于材料,部分废旧塑料具有热塑性,可反复加工再利用。
②某兴趣小组从工厂收集到一份金属废料,可能含有AI、Zn、Fe、Ag四种金属中的一种或几种,为测定其组成,便于回收利用,现取样向其中加入一定质量的CuSO4溶液。
I.充分反应,得到无色溶液及少量固体剩余物,且反应前后溶液的质量相等。该金属废料中一定含有(填元素符号)。
Ⅱ.将I中少量固体剩余物置于试管中,加入足量稀盐酸充分反应,(选填“一定有”,“可能有”或“一定没有”)H2生成。
四、综合题
-
18. 化学是认识、改造和应用物质的科学。从海水中提取镁、制“碱”,都体现了人类改造物质的智慧。结合下列流程图(其中部分操作和条件已略去),请回答相关问题:
 (1)、提纯物质常用转化的方法,就是将杂质转化为沉淀或气体而除去。粗盐中含有氯化镁、硫酸钠、氯化钙等可溶性杂质,通过步骤Ⅰ,再利用过滤操作进行除杂。步骤Ⅰ加入下列三种溶液的先后顺序为(填字母序号)。
(1)、提纯物质常用转化的方法,就是将杂质转化为沉淀或气体而除去。粗盐中含有氯化镁、硫酸钠、氯化钙等可溶性杂质,通过步骤Ⅰ,再利用过滤操作进行除杂。步骤Ⅰ加入下列三种溶液的先后顺序为(填字母序号)。a.稍过量的Na2CO3溶液
b.稍过量的BaCl2溶液
c.稍过量的NaOH溶液
(2)、母液中有MgCl2 , 却经历了步骤IV、V的转化过程,其目的是。(3)、步骤Ⅱ中先向饱和食盐水中通入氨气,有利于二氧化碳的吸收,这样做的目的是 , 发生的化学方程式为;反应中生成NaHCO3和NH4Cl的质量比为168:107,NaHCO3和NH4Cl的溶解度曲线如图所示。请分析NaHCO3结晶析出而NH4Cl没有结晶析出的原因是。 (4)、上述流程图中没有涉及的基本反应类型是。19. 某工厂产生的烧渣(主要含FeO、Fe2O3 , 还有一定量的SiO2)可用于制备七水合硫酸亚铁晶体(FeSO4 ·7H2O),其工艺流程如下:
(4)、上述流程图中没有涉及的基本反应类型是。19. 某工厂产生的烧渣(主要含FeO、Fe2O3 , 还有一定量的SiO2)可用于制备七水合硫酸亚铁晶体(FeSO4 ·7H2O),其工艺流程如下:
查阅资料:SiO2不溶于水,也不与稀硫酸反应。
(1)、“浸取”步骤中,FeO、Fe2O3和稀硫酸发生反应的化学方程式分别为FeO+H2SO4=FeSO4+ H2O 、。
(2)、为提高“浸取”步骤的反应速率,可采取的具体措施有(写2条,不考虑“搅拌”和 “使用催化剂”)。(3)、“还原”步骤的日的是将Fe抖转化为Fe2+ , 试剂X可用SO2或Fe。①若试剂X是SO2 , 转化原理为SO2+Fe2 (SO4)3+2Y =2FeSO4+2H2SO4 , 则Y的化学式是。
②若试剂X是Fe,转化原理为Fe+Fe2 (SO4)3=3FeSO4。测得“还原”后溶液的pH明显增大,其原因是 。
20. 已知某固体混合物A中可能含有CuSO4、FeCl3、NaNO3、 BaCl2、CaCO3五种物质中的两种或多种。按下述步骤进行实验探究,观察实验现象,并加以分析推理(设过程中所有发生的反应都恰好完全反应)。I.取一定质量的该固体混合物A放入一洁净烧杯中,向其中加入适量NaOH溶液,搅拌,待烧杯中物质充分反应后,过滤,得红褐色沉淀B和滤液C。
Ⅱ.另取一定质量的该固体混合物A放入另一洁净烧杯中,向其中加入适量H2SO4溶液,搅拌,待烧杯中物质充分反应后,过滤,得白色沉淀D和滤液E。
III.将所得滤液C和滤液E充分混合,再向混合后的溶液中加入适量AgNO3溶液,待充分反应后,过滤,得白色沉淀F和滤液G。
Ⅳ.根据上述实验过程和发生的现象做出相应推理,填写以下空白:
(1)、在固体混合物A里,上述五种物质中肯定存在的物质是(写化学式)(2)、写出步骤III中生成白色沉淀F的1个化学方程式(3)、在滤液G中,含有的金属阳离子共有一种,该滤液中肯定存在的酸根离子 。(4)、在混合物A里,上述五种物质中肯定不存在的物质是(写化学式) 。得出此结论的理由是 。21. 某小组利用如图装置制备CO2 , 并模拟自然界中CO2的循环。回答下列问题。 (1)、装置A中仪器①的名称是。(2)、实验室用稀盐酸和石灰石制取CO2 , 反应的化学方程式为 , 发生装置是(填字母序号)。(3)、为制得CO2的水溶液,CO2应从装置C的(填“m”或“n”)端通入。(4)、将CO2的水溶液转移至烧杯,并组装装置如图D所示,置于阳光下一段时间,观察到有气泡产生,检验该气体的方法是。(5)、若用装置B制取O2 , 检查装置气密性的操作是。(6)、某同学在学习氮肥时。查阅资料:
(1)、装置A中仪器①的名称是。(2)、实验室用稀盐酸和石灰石制取CO2 , 反应的化学方程式为 , 发生装置是(填字母序号)。(3)、为制得CO2的水溶液,CO2应从装置C的(填“m”或“n”)端通入。(4)、将CO2的水溶液转移至烧杯,并组装装置如图D所示,置于阳光下一段时间,观察到有气泡产生,检验该气体的方法是。(5)、若用装置B制取O2 , 检查装置气密性的操作是。(6)、某同学在学习氮肥时。查阅资料:①氨气极易溶于水,其水溶液称为氨水;②氨水在浓度大或受热时易分解放出氨气。
实验室用生石灰和浓氨水能快速制取氨气的原因是;制得的氨气(填“能”或“不能”)用装置C收集。
22. 某兴趣小组探究酸的化学性质做了如下图所示的实验。实验结束后,将两只试管中的物质全部倒入一个洁净的烧杯中。据图回答。 (1)、在上图所示的实验中,试管①中发生反应的化学方程式是。(2)、烧杯中的物质充分反应后,仅观察到有白色沉淀,无其他现象。则试管②反应后的溶液中的溶质共有哪些(写化学式)。(3)、将烧杯内的物质进行过滤,对所得滤液中溶质成分进行了如下探究:
(1)、在上图所示的实验中,试管①中发生反应的化学方程式是。(2)、烧杯中的物质充分反应后,仅观察到有白色沉淀,无其他现象。则试管②反应后的溶液中的溶质共有哪些(写化学式)。(3)、将烧杯内的物质进行过滤,对所得滤液中溶质成分进行了如下探究:实验操作
实验现象
实验结论
步骤1:取少量滤液于试管中,向其中滴加足量硝酸钡溶液
有白色沉淀生成
①生成的白色沉淀是(写化学式,下同)
②滤液中的溶质共有哪些
步骤2:静置,向上层清夜中滴加无色酚酞试液
溶液变红
(4)、在上述实验(3)的探究中,步骤1中加入足量硝酸钡溶液的目的是。23. 铁和铁的化合物在工农业生产中有广泛的应用。为了探究铁的冶炼原理,小组同学取24.0gFe2O3粉末,用如图装置模拟炼铁,并测定反应后固体成分。
资料:碱石灰的主要成分是氢氧化钠和氧化钙,可吸收H2O和CO2。
(1)、连接装置,先 , 再装入药品。(2)、实验时先通入CO,目的是。(3)、①控制A中温度在700℃至固体全部变黑,继续通CO至冷却。目的是除了防止生成的Fe被氧化外还有。②通过测定装置B中固体的质量变化,可准确求得装置A中剩余固体质量。装置C的作用是。
③现直接测得装置A中剩余固体质量为19.2g。则装置B中固体应增重g。
(4)、经分析A中剩余固体19.2g为Fe和FexOy的混合物,向其中加入足量的稀H2SO4充分反应,得H2 0.3g。①固体中Fe质量为g。
②FexOy的化学式为。
24. 小明取酸性锌锰干电池进行探究,他发现电池内部结构如图1所示。
【资料】
①锌皮为金属锌(含有少量的铁)
②黑色糊状填充物由炭黑、MnO2、ZnCl2和NH4Cl等组成(3)有关数据见下表
温度/℃
0
20
40
60
80
100
溶解度/g
NH4Cl
29.3
37.2
45.8
55.3
65.6
77.3
ZnCl2
343
395
452
488
541
614
【实验探究一】小明取适量黑色糊状填充物,按图2所示实验流程进行探究。
(1)、溶液A中溶质主要有(填化学式),操作Ⅱ中采用冷却热饱和溶液的方法实现两者分离的依据是。(2)、欲从固体M中得到较纯的MnO2 , 操作Ⅲ可采用的简便方法是。(3)、【实验探究二】小明取电池外壳锌皮,用砂纸打磨干净,剪成小块,进行实验。取一块锌皮放入盛有适量稀盐酸的烧杯中,有ZnCl2生成。
①实验中可观察到的现象是。
②下列各组物质混合后,也能生成ZnCl2的有(填字母序号)。
A.ZnO与稀盐酸
B.ZnSO4溶液与BaCl2溶液
C.ZnCO3与NaCl溶液
D.Zn(NO3)2溶液与NH4Cl溶液
(4)、另取一块锌皮放入盛有一定量CuSO4溶液的烧杯中,充分反应后得到溶液E和固体F。当溶液E中只含一种溶质时,该溶质是(填化学式);当固体F中只含一种物质时,溶液E中最少含有种溶质。五、计算题
-
25. 二氯异氰脲酸钠(C3O3N3Cl2Na)是一种预防H7N9禽流感的有效消毒剂。右图为某工厂生产的二氯异氰脲酸钠产品的标签。
 (1)、25℃时,饱和二氯异氰脲酸钠溶液的溶质质量分数为。(2)、请计算分析,标签中“有效氯(Cl%)≥60%”是否为C3O3N3Cl2Na中氯元素的质量分数。(写出计算过程)26. 某同学在实验室用石灰石(杂质不溶于水也不与稀盐酸反应)与稀盐酸反应制取二氧化碳,为测定所得废液中各成分的组成,进行了如下实验:取100g废液,向其中不断滴入碳酸钠溶液,所得数据及图示如下:
(1)、25℃时,饱和二氯异氰脲酸钠溶液的溶质质量分数为。(2)、请计算分析,标签中“有效氯(Cl%)≥60%”是否为C3O3N3Cl2Na中氯元素的质量分数。(写出计算过程)26. 某同学在实验室用石灰石(杂质不溶于水也不与稀盐酸反应)与稀盐酸反应制取二氧化碳,为测定所得废液中各成分的组成,进行了如下实验:取100g废液,向其中不断滴入碳酸钠溶液,所得数据及图示如下: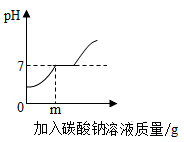
加入酸钠溶液质量/g
53
106
159
212
265
300
生成沉淀质量/g
0
0
10
n
30
30
(1)、m的值是 , n的值是。(2)、100g该废液中的溶质中各成分的质量是多少?