初中科学浙教版第2章 第3节 原子结构的模型同步练习
试卷更新日期:2023-03-01 类型:同步测试
一、单选题
-
1. 二氧化硫、氧化汞、氧气中都含有( )A、氧气 B、氧原子 C、氧分子 D、氧元素2. 臭氧(O3)、二氧化氯(ClO2)、过氧化氢(H2O2)溶液等都是生产、生活中常用的消毒剂,三种物质中都含有( )A、氧分子 B、氧离子 C、氧气 D、氧元素3. 日本福岛核泄漏成分中有碘-131和铯-137等。碘与铯的本质区别是( )A、质子数不同 B、中子数不同 C、最外层电子数不同 D、原子核外电子层数不同4. 著名科学家居里夫人首先发现某些原子具有放射性,即原子能自动地放射出一些固定的粒子,一种元素的原子经过放射变成另一种元素的原子。据此推测,放射出来的粒子可能是 ( )A、电子 B、中子 C、质子 D、原子核5. 最接近原子实际结构的模型是 ( )A、分层模型 B、电子云模型 C、汤姆生模型 D、卢瑟福模型6. 鈈(xi)元素是首个由亚洲科学家发现的新元素。鈈原子的相对原子质量为286,核外电子数为113,则质子数为( )A、286 B、113 C、173 D、3997. 下列所描述的粒子与氧原子一致的是( )A、该粒子有8个质子,9个中子,10个电子 B、该粒子有9个质子,8个中子,10个电子 C、该粒子有8个质子,10个中子,8个电子 D、该粒子有9个质子,10个中子,8个电子8. 小柯学习科学知识时很懂得联想和类比。他想,书本上说卢瑟福研究发现的原子结构模型叫太阳系模型,如果把八大行星看作是原子中的八个核外电子的话,那么( )A、“太阳”相当于一个原子 B、“太阳”中肯定有八个中子 C、“太阳”中肯定有八个质子 D、“太阳系”相当于一个碳原子9. 推理是研究和学习科学的一种重要方法。正电子、负质子都是反粒子,它们跟通常所说的电子、质子相比较,质量相等,电性相反。科学家已发现反氢原子。你推测反氢原子的结构可能是( )A、由1个带负电荷的质子和1个带正电荷的电子构成 B、由1个质子和1个电子构成 C、由1个带负电荷的质子和1个电子构成 D、由1个质子和1个带正电荷的电子构成10. 1911年卢瑟福团队用一束α粒子(带正电荷)轰击金箔时发生了如图所示的实验现象。由实验得出的结论不合理的是( )
 A、 多数α粒子直接穿过,说明原子核外是空的,不存在其他粒子 B、少数α粒子发生偏移,说明原子核带正电 C、极少数α粒子被反弹,说明原子核体积很小、质量相对较大 D、α粒子的质量比核外电子的质量大得多11. 据科学家推测,月球的土壤中吸附着数百万吨的3He,每一百吨3He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以4He的形式存在。下列说法中正确的是( )A、4He原子核内含有4个质子 B、3He和4He互为同位素 C、3He原子核内含有3个中子 D、4He和3He是同种元素的同种原子12. 用“
A、 多数α粒子直接穿过,说明原子核外是空的,不存在其他粒子 B、少数α粒子发生偏移,说明原子核带正电 C、极少数α粒子被反弹,说明原子核体积很小、质量相对较大 D、α粒子的质量比核外电子的质量大得多11. 据科学家推测,月球的土壤中吸附着数百万吨的3He,每一百吨3He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以4He的形式存在。下列说法中正确的是( )A、4He原子核内含有4个质子 B、3He和4He互为同位素 C、3He原子核内含有3个中子 D、4He和3He是同种元素的同种原子12. 用“ ”“
”“ ”“”分别表示质子、中子和电子,下图表示四种原子的结构模型。下列有关说法中正确的是 ( )
”“”分别表示质子、中子和电子,下图表示四种原子的结构模型。下列有关说法中正确的是 ( )  A、甲、丁互为同位素 B、乙、丁属于同一种元素 C、甲、丙的核电荷数不同 D、甲、丙为同一种原子13. 目前普遍认为,质子和中子都是由被称为u夸克和d夸克的两类夸克构成的。u夸克带电量为+e,d夸克带电量为-e,e为基元电荷。下列论断可能正确的是( )A、质子由1个u夸克和1个d夸克构成,中子由1个u夸克和2个d夸克构成 B、质子由1个u夸克和1个d夸克构成,中子由2个u夸克和1个d夸克构成 C、质子由2个u夸克和1个d夸克构成,中子由1个u夸克和2个d夸克构成 D、质子由2个u夸克和1个d夸克构成,中子由1个u夸克和1个d夸克构成14. 碳—14是碳的一种具放射性的同位素原子,其相对原子质量为14。如图为碳—14原子的结构示意图,由图可知碳—14原子( )
A、甲、丁互为同位素 B、乙、丁属于同一种元素 C、甲、丙的核电荷数不同 D、甲、丙为同一种原子13. 目前普遍认为,质子和中子都是由被称为u夸克和d夸克的两类夸克构成的。u夸克带电量为+e,d夸克带电量为-e,e为基元电荷。下列论断可能正确的是( )A、质子由1个u夸克和1个d夸克构成,中子由1个u夸克和2个d夸克构成 B、质子由1个u夸克和1个d夸克构成,中子由2个u夸克和1个d夸克构成 C、质子由2个u夸克和1个d夸克构成,中子由1个u夸克和2个d夸克构成 D、质子由2个u夸克和1个d夸克构成,中子由1个u夸克和1个d夸克构成14. 碳—14是碳的一种具放射性的同位素原子,其相对原子质量为14。如图为碳—14原子的结构示意图,由图可知碳—14原子( )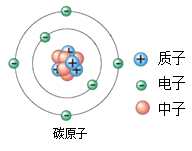 A、含有14个质子 B、含有6个中子 C、核电荷数为6 D、质子数和中子数相等15. 道尔顿的原子学说曾经起到了很大作用。他的学说中,包含下述三个论点:①原子是不能再分的粒子;②同种元素的原子各种性质和质量都相同;③原子是微小的实心球体。从现在的观点看,你认为这三个论点中不确切的是( )A、只有③ B、只有①③ C、只有②③ D、①②③16. 考古人员使用碳-14年代检测法印证了三星堆遗址属于商代晚期。碳-14原子与碳-12原子不同的是( )A、核电荷数 B、质子数 C、核外电子数 D、中子数17. 化学上常用符号“ZAX”表示原子的组成,其中X代表元素符号,Z表示原子核内的质子数,A表示原子核内质子数与中子数之和。已知 abXn+和 cdYm﹣的电子层排布完全相同,则下列关系正确的是( )A、b-a=d-c B、a+n=c-m C、a-n=c+m D、b-n=d+m18. 用激光打印机打印材料时,经常能闻到一股特殊的气味,这就是臭氧(O3)的气味。氧气在放电条件下可以转化为臭氧。下列与此相关的说法正确的是( )A、氧气变成臭氧的过程肯定没有发生物理变化 B、氧气与臭氧互为同位素 C、臭氧分子由一个氧分子和一个氧原子构成 D、氧气、臭氧是两种不同单质
A、含有14个质子 B、含有6个中子 C、核电荷数为6 D、质子数和中子数相等15. 道尔顿的原子学说曾经起到了很大作用。他的学说中,包含下述三个论点:①原子是不能再分的粒子;②同种元素的原子各种性质和质量都相同;③原子是微小的实心球体。从现在的观点看,你认为这三个论点中不确切的是( )A、只有③ B、只有①③ C、只有②③ D、①②③16. 考古人员使用碳-14年代检测法印证了三星堆遗址属于商代晚期。碳-14原子与碳-12原子不同的是( )A、核电荷数 B、质子数 C、核外电子数 D、中子数17. 化学上常用符号“ZAX”表示原子的组成,其中X代表元素符号,Z表示原子核内的质子数,A表示原子核内质子数与中子数之和。已知 abXn+和 cdYm﹣的电子层排布完全相同,则下列关系正确的是( )A、b-a=d-c B、a+n=c-m C、a-n=c+m D、b-n=d+m18. 用激光打印机打印材料时,经常能闻到一股特殊的气味,这就是臭氧(O3)的气味。氧气在放电条件下可以转化为臭氧。下列与此相关的说法正确的是( )A、氧气变成臭氧的过程肯定没有发生物理变化 B、氧气与臭氧互为同位素 C、臭氧分子由一个氧分子和一个氧原子构成 D、氧气、臭氧是两种不同单质二、填空题
-
19. 某原子A的质子数为a,若B3+和A2-具有相同的核外电子数,则B元素的质子数。20. 人类对原子结构的认识经历了一个相当长的时期,一代代科学家不断地发现和提出新的原子结构模型。(1)、以下是科学家及其提出的原子结构假设模型(如图所示),其中符合原子结构模型建立先后顺序的是。
 (2)、1919年科学家卢瑟福用氢原子核轰击氮原子核,结果得到氧、氢两种原子。某学生说:”这是一种生成新物质的变化——化学变化,元素可以通过化学反应来制取。”小柯认为这位学生的说法不正确,其理由是。(3)、2022年4月26日,我国首次国产化碳-14批量生产在中核集团秦山核电站启动。下列模型能表示碳-14 (有6个质子,8个中子)原子结构的是( )A、
(2)、1919年科学家卢瑟福用氢原子核轰击氮原子核,结果得到氧、氢两种原子。某学生说:”这是一种生成新物质的变化——化学变化,元素可以通过化学反应来制取。”小柯认为这位学生的说法不正确,其理由是。(3)、2022年4月26日,我国首次国产化碳-14批量生产在中核集团秦山核电站启动。下列模型能表示碳-14 (有6个质子,8个中子)原子结构的是( )A、 B、
B、 C、
C、 D、
D、 21. 嫦娥五号带回的月球土壤中含有较丰富的氦-3,而在地球上氦元素主要以氦-4的形式存在,如图是它们的原子结构示意图,
21. 嫦娥五号带回的月球土壤中含有较丰富的氦-3,而在地球上氦元素主要以氦-4的形式存在,如图是它们的原子结构示意图, 表示原子中的不同微粒。请回答:
表示原子中的不同微粒。请回答:
 (1)、氦-3、氦-4属于同种 , 两者互为同位素;(2)、“O” 表示原子中的(填“质子”“中子”或“电子”)。22. 下表是小明收集的一些微粒的资料,请根据表格数据,回答下列问题。
(1)、氦-3、氦-4属于同种 , 两者互为同位素;(2)、“O” 表示原子中的(填“质子”“中子”或“电子”)。22. 下表是小明收集的一些微粒的资料,请根据表格数据,回答下列问题。粒子名称
质子数
中子数
电子数
A
14
14
14
B
26
30
24
C
14
14
18
D
14
18
14
(1)、表中的元素共有种。(2)、属于阳离子的是(填字母)。(3)、与A互为同位素原子的是。23. 2020年10月,关于日本政府欲将核废水排入太平洋的事曾在全球闹得沸沸扬扬。核废水中131I(碘-131)的相关报道成为热门话题。请回答下列问题:(1)、131I原子中含有53个质子,78个中子。131I原子的核外电子数是。(2)、自然界中普遍存在的另一种碘原子127I,它和131I同属于碘元素。127I原子的质子数为。
24. 阅读以下两则信息,回答相关问题:(1)、氟利昂曾经是一种很好的制冷剂,自1987 年国际规定禁止使用,因为氟利昂会破坏臭氧(O3)层,O3和O2的化学性质不同的原因是 。(2)、自然界中含氮化合物中常见的氮元素为14N, 某位研究者用同位素示踪法做了一个实验,给绿色植物使用具有放射性15N的氮肥,人吃了这些食物,最终在人尿中检测出15N,那么14N和15N两种原子的本质区别为。25. 元素的阳离子结构示意图为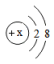 , 元素的阴离子比多8个电子,与形成的化合物为 , 与形成的化含物的化分式为 , 请回答: , 26. 在分子、原子、质子、中子、电子、原子核这些微粒中:(1)、能保持物质化学性质的微粒有。(2)、显示电中性的微粒有。(3)、带正电的微粒有。(4)、质量最小的微粒是。(5)、在同一原子里数目相等的是。
, 元素的阴离子比多8个电子,与形成的化合物为 , 与形成的化含物的化分式为 , 请回答: , 26. 在分子、原子、质子、中子、电子、原子核这些微粒中:(1)、能保持物质化学性质的微粒有。(2)、显示电中性的微粒有。(3)、带正电的微粒有。(4)、质量最小的微粒是。(5)、在同一原子里数目相等的是。三、实验探究题
-
27. 如表是几种原子的构成情况,三位同学认真思考后,提出了各自的观点。
原子种类
质子数
中子数
核外电子数
相对原子质量
氢
1
0
1
1
碳
6
6
6
12
氧
8
8
8
16
钠
11
12
11
23
镁
12
12
12
24
小光:原子里质子数等于核外电子数。
小红:相对原子质量=质子数十中子数。
小伟:原子都是由质子、中子和核外电子构成的。
老师听了三位同学提出的观点后说:“大家总结得非常好,都开动了脑筋,体现了良好的求知态度。
但有一位同学的结论不准确,需要加以修正,而且表中还隐藏着其他的一些结论。
请你认真分析三位同学的观点,并对照上表回答下列问题。
(1)、三位同学的结论中,不准确的是的观点,理由是。(2)、从表中你还能得出的结论有(至少写出两条)。28. 探究原子结构的奥秘。[情境提供]19世纪以前,人们一直以为原子是不可分的,直到1897年,汤姆生发现了带负电的电子后,才引起人们对原子结构模型的探索。
[提出问题]电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?
[进行实验]1911年英国科学家卢瑟福进行了著名的a粒子轰击金属箔的实验。如图所示:
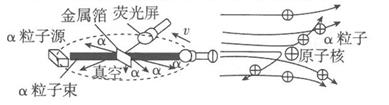
①放射源——放射性物质放出 a粒子(带正电荷),质量是电子质量的7 000倍;
②金属箔——作为靶子,厚度 1 μm,重叠了3 000层左右的原子;
③荧光屏——α粒子打在上面发出闪光;
④显微镜——通过显微镜观察闪光,且通过360度转动可观察不同角度α粒子的到达情况。
[收集证据]绝大多数α粒子穿过金属箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大角度的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达180°,像是被金属箔弹了回来。
[猜想与假设] α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构。上,否则大角度的散射是不可能的。
[解释与结论]
(1)、若原子质量、正电荷在原子内均匀分布,则极少数α粒子就(填“会”或“不 会”)发生大角度散射。卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是 。(2)、科学家对原子结构的探究经历了三个过程,通过α粒子散射实验,你认为原子结构为 (填字母)。A、 道尔顿模型特点:不可再分的实心球体
B、
道尔顿模型特点:不可再分的实心球体
B、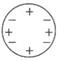 汤姆生模型特点:正负电荷均匀分布
C、
汤姆生模型特点:正负电荷均匀分布
C、 卢瑟福模型特点:核位于原子中心,质量集中在核上
29. 碘是一种由碘分子构成的物质。小明同学利用碘进行如下实验:①把少量的固体碘放在湿润的馒头上,发现馒头会变成蓝色;②再取少量的碘溶解在酒精中,取少量碘酒滴在馒头上,发现馒头也会变蓝色。请回答以下问题。
卢瑟福模型特点:核位于原子中心,质量集中在核上
29. 碘是一种由碘分子构成的物质。小明同学利用碘进行如下实验:①把少量的固体碘放在湿润的馒头上,发现馒头会变成蓝色;②再取少量的碘溶解在酒精中,取少量碘酒滴在馒头上,发现馒头也会变蓝色。请回答以下问题。
(1)、如果取少量的碘放入烧杯中,用酒精灯加热,碘升华成碘蒸气,把湿润的馒头放在碘蒸气中,馒头会有什么变化,请预测实验现象为 , 并阐述理由。(2)、现在市场上买来的食盐大多是加碘盐,将少量食盐水滴在馒头上,馒头不变蓝。那么加碘盐中的“碘”是指 。A、碘单质 B、碘元素 C、碘原子 D、碘分子四、解答题
-
30. 德国科学家埃特尔对一氧化碳在金属铂表面催化下的氧化反应的研究,催生了汽车尾气净化装置,实现了汽车尾气中一氧化碳的清洁排放。
 (1)、 和 是铂元素的两种同位素原子,则这两种原子的中子个数相差个 。(2)、下图是汽车尾气净化装置里,一氧化碳和二氧化氮在金属铂表面催化下反应的微粒变化过程,则其先后顺序为。(用图中的序号排列)31. H、 H、 H分别表示氢元素的三种原子,其上、下标的意义如图所示。 H、 H、 H可简写成1H、2H、3H。
(1)、 和 是铂元素的两种同位素原子,则这两种原子的中子个数相差个 。(2)、下图是汽车尾气净化装置里,一氧化碳和二氧化氮在金属铂表面催化下反应的微粒变化过程,则其先后顺序为。(用图中的序号排列)31. H、 H、 H分别表示氢元素的三种原子,其上、下标的意义如图所示。 H、 H、 H可简写成1H、2H、3H。 (1)、1H、2H、3H三种原子中,数目不等(选填“质子”或“中子”或“电子”);(2)、相同分子数的2H2和3H2分别与足量O2反应全部转化成H2O,生成的质量前者(选填“大于”或“等于"或“小于”)后者。
(1)、1H、2H、3H三种原子中,数目不等(选填“质子”或“中子”或“电子”);(2)、相同分子数的2H2和3H2分别与足量O2反应全部转化成H2O,生成的质量前者(选填“大于”或“等于"或“小于”)后者。