山东省泰安肥城市2021-2022学年高一下学期期中考试化学试题
试卷更新日期:2023-02-22 类型:期中考试
一、单选题
-
1. 2016年IUPAC命名117号元素为Ts(中文名“
 ”,tián),Ts的原子核外最外层电子数是7,下列说法错误的是 A、Ts是第七周期第ⅦA族元素 B、Ts的同位素原子具有相同的电子数 C、Ts在同族元素中非金属性最弱 D、中子数为176的Ts核素符号是Ts2. 下列有关化学用语表达错误的是A、NaCl的形成过程:
”,tián),Ts的原子核外最外层电子数是7,下列说法错误的是 A、Ts是第七周期第ⅦA族元素 B、Ts的同位素原子具有相同的电子数 C、Ts在同族元素中非金属性最弱 D、中子数为176的Ts核素符号是Ts2. 下列有关化学用语表达错误的是A、NaCl的形成过程: B、Na与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑
C、Na的原子结构示意图:
B、Na与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑
C、Na的原子结构示意图: D、钙离子的电子式:Ca2+
3. 已知可逆反应2NO2(g)
D、钙离子的电子式:Ca2+
3. 已知可逆反应2NO2(g) 2NO(g)+O2(g),在恒压密闭容器中充入NO2 , 该反应达到化学平衡状态的标志是( ) A、反应停止了 B、NO的正反应速率与O2的逆反应速率相等 C、c(NO):c(O2)=2:1 D、混合气体的颜色不再变化4. 下列说法中错误的是A、钠的金属性比镁强 B、溴元素的非金属性比氯元素的弱 C、硝酸的酸性比磷酸弱 D、气态氢化物的热稳定性:H2S<HCl5. 某同学运用元素周期表和周期律相关知识,推测铍及其化合物的性质:( )
2NO(g)+O2(g),在恒压密闭容器中充入NO2 , 该反应达到化学平衡状态的标志是( ) A、反应停止了 B、NO的正反应速率与O2的逆反应速率相等 C、c(NO):c(O2)=2:1 D、混合气体的颜色不再变化4. 下列说法中错误的是A、钠的金属性比镁强 B、溴元素的非金属性比氯元素的弱 C、硝酸的酸性比磷酸弱 D、气态氢化物的热稳定性:H2S<HCl5. 某同学运用元素周期表和周期律相关知识,推测铍及其化合物的性质:( )①原子半径大于硼 ②与酸反应时比锂剧烈 ③氢氧化铍的碱性比氢氧化钙弱 ④单质铍与冷水剧烈反应。其中正确的是
A、①②③④ B、①②③ C、①③ D、②④6. 已知某反应中能量变化如图所示,所得结论正确的是 A、该图象可以表示盐酸与镁反应的能量变化 B、该图象可以表示NaHCO3与柠檬酸反应的能量变化 C、该反应过程中,形成新化学键释放的总能量大于断裂旧化学键吸收的总能量 D、因为生成物的总能量高于反应物的总能量,所以该反应一定需要加热才可进行7. 盐酸与块状CaCO3反应时,不能使反应最初的速率明显加快的是A、将盐酸的用量增加一倍 B、盐酸的浓度增加一倍,用量减半 C、温度升高30 ℃ D、将块状CaCO3粉碎后再与盐酸反应8. 在盛有稀硫酸的烧杯中放入用导线连接的铁片和铜片,下列叙述中正确的是A、铜片上有H2逸出 B、电子通过导线由铜片流向铁片 C、溶液中的H+向铁片附近定向迁移 D、铁片发生的反应是Fe-3e-=Fe3+9. 对于二氧化硫与氧气化合生成三氧化硫的反应,下列说法中错误的是A、降低温度会使反应速率减小 B、使用合适的催化剂能使反应速率增大 C、达到平衡状态时,仍有SO2与O2反应生成SO3 D、增大压强会使SO2完全转化为SO310. 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(字母①~⑩为前36号元素)。对比中学常见元素周期表,思考扇形元素周期表的填充规律,下列说法中正确的是
A、该图象可以表示盐酸与镁反应的能量变化 B、该图象可以表示NaHCO3与柠檬酸反应的能量变化 C、该反应过程中,形成新化学键释放的总能量大于断裂旧化学键吸收的总能量 D、因为生成物的总能量高于反应物的总能量,所以该反应一定需要加热才可进行7. 盐酸与块状CaCO3反应时,不能使反应最初的速率明显加快的是A、将盐酸的用量增加一倍 B、盐酸的浓度增加一倍,用量减半 C、温度升高30 ℃ D、将块状CaCO3粉碎后再与盐酸反应8. 在盛有稀硫酸的烧杯中放入用导线连接的铁片和铜片,下列叙述中正确的是A、铜片上有H2逸出 B、电子通过导线由铜片流向铁片 C、溶液中的H+向铁片附近定向迁移 D、铁片发生的反应是Fe-3e-=Fe3+9. 对于二氧化硫与氧气化合生成三氧化硫的反应,下列说法中错误的是A、降低温度会使反应速率减小 B、使用合适的催化剂能使反应速率增大 C、达到平衡状态时,仍有SO2与O2反应生成SO3 D、增大压强会使SO2完全转化为SO310. 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(字母①~⑩为前36号元素)。对比中学常见元素周期表,思考扇形元素周期表的填充规律,下列说法中正确的是 A、②⑧⑨对应简单离子的半径依次减小 B、⑥的金属性比⑦的弱 C、元素⑩位于常见元素周期表第四周期VIII族 D、①分别与③④⑤形成的简单化合物热稳定性依次减弱11. 汽车安全气囊内的气体发生剂主要是叠氮化钠(NaN3)、Fe2O3等物质。下列说法错误的是A、强烈碰撞时,NaN3受热分解产生N2和Na的化学方程式是2NaN32Na+3N2↑ B、叠氮化钠中含有离子键和共价键 C、N2的电子式为
A、②⑧⑨对应简单离子的半径依次减小 B、⑥的金属性比⑦的弱 C、元素⑩位于常见元素周期表第四周期VIII族 D、①分别与③④⑤形成的简单化合物热稳定性依次减弱11. 汽车安全气囊内的气体发生剂主要是叠氮化钠(NaN3)、Fe2O3等物质。下列说法错误的是A、强烈碰撞时,NaN3受热分解产生N2和Na的化学方程式是2NaN32Na+3N2↑ B、叠氮化钠中含有离子键和共价键 C、N2的电子式为 D、Fe2O3中O元素位于周期表VIA族、Fe元素属于VIIB族
12. 2020 年上海进博会展览中,诸多氢能源汽车纷纷亮相。氢燃料电池被誉为氢能源汽车的心脏。某种氢燃料电池的内部结构如图,下列说法正确的是
D、Fe2O3中O元素位于周期表VIA族、Fe元素属于VIIB族
12. 2020 年上海进博会展览中,诸多氢能源汽车纷纷亮相。氢燃料电池被誉为氢能源汽车的心脏。某种氢燃料电池的内部结构如图,下列说法正确的是
 A、电池每消耗 11.2 L氢气,电路中通过的电子数目为NA B、a 处通入的是氧气 C、右侧电极发生的反应为:O2+4e-+4H+=2H2O D、右侧电极为电池的负极
A、电池每消耗 11.2 L氢气,电路中通过的电子数目为NA B、a 处通入的是氧气 C、右侧电极发生的反应为:O2+4e-+4H+=2H2O D、右侧电极为电池的负极二、多选题
-
13. 下列图中的实验方案,不做达到实验目的的是
A
B
C
D
实验方案




实验目的
验证化学能可以转化成电能
萃取分液
验证非金属性:Cl>C>Si
用洁净的铂丝蘸取待测液,在酒精灯火焰上灼烧,直接观察火焰呈黄色,原溶液无钾离子
A、A B、B C、C D、D14. X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X有三种核素且质量数比为1∶2∶3,且它与其它四种元素不在同一周期;X与Z元素在同一主族;W的次外层电子数是最外层电子数的4倍,且W原子核外电子总数是Y的2倍;R元素在同周期中原子得电子能力最强。下列说法正确的是( )A、Y元素在周期表中位置是第二周期ⅣA族 B、原子的失去电子能力是W>Z C、ZX中含有离子键,WR2中含有共价键 D、R单质与溴化钠溶液反应的离子方程式为Cl2+2Br-=2Cl-+Br215. 研究表明,在一定条件下,气态HCN(a)与HNC(b)两种分子的互变反应过程能量变化如图所示。下列说法错误的是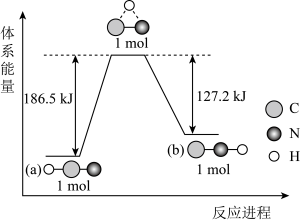 A、HCN比HNC更稳定 B、HCN(g)→HNC(g)为吸热反应且反应条件一定要加热 C、1 mol HCN(g)中的所有化学键全部断开需要吸收186.5 kJ的热量 D、1 mol HCN(g)转化为1mol HNC(g)需要吸收59.3 kJ的热量
A、HCN比HNC更稳定 B、HCN(g)→HNC(g)为吸热反应且反应条件一定要加热 C、1 mol HCN(g)中的所有化学键全部断开需要吸收186.5 kJ的热量 D、1 mol HCN(g)转化为1mol HNC(g)需要吸收59.3 kJ的热量三、综合题
-
16. 能源是现代文明的原动力,化学电池在生产生活中有着广泛的应用。(1)、根据构成原电池的本质判断,下列反应可以设计成原电池的是____(填序号)。A、C(s)+H2O(g) =CO(g)+H2(g) B、NaOH(aq)+HCl(aq) =NaCl(aq)+H2O(l) C、2CO(g)+O2=2CO2(l)(2)、为了探究化学反应中的能量变化,某同学设计了如图所示两个实验。有关实验现象,下列说法正确的是____(填序号)。
 A、图I和图II的气泡均产生于锌棒表面 B、图II中产生气体的速率比图I快 C、图I中温度计的示数高于图II的示数 D、图I和图II中温度计的示数相等,且均高于室温(3)、图II中外电路中的电子是从(填“Zn”或“Cu”)电极经导线流向电极,H+向(填“Zn”或“Cu”)移动。若反应过程中有0.2 mol电子发生转移,则生成的氢气在标准状况下的体积为。若电池的总反应为2Fe3++Cu=2Fe2++Cu2+ , 则负极材料是(填化学式)。(4)、知识源于实践。学习原电池知识后,某学习小组以Zn和Cu为电极材料,制作了如图所示的水果电池(水果果汁中含游离的H+)。该组电池放电时,下列说法正确的是____(填序号)。
A、图I和图II的气泡均产生于锌棒表面 B、图II中产生气体的速率比图I快 C、图I中温度计的示数高于图II的示数 D、图I和图II中温度计的示数相等,且均高于室温(3)、图II中外电路中的电子是从(填“Zn”或“Cu”)电极经导线流向电极,H+向(填“Zn”或“Cu”)移动。若反应过程中有0.2 mol电子发生转移,则生成的氢气在标准状况下的体积为。若电池的总反应为2Fe3++Cu=2Fe2++Cu2+ , 则负极材料是(填化学式)。(4)、知识源于实践。学习原电池知识后,某学习小组以Zn和Cu为电极材料,制作了如图所示的水果电池(水果果汁中含游离的H+)。该组电池放电时,下列说法正确的是____(填序号)。 A、每个水果果汁中的H+移向正极 B、锌a、b发生的电极反应式为2H++2e-=H2↑ C、四个水果电池串联,则电极d为铜片 D、铜a为电池正极,发生氧化反应17. 元素周期律(表)是认识元素化合物性质的重要理论。随着原子序数的递增, 8种短周期元素(用字母表示)原子半径的相对大小、最高正化合价或最低负化合价的变化如下图所示。
A、每个水果果汁中的H+移向正极 B、锌a、b发生的电极反应式为2H++2e-=H2↑ C、四个水果电池串联,则电极d为铜片 D、铜a为电池正极,发生氧化反应17. 元素周期律(表)是认识元素化合物性质的重要理论。随着原子序数的递增, 8种短周期元素(用字母表示)原子半径的相对大小、最高正化合价或最低负化合价的变化如下图所示。
已知:x为非金属元素,d元素原子的最外层电子数为内层电子数的3倍。
(1)、x、e、d三种元素形成的离子化合物的电子式为。化合物yd2中化学键类型有(填“离子键”或“共价键”),请写出该化合物与e2d2反应的化学方程式。(2)、f元素形成的最高价氧化物对应水化物与溶液反应的离子方程式为。(3)、d、e简单离子的半径较大的是(用化学式表示,下同);y、z的最高价氧化物的水化物的酸性较弱的是;d、g的单质分别与x的单质化合时,较容易的是 , 形成的化合物热稳定性较差的是。
18. 回答下列问题:(1)、I、一定条件下,在2 L密闭容器中发生反应:3A(g)+B(g) 2C(g)。开始时加入4 mol A、6 mol B、2 mol C,在2 min末测得C的物质的量是3 mol。用A的浓度变化表示反应的平均速率:。
(2)、在2 min末B的浓度为。(3)、若改变下列一个条件,推测该反应的速率发生的变化 (填“增大”“减小”或“不变”)。①升高温度,化学反应速率;
②充入1 mol B,化学反应速率;
③将容器的体积变为3 L,化学反应速率。
(4)、在一定条件下,某可逆反应的正反应速率和逆反应速率随时间变化的曲线如下图所示。下列有关说法正确的是____(填序号)。 A、t1时刻,反应逆向进行 B、t2时刻,正反应速率大于逆反应速率 C、t3时刻,达到反应进行的限度 D、t4时刻,反应处于平衡状态(5)、II、已知:甲酸(HCOOH)是一种弱酸,一定条件下在水溶液中部分电离出氢离子和甲酸根离子(HCOO-),达到平衡状态。
A、t1时刻,反应逆向进行 B、t2时刻,正反应速率大于逆反应速率 C、t3时刻,达到反应进行的限度 D、t4时刻,反应处于平衡状态(5)、II、已知:甲酸(HCOOH)是一种弱酸,一定条件下在水溶液中部分电离出氢离子和甲酸根离子(HCOO-),达到平衡状态。请写出甲酸的电离方程式。
(6)、0.1 mol·L-1的甲酸溶液,当其电离达到平衡时,溶液中的c(HCOO-)为____ (填序号)。A、>0.1 mol·L-1 B、= 0.1 mol·L-1 C、0< c(HCOO-)<0.1 mol·L-1 D、=019. 回答下列问题:(1)、冷敷袋俗称冰袋,在日常生活中有降温、保鲜和镇痛等多种用途。制作冷敷袋可以利用____(填序号,下同)。A、放热的化学变化 B、吸热的化学变化 C、放热的物理变化 D、吸热的物理变化(2)、下列变化过程中放出热的是。①液态水汽化 ②稀释浓硫酸
③高温下碳酸钙分解 ④镁条与盐酸反应
⑤硝酸铵固体溶于水 ⑥铁丝在纯氧中燃烧
⑦氢氧化钾溶液与硝酸反应 ⑧八水合氢氧化钡固体与氯化铵固体混合搅拌
(3)、下列变化:①碘的升华 ②烧碱熔化 ③氯化钠溶于水④氯化氢溶于水 ⑤氯气溶于水 ⑥氯化铵受热分解未发生化学键破坏的是;仅发生离子键破坏的是。上述涉及的主要物质为纯净物时,属于共价化合物的是;属于离子化合物的是。
20. 已知:Cl2+2I-=2Cl-+I2 , 海藻中富含碘元素。某化学兴趣小组的同学在实验室里用灼烧海藻的灰分提取碘,其流程如下图。请回答下列问题: (1)、验证“含I-溶液”和“碘水”中含有的I-和I2所需的试剂分别是和。(2)、操作②选用CCl4的理由是____(填序号)。A、CCl4不溶于水 B、CCl4的密度比水大 C、碘在CCl4中比在水中溶解度更大 D、CCl4与碘水不反应(3)、用NaOH浓溶液反萃取后再加稀硫酸,可以分离I2和CCl4 , 有关化学方程式为:
(1)、验证“含I-溶液”和“碘水”中含有的I-和I2所需的试剂分别是和。(2)、操作②选用CCl4的理由是____(填序号)。A、CCl4不溶于水 B、CCl4的密度比水大 C、碘在CCl4中比在水中溶解度更大 D、CCl4与碘水不反应(3)、用NaOH浓溶液反萃取后再加稀硫酸,可以分离I2和CCl4 , 有关化学方程式为:碱性条件:3I2+6NaOH=5NaI+NaIO3+3H2O
酸性条件:5NaI+NaIO3+3H2SO4=3Na2SO4+3I2+3H2O
以下是反萃取过程的操作,请按要求填空:
①向装有I2的CCl4溶液的(填仪器名称)中加入少量1 mol·L-1NaOH溶液;
②振荡至溶液的色消失,静置、分层;
③将含碘的碱溶液从仪器的(填“上”、“下”)口倒入烧杯中;
④边搅拌边加入几滴1 mol‧L-1 H2SO4溶液,溶液立即转为棕黄色,并析出碘晶体。
(4)、本实验中可以循环利用的物质是。