河北省深州市2021-2022学年高一下学期期中考试化学试题
试卷更新日期:2023-02-22 类型:期中考试
一、单选题
-
1. 化学与生活密切相关,下列有关说法正确的是A、、和氮氧化物是主要的大气污染物 B、大气中的和是形成酸雨的主要污染物 C、是制造玻璃的主要原料之一,它在常温下不与溶液反应 D、目前主要用石灰石对煤燃烧后形成的烟气脱硫2. 研究物质可从微观辨析角度着手。下列说法正确的是A、乙烯的电子式:
 B、酯基:
B、酯基: C、丙烯的分子结构模型:
C、丙烯的分子结构模型: D、1,2-二溴乙烷的结构简式:
3. 把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的碳酸钠溶液的洗气瓶,最后收集到的气体是A、氧气 B、二氧化氮 C、二氧化碳 D、一氧化氮4. “自古书契多编以竹简,其用缣帛者(丝制品)谓之为纸”。文中“纸”的主要成分是A、葡萄糖 B、纤维素 C、蛋白质 D、油脂5. 立方烷是一种新合成的烷烃,其分子结构为
D、1,2-二溴乙烷的结构简式:
3. 把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的碳酸钠溶液的洗气瓶,最后收集到的气体是A、氧气 B、二氧化氮 C、二氧化碳 D、一氧化氮4. “自古书契多编以竹简,其用缣帛者(丝制品)谓之为纸”。文中“纸”的主要成分是A、葡萄糖 B、纤维素 C、蛋白质 D、油脂5. 立方烷是一种新合成的烷烃,其分子结构为 。下列有关它的说法错误的是 A、分子式为 B、能燃烧 C、能发生取代反应 D、一氯代物有2种6. 最近美国宇航局马里诺娃博士找到了一种比二氧化碳有效倍的“超级温室气体”——全氟丙烷并提出用其“温室化火星”使火星成为第二个地球的计划。下列有关全氟丙烷的说法正确的是A、与互为同素异形体 B、全氟丙烷的电子式为
。下列有关它的说法错误的是 A、分子式为 B、能燃烧 C、能发生取代反应 D、一氯代物有2种6. 最近美国宇航局马里诺娃博士找到了一种比二氧化碳有效倍的“超级温室气体”——全氟丙烷并提出用其“温室化火星”使火星成为第二个地球的计划。下列有关全氟丙烷的说法正确的是A、与互为同素异形体 B、全氟丙烷的电子式为 C、与互为同分异构体
D、与互为同系物
7. 乙醇、乙酸分子中的各种化学键如图所示,下列反应中断键的位置错误的是
C、与互为同分异构体
D、与互为同系物
7. 乙醇、乙酸分子中的各种化学键如图所示,下列反应中断键的位置错误的是 A、乙醇与金属钠反应,断裂①键 B、乙酸与乙醇发生酯化反应,断裂②键、a键 C、乙醇在铜催化共热下与O2反应,断裂①③键 D、乙酸变成乙酸酐的反应2CH3COOH→(CH3CO)2O+ H2O,断裂a、b键8. 热激活电池常用作火箭的工作电源,某种热激活电池以和为电极材料,以无水为电解质,电池总反应为。当电解质受热熔融后,电池即可瞬间放电。下列有关说法错误的是A、电极发生还原反应 B、负极的电极反应式为 C、放电时,向负极移动 D、每转移1mol电子,正极质量减少48g9. 下列从实验事实所得到的相应结论正确的是
A、乙醇与金属钠反应,断裂①键 B、乙酸与乙醇发生酯化反应,断裂②键、a键 C、乙醇在铜催化共热下与O2反应,断裂①③键 D、乙酸变成乙酸酐的反应2CH3COOH→(CH3CO)2O+ H2O,断裂a、b键8. 热激活电池常用作火箭的工作电源,某种热激活电池以和为电极材料,以无水为电解质,电池总反应为。当电解质受热熔融后,电池即可瞬间放电。下列有关说法错误的是A、电极发生还原反应 B、负极的电极反应式为 C、放电时,向负极移动 D、每转移1mol电子,正极质量减少48g9. 下列从实验事实所得到的相应结论正确的是选项
实验事实
结论
A
和盐酸反应时,其他条件相同,增大溶液浓度,析出硫沉淀所需时间缩短
当其他条件不变时,适当增大反应物浓度,化学反应速率加快
B
在化学反应前后,催化剂的质量和化学性质都没有发生改变
催化剂不参与化学反应
C
物质的量浓度相同的盐酸和醋酸分别与等质量的、形状相同的锌粒反应
反应刚开始时反应速率相同
D
在容积可变的密闭容器中发生反应: , 把容积缩小一半
正反应速率加快,逆反应速率减小
A、A B、B C、C D、D10. 自热食品是将水倒在发热包上,发热包遇水自动升温,从而加热食物。发热包的主要成分是生石灰、铁粉、焦炭粉、碳酸钠、焙烧硅藻土等,遇水时铁粉、焦炭粉会形成许多微小的铁碳原电池。下列说法错误的是A、生石灰和水反应生成熟石灰放出热量 B、发热包遇水最终有碳酸钙和氢氧化钙生成 C、遇水发热过程中形成了许多微小的铁碳原电池,其中碳作负极 D、铁碳原电池的正极反应为11. 我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应: ,在低温下获得高转化率与高反应速率。反应过程示意图如下: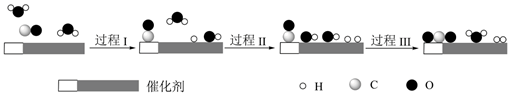
下列说法正确的是( )
A、过程Ⅰ、过程Ⅱ均为放热过程 B、该催化过程中:有极性键和非极性键的断裂,也有极性键和非极性键的形成 C、图示显示:起始时的2个 在反应过程中并未都参与了反应 D、一定条件下,当CO和 反应未达到限度时,12. 环氧乙烷可用作生产一次性口罩时的灭菌剂。通过与蛋白质上的羧基、氨基、巯基等发生作用(原理如图),使蛋白质失去反应基,从而达到灭菌的目的。
下列说法错误的是
A、与乙醛不互为同分异构体 B、氨基、巯基与环氧乙烷反应均断裂极性共价键 C、用灭菌后的口罩应对的残余量进行安全检测 D、杀灭微生物是利用其氧化性,使微生物蛋白质变性而失去生理活性二、多选题
-
13. 通过对实验现象的观察、分析推理得出正确的结论,这是化学学习的方法之一、下列对实验现象的解释正确的是
选项
实验现象
解释
A
向盐酸中加入浓硫酸时产生白雾
说明浓硫酸具有脱水性
B
向含有的溶液中通入适量溶液红色褪去
说明具有还原性
C
向某溶液中加盐酸酸化的硝酸钡溶液,有白色沉淀生成
说明该溶液中一定含有
D
浓硝酸在光照条件下变黄
浓硝酸不稳定,见光易分解,生成的有色产物能溶于浓硝酸
A、A B、B C、C D、D三、填空题
-
14. 根据要求回答下列问题:
反应的能量变化趋势如图所示。
 (1)、该反应为(填“吸热”或“放热”)反应。(2)、若要使该反应的反应速率加快,下列措施不可行的是____(填字母)。A、将铁片改为铁粉 B、滴加少量溶液 C、升高温度 D、将稀硫酸改为98%的浓硫酸(3)、欲区分葡萄糖和淀粉,可选用____(填字母,下同)。A、碘水 B、银氨溶液 C、盐酸 D、溶液(4)、氮的化合物常用作制冷剂的是(填名称),向蔗糖中滴加少量浓硫酸并搅拌,出现“黑色面包”,并产生刺激性无色气体,这一现象显示浓硫酸的(填性质)。(5)、燃煤排放的尾气中含有二氧化硫、氮的氧化物(主要为)等污染物,工业上采用碱性溶液作为吸收剂可同时对烟气进行脱硫、脱硝。脱硫的离子方程式为 , 实验证明相对于 , 更难脱除,其原因可能是。15. 化学反应速率和限度与生产、生活密切相关。请回答下列问题。(1)、在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
(1)、该反应为(填“吸热”或“放热”)反应。(2)、若要使该反应的反应速率加快,下列措施不可行的是____(填字母)。A、将铁片改为铁粉 B、滴加少量溶液 C、升高温度 D、将稀硫酸改为98%的浓硫酸(3)、欲区分葡萄糖和淀粉,可选用____(填字母,下同)。A、碘水 B、银氨溶液 C、盐酸 D、溶液(4)、氮的化合物常用作制冷剂的是(填名称),向蔗糖中滴加少量浓硫酸并搅拌,出现“黑色面包”,并产生刺激性无色气体,这一现象显示浓硫酸的(填性质)。(5)、燃煤排放的尾气中含有二氧化硫、氮的氧化物(主要为)等污染物,工业上采用碱性溶液作为吸收剂可同时对烟气进行脱硫、脱硝。脱硫的离子方程式为 , 实验证明相对于 , 更难脱除,其原因可能是。15. 化学反应速率和限度与生产、生活密切相关。请回答下列问题。(1)、在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
①比较时刻,正、逆反应速率大小(填“>”“=”或“<”)。
②若 , 计算反应开始至时刻用M的浓度变化表示的平均反应速率为。
③如果升高温度,则(填“增大”“减小”或“不变”)。
(2)、在2L密闭容器内,800℃时仅发生反应 , 体系中开始仅含有NO和 , 随时间的变化如下表所示:时间/s
0
1
2
3
4
/mol
0.020
0.010
0.008
0.007
0.007
①3s时,生成的物质的量为mol,在第5s时,NO的转化率为。
②如图中表示变化曲线的是(填字母)。

③下列能说明该反应已达到平衡状态的是(填字母)。
a.每消耗1mol , 生成2mol的
b.各物质组分的物质的浓度不再改变
c.混合气体的平均相对分子质量不变
d.容器内密度保持不变
16. 和是主要的大气污染物。某小组认为一定条件下,用与反应转化为无污染物质可进行汽车尾气无害化处理。(1)、氨气的制备①实验室制氨气的化学方程式为。
②制备和收集纯净、干燥的氨气,可以选择下图装置(填字母),C中试剂为。
 (2)、氨气与二氧化氮的反应(已知:)。
(2)、氨气与二氧化氮的反应(已知:)。
①在硬质玻璃管Y中加入少量催化剂,将气体注入Y管中,Z中应盛装。
②打开 , 将注射器X中的缓慢注入Y中,发生反应的化学方程式为。
③将注射器活塞退回原处并固定,待装置恢复到室温,打开K2 , Y中出现倒吸现象,原因
是。
(3)、该小组进一步研究的性质,探究能否与发生氧化还原反应。实验室用铜丝和浓硫酸反应生成的化学方程式为。利用(2)中装置,将Y中的药品更换为少量 , 将注射器X中缓慢推入Y中,Y装置中淡黄色粉末颜色变成白色。设计方案检验生成的白色物质中含有 , 其方案为。17. 下图是一些常见有机物的转化关系。A的产量可以用来衡量一个国家的石油化工发展水平,E是一种酸。请回答相关问题。 (1)、D的结构简式为。(2)、C与E分子中相应的官能团名称为、。(3)、在催化剂条件下,A可形成高分子化合物B,该反应的化学方程式为。(4)、反应①~⑦中属于加成反应的有(填序号)。(5)、写出反应③的化学方程式:。(6)、若将A通入酸性高锰酸钾溶液中,可以观察到 , 发生的反应类型为 , 乙烯使溴的四氯化碳溶液褪色的反应类型和使酸性高锰酸钾溶液褪色的反应类型(填“相同”或“不相同”)。
(1)、D的结构简式为。(2)、C与E分子中相应的官能团名称为、。(3)、在催化剂条件下,A可形成高分子化合物B,该反应的化学方程式为。(4)、反应①~⑦中属于加成反应的有(填序号)。(5)、写出反应③的化学方程式:。(6)、若将A通入酸性高锰酸钾溶液中,可以观察到 , 发生的反应类型为 , 乙烯使溴的四氯化碳溶液褪色的反应类型和使酸性高锰酸钾溶液褪色的反应类型(填“相同”或“不相同”)。
-