广东省珠海市三校2021-2022学年高一下学期期中联考化学试题
试卷更新日期:2023-02-22 类型:期中考试
一、单选题
-
1. 下列说法正确的是A、制造手机芯片的关键材料是二氧化硅 B、“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐 C、我国提出网络强国战略,光缆线路总长超过三千万公里,光缆的主要成分是晶体硅 D、“超轻海绵”使用的石墨烯是新型无机非金属材料2. 下列各图均能表示甲烷的分子结构,其中能反映其真实存在状况的是A、结构示意图
 B、电子式
B、电子式 C、球棍模型
C、球棍模型 D、空间充填模型
D、空间充填模型 3. 如图是硫元素在自然界中的循环示意图,下列说法错误的是( )
3. 如图是硫元素在自然界中的循环示意图,下列说法错误的是( ) A、硫在自然界只有游离态 B、煤中含有硫元素,燃煤中加入生石灰可脱硫 C、硫具有弱氧化性,和变价金属反应,通常将金属氧化成低价态 D、硫化氢溶于水得到氢硫酸,氢硫酸是弱酸,能与碱、碱性氧化物反应4. 下列四种溶液中,一定存在SO42-的是A、向甲溶液中加入BaCl2溶液,有白色沉淀产生 B、向乙溶液中加入BaCl2溶液,有白色沉淀产生,再加入盐酸沉淀不溶解 C、向丙溶液中加入盐酸使之酸化,无白色沉淀,再加入BaCl2溶液,有白色沉淀产生 D、向丁溶液中加入硝酸酸化,再加入硝酸钡溶液,有白色沉淀产生5. 酸雨被称为“天堂的眼泪”,会造成水土酸性化、建筑物加速腐蚀等危害。下列说法正确的是A、酸雨不会对动植物产生任何影响 B、使用新型能源不会对酸雨的防治产生效果 C、酸雨指的是pH小于7的雨水 D、NO2和SO2的过度排放是形成酸雨的主要原因6. 下列装置用于实验室中制取干燥氨气的实验,其中能达到实验目的的是( )
A、硫在自然界只有游离态 B、煤中含有硫元素,燃煤中加入生石灰可脱硫 C、硫具有弱氧化性,和变价金属反应,通常将金属氧化成低价态 D、硫化氢溶于水得到氢硫酸,氢硫酸是弱酸,能与碱、碱性氧化物反应4. 下列四种溶液中,一定存在SO42-的是A、向甲溶液中加入BaCl2溶液,有白色沉淀产生 B、向乙溶液中加入BaCl2溶液,有白色沉淀产生,再加入盐酸沉淀不溶解 C、向丙溶液中加入盐酸使之酸化,无白色沉淀,再加入BaCl2溶液,有白色沉淀产生 D、向丁溶液中加入硝酸酸化,再加入硝酸钡溶液,有白色沉淀产生5. 酸雨被称为“天堂的眼泪”,会造成水土酸性化、建筑物加速腐蚀等危害。下列说法正确的是A、酸雨不会对动植物产生任何影响 B、使用新型能源不会对酸雨的防治产生效果 C、酸雨指的是pH小于7的雨水 D、NO2和SO2的过度排放是形成酸雨的主要原因6. 下列装置用于实验室中制取干燥氨气的实验,其中能达到实验目的的是( )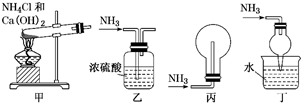 A、用装置甲制备氨气 B、用装置乙除去氨气中的少量水 C、用装置丙收集氨气 D、用装置丁吸收多余的氨气7. 下列说法中错误的是A、化学反应必然伴随发生能量变化 B、化学反应中能量变化的大小与反应物的质量多少有关 C、能量变化必然伴随发生化学反应 D、化学反应中的能量变化主要是由化学键变化引起的8. 化学反应速率在工农业生产和日常生活中都有重要作用,下列说法正确的是A、将肉类食品进行低温冷藏,能使其永远不会腐败变质 B、化学工业都必须使用催化剂 C、夏天面粉的发酵速率与冬天面粉的发酵速率相差不大 D、茶叶使用真空包装,能显著延长茶叶的储存时间9. 下列说法正确的是
A、用装置甲制备氨气 B、用装置乙除去氨气中的少量水 C、用装置丙收集氨气 D、用装置丁吸收多余的氨气7. 下列说法中错误的是A、化学反应必然伴随发生能量变化 B、化学反应中能量变化的大小与反应物的质量多少有关 C、能量变化必然伴随发生化学反应 D、化学反应中的能量变化主要是由化学键变化引起的8. 化学反应速率在工农业生产和日常生活中都有重要作用,下列说法正确的是A、将肉类食品进行低温冷藏,能使其永远不会腐败变质 B、化学工业都必须使用催化剂 C、夏天面粉的发酵速率与冬天面粉的发酵速率相差不大 D、茶叶使用真空包装,能显著延长茶叶的储存时间9. 下列说法正确的是 A、图1所示装置能将化学能转化为电能 B、图2所示反应为吸热反应 C、蓄电池充电时也发生了氧化还原反应 D、锌锰干电池中,锌筒作正极10. 下列反应中,属于取代反应的是A、 B、 C、 D、11. 下列说法正确的是A、C5H12表示的一定是纯净物 B、分子组成上相差若干个CH2原子团的化合物互称同系物 C、分子式相同而结构不同的有机物互称同分异构体 D、烷烃分子中碳原子与其他原子的结合方式均是非极性共价键12. 某同学设想用下表所给装置来验证浓硫酸的某些性质,其中不能达到实验目的的是( )
A、图1所示装置能将化学能转化为电能 B、图2所示反应为吸热反应 C、蓄电池充电时也发生了氧化还原反应 D、锌锰干电池中,锌筒作正极10. 下列反应中,属于取代反应的是A、 B、 C、 D、11. 下列说法正确的是A、C5H12表示的一定是纯净物 B、分子组成上相差若干个CH2原子团的化合物互称同系物 C、分子式相同而结构不同的有机物互称同分异构体 D、烷烃分子中碳原子与其他原子的结合方式均是非极性共价键12. 某同学设想用下表所给装置来验证浓硫酸的某些性质,其中不能达到实验目的的是( )选项
A
B
C
D
实验目的
吸水性
脱水性
稀释放热
强氧化性
实验装置



 A、A B、B C、C D、D13. “封管实验”具有简易、方便、节约、绿色等优点,关于如图所示三个“封管实验”(夹持装置未画出)的说法正确的是( )
A、A B、B C、C D、D13. “封管实验”具有简易、方便、节约、绿色等优点,关于如图所示三个“封管实验”(夹持装置未画出)的说法正确的是( ) A、加热时,①中上部汇集了 固体 B、加热时,②中溶液变红,冷却后又变为无色 C、加热时,③中溶液红色褪去,冷却后溶液变红,体现 的漂白性 D、三个“封管实验”中所发生的化学反应都是可逆反应14. 习主席在2020年新年贺词中强调“5G商用加速推出,凝结着新时代奋斗者的心血和汗水,彰显了不同凡响的中国风采、中国力量”,制造芯片用到高纯硅,用SiHCl3与过量H2在1100~1200℃反应制备高纯硅的装置如下图所示(热源及夹持装置略去)。
A、加热时,①中上部汇集了 固体 B、加热时,②中溶液变红,冷却后又变为无色 C、加热时,③中溶液红色褪去,冷却后溶液变红,体现 的漂白性 D、三个“封管实验”中所发生的化学反应都是可逆反应14. 习主席在2020年新年贺词中强调“5G商用加速推出,凝结着新时代奋斗者的心血和汗水,彰显了不同凡响的中国风采、中国力量”,制造芯片用到高纯硅,用SiHCl3与过量H2在1100~1200℃反应制备高纯硅的装置如下图所示(热源及夹持装置略去)。
已知: SiHCl3 遇水H2O 强烈水解,在空气中易自燃。下列说法错误的是( )
A、装置 B 中的试剂是浓硫酸 B、实验时先打开装置C中分液漏斗的旋塞 C、装置C中的烧瓶需要加热,其目的是使滴入烧瓶中的SiHCl3气化 D、装置D不能采用普通玻璃管的原因是在反应温度下,普通玻璃管会软化15. 为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中错误的是 A、图甲所示实验可通过观察产生气泡的快慢来比较H2O2分解速率的大小 B、相同环境下若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 C、用图乙所示装置测定反应速率,需要记录反应产生的气体体积及反应时间 D、为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位16. 氢能的低成本、低温、高速率制取一直是亟待解决的关键难题。实验计算机模拟在催化剂表面水煤气变换低温产氢反应(CO+H2O=CO2+H2)过程中能量的变化如图所示,下列说法正确的是
A、图甲所示实验可通过观察产生气泡的快慢来比较H2O2分解速率的大小 B、相同环境下若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 C、用图乙所示装置测定反应速率,需要记录反应产生的气体体积及反应时间 D、为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位16. 氢能的低成本、低温、高速率制取一直是亟待解决的关键难题。实验计算机模拟在催化剂表面水煤气变换低温产氢反应(CO+H2O=CO2+H2)过程中能量的变化如图所示,下列说法正确的是 A、水煤气变换产氢反应是吸热反应 B、过程I和过程II均为放热过程 C、过程I发生了极性键的断裂 D、过程II只生成了具有极性键的CO2和H2O
A、水煤气变换产氢反应是吸热反应 B、过程I和过程II均为放热过程 C、过程I发生了极性键的断裂 D、过程II只生成了具有极性键的CO2和H2O二、综合题
-
17. 氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2.某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
I.某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。
 (1)、实验室制备氨气的化学方程式为;B中圆底烧瓶收集氨气时,请你选择氨气的进气口(填“a”或“b”)。(2)、若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是。(3)、将I中收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。
(1)、实验室制备氨气的化学方程式为;B中圆底烧瓶收集氨气时,请你选择氨气的进气口(填“a”或“b”)。(2)、若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是。(3)、将I中收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。
在一定温度下按图示装置进行实验。打开K1 , 推动注射器活塞,使X中的气体缓慢通入Y管中,反应的化学方程式。
(4)、Ⅱ.某小组用如图所示装置(夹持装置省略)制备SO2 , 并探究SO2与FeCl3溶液的反应。
回答下列问题:
仪器a的名称是 , 装置I中反应的化学方程式为。
(5)、多孔球泡的作用有、。18. 化学反应的速率和限度对人类生产生活有重要的意义。(1)、I.某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值,体积已换算成标准状态):时间(min)
1
2
3
4
5
氢气体积(mL)
50
120
232
290
310
哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大。
(2)、求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)。(3)、如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:A、蒸馏水 B、Na2CO3溶液 C、NaCl溶液 D、CuSO4溶液 E、NaNO3溶液可行的是____(填编号)。
(4)、Ⅱ.已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计实验如表(所取溶液体积均为2mL)。实验编号
温度/℃
c(Na2S2O3)/mol·L-1
c(H2SO4)/mol·L-1
I
25
0.1
0.1
II
25
0.2
0.1
III
50
0.2
0.1
①上述实验中溶液最先变浑浊的是。(填实验编号,下同)
②为探究浓度对化学反应速率的影响,应选择实验和。
19. 回答下列问题:(1)、键能是表征化学键强度的物理量,可以用键断裂时所需能量的大小来衡量。从断键和成键的角度分析反应2H2(g)+O2(g)2H2O(g)中能量的变化,化学键的键能如表所示:化学键
H—H
O=O
H—O
键能(kJ·mol-1)
436
496
463
则生成1molH2O(g)可以放出kJ热量。
(2)、下列反应中,属于放热反应的是(填字母,下同),属于吸热反应的是。a.盐酸与烧碱溶液反应
b.Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水
d.高温煅烧石灰石使其分解
e.铝和盐酸反应
f.葡萄糖在人体内氧化分解
(3)、A,B,C,D四种金属按下表中装置进行实验。装置



现象
金属A不断溶解
C的质量增加
A上有气体产生
根据实验现象回答下列问题:
①装置甲溶液中的阴离子移向(填“A”或“B”)极。
②装置乙中正极的电极反应式为。
③四种金属活动性由强到弱的顺序是。
20. 某温度时,在0.5L密闭容器中,某一可逆反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析可得: (1)、该反应的化学方程式为。(2)、若降低温度,则该反应的正反应速率(填“加快”“减慢”或“不变”,下同),逆反应速率。(3)、第4min时,正、逆反应速率的大小关系为v正(填”>””<”或”=”)v逆。(4)、能判断该反应在一定温度下达到化学平衡状态的依据是____。A、容器中压强不变 B、混合气体中A的浓度不再改变 C、容器中气体密度不变 D、c(A)=c(B)(5)、平衡时A的转化率为。(6)、平衡时混合气体中B的体积分数约为。(7)、反应达到平衡,此时体系内压强与开始时的压强之比为。
(1)、该反应的化学方程式为。(2)、若降低温度,则该反应的正反应速率(填“加快”“减慢”或“不变”,下同),逆反应速率。(3)、第4min时,正、逆反应速率的大小关系为v正(填”>””<”或”=”)v逆。(4)、能判断该反应在一定温度下达到化学平衡状态的依据是____。A、容器中压强不变 B、混合气体中A的浓度不再改变 C、容器中气体密度不变 D、c(A)=c(B)(5)、平衡时A的转化率为。(6)、平衡时混合气体中B的体积分数约为。(7)、反应达到平衡,此时体系内压强与开始时的压强之比为。