高考化学真题重组卷 7+4专题冲刺 专题15 化学实验
试卷更新日期:2023-02-21 类型:三轮冲刺
一、单选题
-
1. 下列试剂实验室保存方法错误的是( )A、浓硝酸保存在棕色细口瓶中 B、氢氧化钠固体保存在广口塑料瓶中 C、四氯化碳保存在广口塑料瓶中 D、高锰酸钾固体保存在棕色广口瓶中2. 《医学入门》中记载我国传统中医提纯铜绿的方法:“水洗净,细研水飞,去石澄清,慢火熬干,”其中未涉及的操作是( )A、洗涤 B、粉碎 C、萃取 D、蒸发3. 下列实验能达到目的的是( )
实验目的
实验方法或操作
A
测定中和反应的反应热
酸碱中和滴定的同时,用温度传感器采集锥形瓶内溶液的温度
B
探究浓度对化学反应速率的影响
量取同体积不同浓度的溶液,分别加入等体积等浓度的溶液,对比现象
C
判断反应后是否沉淀完全
将溶液与溶液混合,反应后静置,向上层清液中再加1滴溶液
D
检验淀粉是否发生了水解
向淀粉水解液中加入碘水
A、A B、B C、C D、D4. 下列实验装置(部分夹持装置略)或现象错误的是( )


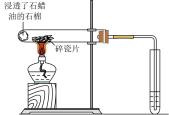
A.滴入酚酞溶液
B.吸氧腐蚀
C.钠的燃烧
D.石蜡油的热分解
A、A B、B C、C D、D5. 利用如图所示装置(夹持装置略)进行实验,b中现象不能证明a中产物生成的是( )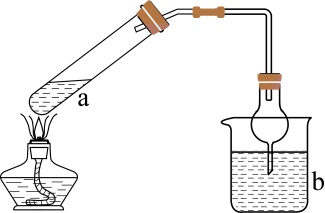
a中反应
b中检测试剂及现象
A
浓分解生成
淀粉溶液变蓝
B
与浓生成
品红溶液褪色
C
浓与溶液生成
酚酞溶液变红
D
与乙醇溶液生成丙烯
溴水褪色
A、A B、B C、C D、D6. 下列实验中,不能达到实验目的的是( )由海水制取蒸馏水
萃取碘水中的碘
分离粗盐中的不溶物
由制取无水固体

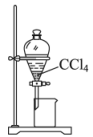


A
B
C
D
A、A B、B C、C D、D7. 下列实验操作规范的是( )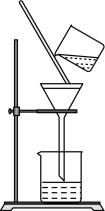
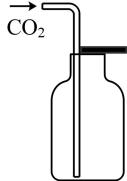
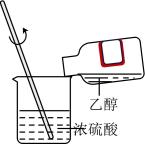
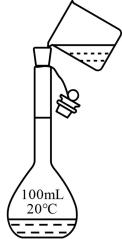
A.过滤
B.排空气法收集
C.混合浓硫酸和乙醇
D.溶液的转移
A、A B、B C、C D、D二、综合题
-
8. 实验室以二氧化铈()废渣为原料制备含量少的 , 其部分实验过程如下:
 (1)、“酸浸”时与反应生成并放出 , 该反应的离子方程式为。(2)、pH约为7的溶液与溶液反应可生成沉淀,该沉淀中含量与加料方式有关。得到含量较少的的加料方式为____(填序号)。A、将溶液滴加到溶液中 B、将溶液滴加到溶液中(3)、通过中和、萃取、反萃取、沉淀等过程,可制备含量少的。已知能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
(1)、“酸浸”时与反应生成并放出 , 该反应的离子方程式为。(2)、pH约为7的溶液与溶液反应可生成沉淀,该沉淀中含量与加料方式有关。得到含量较少的的加料方式为____(填序号)。A、将溶液滴加到溶液中 B、将溶液滴加到溶液中(3)、通过中和、萃取、反萃取、沉淀等过程,可制备含量少的。已知能被有机萃取剂(简称HA)萃取,其萃取原理可表示为(水层)+3HA(有机层)(有机层)+(水层)
①加氨水“中和”去除过量盐酸,使溶液接近中性。去除过量盐酸的目的是。
②反萃取的目的是将有机层转移到水层。使尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有(填两项)。
③与“反萃取”得到的水溶液比较,过滤溶液的滤液中,物质的量减小的离子有(填化学式)。
(4)、实验中需要测定溶液中的含量。已知水溶液中可用准确浓度的溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为。请补充完整实验方案:①准确量取溶液[约为],加氧化剂将完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到容量瓶中后定容;②按规定操作分别将和待测溶液装入如图所示的滴定管中:③。 9. 某工厂采用辉铋矿(主要成分为 , 含有、杂质)与软锰矿(主要成分为)联合焙烧法制各和 , 工艺流程如下:
9. 某工厂采用辉铋矿(主要成分为 , 含有、杂质)与软锰矿(主要成分为)联合焙烧法制各和 , 工艺流程如下:
已知:①焙烧时过量的分解为 , 转变为;
②金属活动性:;
③相关金属离子形成氢氧化物的范围如下:
开始沉淀
完全沉淀
6.5
8.3
1.6
2.8
8.1
10.1
回答下列问题:
(1)、为提高焙烧效率,可采取的措施为。a.进一步粉碎矿石 b.鼓入适当过量的空气 c.降低焙烧温度
(2)、在空气中单独焙烧生成 , 反应的化学方程式为。(3)、“酸浸”中过量浓盐酸的作用为:①充分浸出和;②。(4)、滤渣的主要成分为(填化学式)。(5)、生成气体A的离子方程式为。(6)、加入金属Bi的目的是。(7)、将100kg辉铋矿进行联合焙烧,转化时消耗1.1kg金属Bi,假设其余各步损失不计,干燥后称量产品质量为32kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为。10. 全球对锂资源的需求不断增长,“盐湖提锂”越来越受到重视。某兴趣小组取盐湖水进行浓缩和初步除杂后,得到浓缩卤水(含有和少量),并设计了以下流程通过制备碳酸锂来提取锂。
时相关物质的参数如下:
的溶解度:
化合物

回答下列问题:
(1)、“沉淀1”为。(2)、向“滤液1”中加入适量固体的目的是。(3)、为提高的析出量和纯度,“操作A”依次为、、洗涤。(4)、有同学建议用“侯氏制碱法”的原理制备。查阅资料后,发现文献对常温下的有不同的描述:①是白色固体;②尚未从溶液中分离出来。为探究的性质,将饱和溶液与饱和溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。上述现象说明,在该实验条件下(填“稳定”或“不稳定”),有关反应的离子方程式为。(5)、他们结合(4)的探究结果,拟将原流程中向“滤液2”加入改为通入。这一改动能否达到相同的效果,作出你的判断并给出理由。三、实验探究题
-
11. 实验室利用和亚硫酰氯()制备无水的装置如图所示(加热及夹持装置略)。已知沸点为 , 遇水极易反应生成两种酸性气体。回答下列问题:
 (1)、实验开始先通。一段时间后,先加热装置(填“a”或“b”)。装置b内发生反应的化学方程式为。装置c、d共同起到的作用是。(2)、现有含少量杂质的 , 为测定n值进行如下实验:
(1)、实验开始先通。一段时间后,先加热装置(填“a”或“b”)。装置b内发生反应的化学方程式为。装置c、d共同起到的作用是。(2)、现有含少量杂质的 , 为测定n值进行如下实验:实验Ⅰ:称取样品,用足量稀硫酸溶解后,用标准溶液滴定达终点时消耗(滴定过程中转化为 , 不反应)。
实验Ⅱ:另取样品,利用上述装置与足量反应后,固体质量为。
则;下列情况会导致n测量值偏小的是(填标号)。
A.样品中含少量杂质
B.样品与反应时失水不充分
C.实验Ⅰ中,称重后样品发生了潮解
D.滴定达终点时发现滴定管尖嘴内有气泡生成
(3)、用上述装置、根据反应制备。已知与分子结构相似,与互溶,但极易水解。选择合适仪器并组装蒸馏装置对、混合物进行蒸榴提纯(加热及夹持装置略),安装顺序为①⑨⑧(填序号),先馏出的物质为。