高考化学真题重组卷 7+4专题冲刺 专题14 化学键与晶体结构
试卷更新日期:2023-02-21 类型:三轮冲刺
一、单选题
-
1. 理论化学模拟得到一种离子,结构如图。下列关于该离子的说法错误的是( )
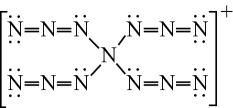 A、所有原子均满足8电子结构 B、N原子的杂化方式有2种 C、空间结构为四面体形 D、常温下不稳定2. 、属于第三代半导体材料,二者成键结构与金刚石相似,晶体中只存在键、键。下列说法错误的是( )A、的熔点高于 B、晶体中所有化学键均为极性键 C、晶体中所有原子均采取杂化 D、晶体中所有原子的配位数均相同3. 下列有关N、P及其化合物的说法错误的是( )A、N的电负性比P的大,可推断NCl3分子的极性比PCl3的大 B、N与N的π键比P与P的强,可推断N≡N的稳定性比P≡P的高 C、NH3的成键电子对间排斥力较大,可推断NH3的键角比PH3的大 D、HNO3的分子间作用力较小,可推断HNO3的熔点比H3PO4的低4. 某立方晶系的锑钾(Sb—K)合金可作为钾离子电池的电极材料,图a为该合金的晶胞结构图,图b表示晶胞的一部分。下列说法正确的是( )
A、所有原子均满足8电子结构 B、N原子的杂化方式有2种 C、空间结构为四面体形 D、常温下不稳定2. 、属于第三代半导体材料,二者成键结构与金刚石相似,晶体中只存在键、键。下列说法错误的是( )A、的熔点高于 B、晶体中所有化学键均为极性键 C、晶体中所有原子均采取杂化 D、晶体中所有原子的配位数均相同3. 下列有关N、P及其化合物的说法错误的是( )A、N的电负性比P的大,可推断NCl3分子的极性比PCl3的大 B、N与N的π键比P与P的强,可推断N≡N的稳定性比P≡P的高 C、NH3的成键电子对间排斥力较大,可推断NH3的键角比PH3的大 D、HNO3的分子间作用力较小,可推断HNO3的熔点比H3PO4的低4. 某立方晶系的锑钾(Sb—K)合金可作为钾离子电池的电极材料,图a为该合金的晶胞结构图,图b表示晶胞的一部分。下列说法正确的是( )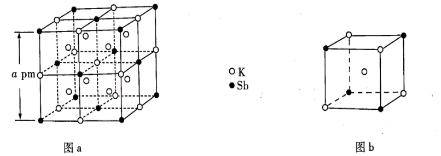 A、该晶胞的体积为a3×10-36cm-3 B、K和Sb原子数之比为3∶1 C、与Sb最邻近的K原子数为4 D、K和Sb之间的最短距离为 apm5. 甲烷单加氧酶(s—mmo)含有双核铁活性中心,是O2氧化CH4生成CH3OH的催化剂,反应过程如图所示。下列叙述错误的是( )
A、该晶胞的体积为a3×10-36cm-3 B、K和Sb原子数之比为3∶1 C、与Sb最邻近的K原子数为4 D、K和Sb之间的最短距离为 apm5. 甲烷单加氧酶(s—mmo)含有双核铁活性中心,是O2氧化CH4生成CH3OH的催化剂,反应过程如图所示。下列叙述错误的是( ) A、基态Fe原子的核外电子排布式为[Ar]3d64s2 B、步骤③有非极性键的断裂和极性键的形成 C、每一步骤都存在铁和氧元素之间的电子转移 D、图中的总过程可表示为:CH4+O2+2H++2e- CH3OH+H2O6. 下列化学用语表达正确的是( )A、F-的离子结构示意图:
A、基态Fe原子的核外电子排布式为[Ar]3d64s2 B、步骤③有非极性键的断裂和极性键的形成 C、每一步骤都存在铁和氧元素之间的电子转移 D、图中的总过程可表示为:CH4+O2+2H++2e- CH3OH+H2O6. 下列化学用语表达正确的是( )A、F-的离子结构示意图: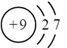 B、基态碳原子的轨道表示式:
B、基态碳原子的轨道表示式:  C、丙炔的键线式:
C、丙炔的键线式: 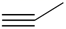 D、H2O分子的球棍模型:
D、H2O分子的球棍模型: 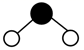 7. 下列各组物质的晶体类型相同的是( )A、SiO2和SO3 B、I2和NaCl C、Cu和Ag D、SiC和MgO
7. 下列各组物质的晶体类型相同的是( )A、SiO2和SO3 B、I2和NaCl C、Cu和Ag D、SiC和MgO二、综合题
-
8. 工业中可利用生产钛白的副产物和硫铁矿联合制备铁精粉和硫酸,实现能源及资源的有效利用。(1)、结构示意图如图1。
①的价层电子排布式为。
②中O和中S均为杂化,比较中键角和中键角的大小并解释原因。
③中与与的作用力类型分别是。
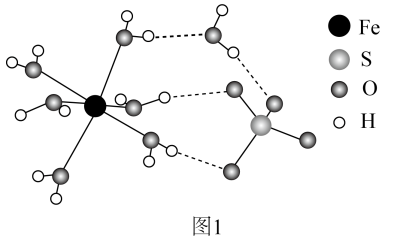
(2)、晶体的晶胞形状为立方体,边长为 , 结构如图2。
①距离最近的阴离子有个。
②的摩尔质量为 , 阿伏加德罗常数为。
该晶体的密度为。
(3)、加热脱水后生成 , 再与在氧气中掺烧可联合制备铁精粉和硫酸。分解和在氧气中燃烧的能量示意图如图3。利用作为分解的燃料,从能源及资源利用的角度说明该工艺的优点。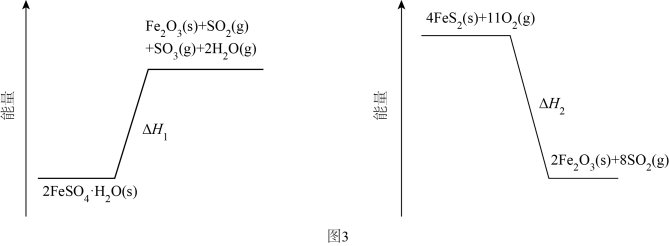 9. 研究笼形包合物结构和性质具有重要意义。化学式为的笼形包合物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞。晶胞参数为。回答下列问题:
9. 研究笼形包合物结构和性质具有重要意义。化学式为的笼形包合物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞。晶胞参数为。回答下列问题: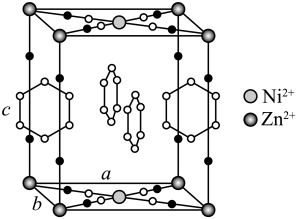 (1)、基态原子的价电子排布式为 , 在元素周期表中位置为。(2)、晶胞中N原子均参与形成配位键,与的配位数之比为;;晶胞中有d轨道参与杂化的金属离子是。(3)、吡啶(
(1)、基态原子的价电子排布式为 , 在元素周期表中位置为。(2)、晶胞中N原子均参与形成配位键,与的配位数之比为;;晶胞中有d轨道参与杂化的金属离子是。(3)、吡啶(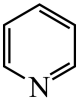 )替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的大键、则吡啶中N原子的价层孤电子对占据____(填标号)。 A、2s轨道 B、2p轨道 C、sp杂化轨道 D、sp2杂化轨道(4)、在水中的溶解度,吡啶远大于苯,主要原因是① , ②。(5)、
)替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的大键、则吡啶中N原子的价层孤电子对占据____(填标号)。 A、2s轨道 B、2p轨道 C、sp杂化轨道 D、sp2杂化轨道(4)、在水中的溶解度,吡啶远大于苯,主要原因是① , ②。(5)、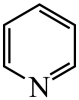 、
、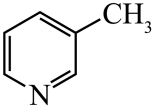 、
、 的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。 10. 硒( )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含 的新型 分子 的合成路线如下:
的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。 10. 硒( )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含 的新型 分子 的合成路线如下: (1)、 与S同族,基态硒原子价电子排布式为。(2)、 的沸点低于 ,其原因是。(3)、关于I~III三种反应物,下列说法正确的有_________。A、I中仅有 键 B、I中的 键为非极性共价键 C、II易溶于水 D、II中原子的杂化轨道类型只有 与 E、I~III含有的元素中,O电负性最大(4)、IV中具有孤对电子的原子有。(5)、硒的两种含氧酸的酸性强弱为 (填“>”或“<”)。
(1)、 与S同族,基态硒原子价电子排布式为。(2)、 的沸点低于 ,其原因是。(3)、关于I~III三种反应物,下列说法正确的有_________。A、I中仅有 键 B、I中的 键为非极性共价键 C、II易溶于水 D、II中原子的杂化轨道类型只有 与 E、I~III含有的元素中,O电负性最大(4)、IV中具有孤对电子的原子有。(5)、硒的两种含氧酸的酸性强弱为 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。 的立体构型为。
(6)、我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图a,沿x、y、z轴方向的投影均为图b。
①X的化学式为。
②设X的最简式的式量为 ,晶体密度为 ,则X中相邻K之间的最短距离为 (列出计算式, 为阿伏加德罗常数的值)。
三、实验探究题
-
11. [选修3:物质结构与性质]
铁和硒( )都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用。回答下列问题:
(1)、乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:
①基态 原子的核外电子排布式为 ;
②该新药分子中有种不同化学环境的C原子;
③比较键角大小:气态 分子 离子(填“>”“<”或“=”),原因是。
(2)、富马酸亚铁 是一种补铁剂。富马酸分子的结构模型如图所示:
①富马酸分子中 键与 键的数目比为;
②富马酸亚铁中各元素的电负性由大到小的顺序为。
(3)、科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化 ,将 转化为 ,反应过程如图所示:
①产物中N原子的杂化轨道类型为;
②与 互为等电子体的一种分子为(填化学式)。
(4)、钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
①该超导材料的最简化学式为;
② 原子的配位数为;
③该晶胞参数 、 。阿伏加德罗常数的值为 ,则该晶体的密度为 (列出计算式)。