高考化学真题重组卷 7+4专题冲刺 专题12 金属元素及其化合物
试卷更新日期:2023-02-21 类型:三轮冲刺
一、单选题
-
1. 关于化合物的性质,下列推测不合理的是( )A、与稀盐酸反应生成、、 B、隔绝空气加热分解生成、、 C、溶于氢碘酸(),再加萃取,有机层呈紫红色 D、在空气中,与高温反应能生成2. 为检验牺牲阳极的阴极保护法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入酸化的 溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是( )A、加入 溶液产生沉淀 B、加入淀粉碘化钾溶液无蓝色出现 C、加入 溶液无红色出现 D、加入 溶液无蓝色沉淀生成3. 下列说法不正确的是( )A、镁合金密度较小、强度较大,可用于制造飞机部件 B、还原铁粉可用作食品干燥剂 C、氯气、臭氧、二氧化氯都可用于饮用水的消毒 D、油脂是热值最高的营养物质4. 下列说法正确的是( )A、铁与碘反应易生成碘化铁 B、电解ZnSO4溶液可以得到Zn C、用石灰沉淀富镁海水中的Mg2+ , 生成碳酸镁 D、SO2通入BaCl2溶液中生成BaSO3沉淀5. 某离子液体的阴离子的结构如图所示,其中W、X、Y、Z、M为原子序数依次增大的短周期非金属元素,W是有机分子的骨架元素。下列说法正确的是( )

A、Z元素的最高价态为+7 B、基态原子未成对电子数:W>Y C、该阴离子中X不满足8电子稳定结构 D、最简单氢化物水溶液的pH:X>M6. 下列方程式不能准确解释相应实验现象的是( )A、酚酞滴入醋酸钠溶液中变为浅红色:CH3COO-+H2O⇌CH3COOH+OH- B、金属钠在空气中加热生成淡黄色固体:4Na+O2=2Na2O C、铝溶于氢氧化钠溶液,有无色气体产生:2Al+2OH-+2H2O=2 +3H2↑ D、将二氧化硫通入氢硫酸中产生黄色沉淀:SO2+2H2S=3S↓+2H2O7. 一种工业制备无水氯化镁的工艺流程如下:
A、Z元素的最高价态为+7 B、基态原子未成对电子数:W>Y C、该阴离子中X不满足8电子稳定结构 D、最简单氢化物水溶液的pH:X>M6. 下列方程式不能准确解释相应实验现象的是( )A、酚酞滴入醋酸钠溶液中变为浅红色:CH3COO-+H2O⇌CH3COOH+OH- B、金属钠在空气中加热生成淡黄色固体:4Na+O2=2Na2O C、铝溶于氢氧化钠溶液,有无色气体产生:2Al+2OH-+2H2O=2 +3H2↑ D、将二氧化硫通入氢硫酸中产生黄色沉淀:SO2+2H2S=3S↓+2H2O7. 一种工业制备无水氯化镁的工艺流程如下:
下列说法错误的是( )
A、物质X常选用生石灰 B、工业上常用电解熔融 制备金属镁 C、“氯化”过程中发生的反应为 D、“煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水二、综合题
-
8.(1)、Ⅰ.化合物Ⅹ由四种短周期元素组成,加热X,可产生使湿润的红色石蕊试纸变蓝的气体Y,Y为纯净物;取 ,用含 的盐酸完全溶解得溶液A,将溶液A分成 和 两等份,完成如下实验(白色沉淀C可溶于 溶液):

请回答:
组成X的四种元素是N、H和(填元素符号),X的化学式是。
(2)、溶液B通入过量 得到白色沉淀C的离子方程式是。(3)、写出一个化合反应(用化学方程式或离子方程式表示)。要求同时满足:①其中一种反应物的组成元素必须是X中除N、H外的两种元素;
②反应原理与“ ”相同。
(4)、Ⅱ.某兴趣小组为验证浓硫酸的性质进行实验,如图。实验中观察到的现象有:锥形瓶内有白雾,烧杯中出现白色沉淀。请回答:
将浓硫酸和浓盐酸混合可产生 气体的原因是。
(5)、烧杯中出现白色沉淀的原因是。三、推断题
-
9. 化合物X由4种元素组成。某兴趣小组按如图流程进行实验:
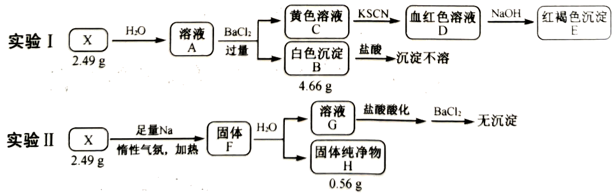
请回答:
(1)、组成X的元素有 , X的化学式为。(2)、溶液C中溶质的成分是(用化学式表示);根据C→D→E的现象,给出相应微粒与阳离子结合由弱到强的排序。(3)、X与足量Na反应生成固体F的化学方程式是。(4)、设计实验确定溶液G中阴离子。四、实验探究题
-
10. 为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。

回答下列问题:
(1)、由FeSO4·7H2O固体配制0.10 mol·L−1 FeSO4溶液,需要的仪器有药匙、玻璃棒、(从下列图中选择,写出名称)。 (2)、电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择作为电解质。
(2)、电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择作为电解质。阳离子
u∞×108/(m2·s−1·V−1)
阴离子
u∞×108/(m2·s−1·V−1)
Li+
4.07
4.61
Na+
5.19
7.40
Ca2+
6.59
Cl−
7.91
K+
7.62
8.27
(3)、电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入电极溶液中。(4)、电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L−1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=。(5)、根据(3)、(4)实验结果,可知石墨电极的电极反应式为 , 铁电极的电极反应式为。因此,验证了Fe2+氧化性小于 , 还原性小于。(6)、实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是。11. 立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:(1)、利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为__________(填标号)。A、黄色 B、红色 C、紫色 D、绿色(2)、以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:
①在回转窑中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为。回转窑尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的(填化学式)。
③沉淀器中反应的离子方程式为。
(3)、成品中S2−的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L−1的I2−KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000 mol·L−1Na2S2O3溶液滴定,反应式为I2+2 =2I−+ 。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为 , 样品中S2−的含量为(写出表达式)。
-
-