高考化学真题重组卷 7+4专题冲刺 专题11 非金属元素及其化合物
试卷更新日期:2023-02-21 类型:三轮冲刺
一、单选题
-
1. 下列说法不正确的是( )A、晶体硅的导电性介于导体和绝缘体之间,常用于制造光导纤维 B、高压钠灯发出的黄光透雾能力强、射程远,可用于道路照明 C、氧化铝熔点高,常用于制造耐高温材料 D、用石灰石-石膏法对燃煤烟气进行脱硫,同时可得到石膏2. 下列说法正确的是( )A、 (标准状况)与水充分反应转移 电子 B、 和 均可通过化合反应得到 C、将蘸有浓氨水和浓硫酸的玻璃棒相互靠近,有白烟产生 D、 与 溶液反应:3. 关于 性质的解释合理的是( )
选项
性质
解释
A
比 容易液化
分子间的范德华力更大
B
熔点高于
键的键能比 大
C
能与 以配位键结合
中氮原子有孤电子对
D
氨水中存在
是离子化合物
A、A B、B C、C D、D4. 含S元素的某钠盐a能发生如图转化。下列说法错误的是( )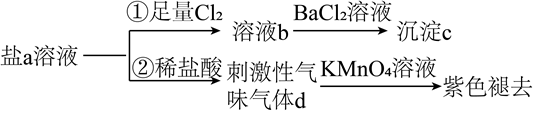 A、a可能为正盐,也可能为酸式盐 B、c为不溶于盐酸的白色沉淀 C、d为含极性键的非极性分子 D、反应②中还可能生成淡黄色沉淀5. 室温下,1体积的水能溶解约40体积的SO2。用试管收集SO2后进行如下实验。对实验现象的分析正确的是( )
A、a可能为正盐,也可能为酸式盐 B、c为不溶于盐酸的白色沉淀 C、d为含极性键的非极性分子 D、反应②中还可能生成淡黄色沉淀5. 室温下,1体积的水能溶解约40体积的SO2。用试管收集SO2后进行如下实验。对实验现象的分析正确的是( ) A、试管内液面上升,证明SO2与水发生了反应 B、试管中剩余少量气体,是因为SO2的溶解已达饱和 C、取出试管中的溶液,立即滴入紫色石蕊试液,溶液显红色,原因是:SO2+H2O⇌H2SO3、H2SO3⇌H++ 、 ⇌H++ D、取出试管中溶液,在空气中放置一段时间后pH下降,是由于SO2挥发6. 下列由实验现象所得结论错误的是( )A、向NaHSO3溶液中滴加氢硫酸,产生淡黄色沉淀,证明HSO 具有氧化性 B、向酸性KMnO4溶液中加入Fe3O4粉末,紫色褪去,证明Fe3O4中含Fe(Ⅱ) C、向浓HNO3中插入红热的炭,产生红棕色气体,证明炭可与浓HNO3反应生成NO2 D、向NaClO溶液中滴加酚酞试剂,先变红后褪色,证明NaClO在溶液中发生了水解反应7. 工业上以SO2和纯碱为原料制备无水NaHSO3的主要流程如图,下列说法错误的是( )
A、试管内液面上升,证明SO2与水发生了反应 B、试管中剩余少量气体,是因为SO2的溶解已达饱和 C、取出试管中的溶液,立即滴入紫色石蕊试液,溶液显红色,原因是:SO2+H2O⇌H2SO3、H2SO3⇌H++ 、 ⇌H++ D、取出试管中溶液,在空气中放置一段时间后pH下降,是由于SO2挥发6. 下列由实验现象所得结论错误的是( )A、向NaHSO3溶液中滴加氢硫酸,产生淡黄色沉淀,证明HSO 具有氧化性 B、向酸性KMnO4溶液中加入Fe3O4粉末,紫色褪去,证明Fe3O4中含Fe(Ⅱ) C、向浓HNO3中插入红热的炭,产生红棕色气体,证明炭可与浓HNO3反应生成NO2 D、向NaClO溶液中滴加酚酞试剂,先变红后褪色,证明NaClO在溶液中发生了水解反应7. 工业上以SO2和纯碱为原料制备无水NaHSO3的主要流程如图,下列说法错误的是( ) A、吸收过程中有气体生成 B、结晶后母液中含有NaHCO3 C、气流干燥湿料时温度不宜过高 D、中和后溶液中含Na2SO3和NaHCO3
A、吸收过程中有气体生成 B、结晶后母液中含有NaHCO3 C、气流干燥湿料时温度不宜过高 D、中和后溶液中含Na2SO3和NaHCO3二、实验探究题
-
8. 磁性材料在很多领域具有应用前景,其制备过程如下(各步均在 氛围中进行):
①称取 ,配成 溶液,转移至恒压滴液漏斗中。
②向三颈烧瓶中加入 溶液。
③持续磁力搅拌,将 溶液以 的速度全部滴入三颈烧瓶中,100℃下回流3h。
④冷却后过滤,依次用热水和乙醇洗涤所得黑色沉淀,在 干燥。
⑤管式炉内焙烧2h,得产品3.24g。
部分装置如图:

回答下列问题:
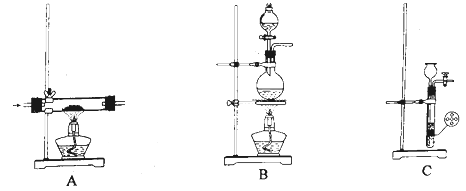
(1)、仪器a的名称是;使用恒压滴液漏斗的原因是。(2)、实验室制取 有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合下列供选试剂和装置,选出一种可行的方法,化学方程式为 , 对应的装置为(填标号)。可供选择的试剂: 、 、 、 、饱和 、饱和
可供选择的发生装置(净化装置略去):
 (3)、三颈烧瓶中反应生成了Fe和 ,离子方程式为。(4)、为保证产品性能,需使其粒径适中、结晶度良好,可采取的措施有_______。A、采用适宜的滴液速度 B、用盐酸代替KOH溶液,抑制 水解 C、在空气氛围中制备 D、选择适宜的焙烧温度(5)、步骤④中判断沉淀是否已经用水洗涤干净,应选择的试剂为;使用乙醇洗涤的目的是。(6)、该实验所得磁性材料的产率为(保留3位有效数字)。9. 亚硝酰氯 可作为有机合成试剂。
(3)、三颈烧瓶中反应生成了Fe和 ,离子方程式为。(4)、为保证产品性能,需使其粒径适中、结晶度良好,可采取的措施有_______。A、采用适宜的滴液速度 B、用盐酸代替KOH溶液,抑制 水解 C、在空气氛围中制备 D、选择适宜的焙烧温度(5)、步骤④中判断沉淀是否已经用水洗涤干净,应选择的试剂为;使用乙醇洗涤的目的是。(6)、该实验所得磁性材料的产率为(保留3位有效数字)。9. 亚硝酰氯 可作为有机合成试剂。已知:①
②沸点: 为-6℃, 为-34℃, 为-152℃。
③ 易水解,能与 反应。
某研究小组用 和 在如图所示装置中制备 ,并分离回收未反应的原料。

回答问题:
(1)、通入 和 前先通入氩气,作用是;仪器 的名称是。(2)、将催化剂负载在玻璃棉上而不是直接平铺在玻璃管中,目的是。(3)、实验所需的 可用 和 溶液在稀 中反应制得,离子反应方程式为。(4)、为分离产物和未反应的原料,低温溶槽A的温度区间应控制在 , 仪器C收集的物质是。(5)、无色的尾气若遇到空气会变为红棕色,原因是。10. 含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。(1)、实验室沿用舍勒的方法制取 的化学方程式为。(2)、实验室制取干燥 时,净化与收集 所需装置的接口连接顺序为。
(3)、某氯水久置后不能使品红溶液褪色,可推测氯水中已分解。检验此久置氯水中 存在的操作及现象是。(4)、某合作学习小组进行以下实验探究。①实验任务。通过测定溶液电导率,探究温度对 溶解度的影响。
②查阅资料。电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。25℃时, 。
③提出猜想。
猜想a:较高温度的 饱和溶液的电导率较大。
猜想b: 在水中的溶解度 。
④设计实验、验证猜想。取试样Ⅰ、Ⅱ、Ⅲ(不同温度下配制的 饱和溶液),在设定的测试温度下,进行表中实验1~3,记录数据。
实验序号
试样
测试温度/℃
电导率/
1
Ⅰ:25℃的 饱和溶液
25
2
Ⅱ:35℃的 饱和溶液
35
3
Ⅲ:45℃的 饱和溶液
45
⑤数据分析、交流讨论。25℃的 饱和溶液中, 。
实验结果为 。小组同学认为,此结果可以证明③中的猜想 成立,但不足以证明猜想 成立。结合②中信息,猜想 不足以成立的理由有。
⑥优化实验。小组同学为进一步验证猜想 ,在实验1~3的基础上完善方案,进行实验4和5。请在答题卡上完成表中内容。
实验序号
试样
测试温度/℃
电导率/
4
Ⅰ
5
⑦实验总结。根据实验1~5的结果,并结合②中信息,小组同学认为猜想 也成立。猜想 成立的判断依据是。
11. 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。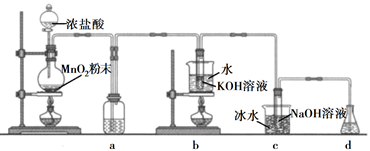
回答下列问题:
(1)、盛放MnO2粉末的仪器名称是 , a中的试剂为。(2)、b中采用的加热方式是 , c中化学反应的离子方程式是 , 采用冰水浴冷却的目的是。(3)、d的作用是 , 可选用试剂(填标号)。A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4
(4)、反应结束后,取出b中试管,经冷却结晶, , , 干燥,得到KClO3晶体。(5)、取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显色。可知该条件下KClO3的氧化能力NaClO(填“大于”或“小于")。