高考化学真题重组卷 7+4专题冲刺 专题10 电化学
试卷更新日期:2023-02-21 类型:三轮冲刺
一、单选题
-
1. 含磷有机物应用广泛。电解法可实现由白磷直接制备 , 过程如图所示(为甲基)。下列说法正确的是( )
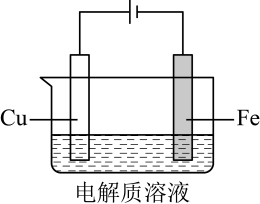
 A、生成 , 理论上外电路需要转移电子 B、阴极上的电极反应为: C、在电解过程中向铂电极移动 D、电解产生的中的氢元素来自于2. 武当山金殿是铜铸鎏金大殿。传统鎏金工艺是将金溶于汞中制成“金汞漆”,涂在器物表面,然后加火除汞,使金附着在器物表面。下列说法错误的是( )A、鎏金工艺利用了汞的挥发性 B、鎏金工艺中金发生了化学反应 C、鎏金工艺的原理可用于金的富集 D、用电化学方法也可实现铜上覆金3. 利用下图装置进行铁上电镀铜的实验探究。
A、生成 , 理论上外电路需要转移电子 B、阴极上的电极反应为: C、在电解过程中向铂电极移动 D、电解产生的中的氢元素来自于2. 武当山金殿是铜铸鎏金大殿。传统鎏金工艺是将金溶于汞中制成“金汞漆”,涂在器物表面,然后加火除汞,使金附着在器物表面。下列说法错误的是( )A、鎏金工艺利用了汞的挥发性 B、鎏金工艺中金发生了化学反应 C、鎏金工艺的原理可用于金的富集 D、用电化学方法也可实现铜上覆金3. 利用下图装置进行铁上电镀铜的实验探究。装置示意图
序号
电解质溶液
实验现象
①
阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有
②
阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无元素
下列说法错误的是( )
A、①中气体减少,推测是由于溶液中减少,且覆盖铁电极,阻碍与铁接触 B、①中检测到 , 推测可能发生反应: C、随阴极析出 , 推测②中溶液减少,平衡逆移 D、②中生成 , 使得比①中溶液的小,缓慢析出,镀层更致密4. 一种采用和为原料制备的装置示意图如下。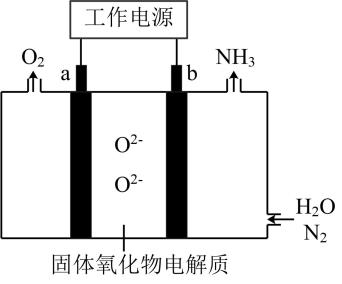
下列有关说法正确的是( )
A、在b电极上,被还原 B、金属Ag可作为a电极的材料 C、改变工作电源电压,反应速率不变 D、电解过程中,固体氧化物电解质中不断减少5. 海水电池在海洋能源领域备受关注,一种锂-海水电池构造示意图如下。下列说法错误的是( ) A、海水起电解质溶液作用 B、N极仅发生的电极反应: C、玻璃陶瓷具有传导离子和防水的功能 D、该锂-海水电池属于一次电池6. 以熔融盐为电解液,以含 和 等的铝合金废料为阳极进行电解,实现 的再生。该过程中( )A、阴极发生的反应为 B、阴极上 被氧化 C、在电解槽底部产生含 的阳极泥 D、阳极和阴极的质量变化相等7. 科学家基于 易溶于 的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时电极a的反应为:
A、海水起电解质溶液作用 B、N极仅发生的电极反应: C、玻璃陶瓷具有传导离子和防水的功能 D、该锂-海水电池属于一次电池6. 以熔融盐为电解液,以含 和 等的铝合金废料为阳极进行电解,实现 的再生。该过程中( )A、阴极发生的反应为 B、阴极上 被氧化 C、在电解槽底部产生含 的阳极泥 D、阳极和阴极的质量变化相等7. 科学家基于 易溶于 的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时电极a的反应为:下列说法正确的是( )
 A、充电时电极b是阴极 B、放电时 溶液的 减小 C、放电时 溶液的浓度增大 D、每生成 ,电极a质量理论上增加
A、充电时电极b是阴极 B、放电时 溶液的 减小 C、放电时 溶液的浓度增大 D、每生成 ,电极a质量理论上增加二、综合题
-
8. 工业上以铬铁矿(FeCr2O4 , 含Al、Si氧化物等杂质)为主要原料制备红矾钠(Na2Cr2O7•2H2O)的工艺流程如图。回答下列问题:
 (1)、焙烧的目的是将FeCr2O4转化为Na2Cr2O4并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是。(2)、矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示。当溶液中可溶组分浓度c≤1.0×10-5mol•L-1时,可认为已除尽。
(1)、焙烧的目的是将FeCr2O4转化为Na2Cr2O4并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是。(2)、矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示。当溶液中可溶组分浓度c≤1.0×10-5mol•L-1时,可认为已除尽。
中和时pH的理论范围为;酸化的目的是;Fe元素在(填操作单元的名称)过程中除去。
(3)、蒸发结晶时,过度蒸发将导致;冷却结晶所得母液中,除Na2Cr2O7外,可在上述流程中循环利用的物质还有。(4)、利用膜电解技术(装置如图所示),以Na2Cr2O4为主要原料制备Na2Cr2O7的总反应方程式为:4Na2Cr2O4+4H2O 2Na2Cr2O7+4NaOH+2H2↑+O2↑。则Na2Cr2O7在(填“阴”或“阳”)极室制得,电解时通过膜的离子主要为。 9. 氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。
9. 氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。方法I:氨热分解法制氢气
相关化学键的键能数据
化学键
键能
946
436.0
390.8
一定温度下,利用催化剂将 分解为 和 。回答下列问题:
(1)、反应 ;(2)、已知该反应的 ,在下列哪些温度下反应能自发进行?_______(填标号)A、25℃ B、125℃ C、225℃ D、325℃(3)、某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将 通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。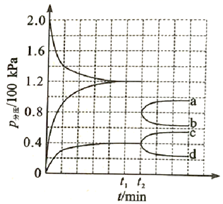
①若保持容器体积不变, 时反应达到平衡,用 的浓度变化表示 时间内的反应速率 (用含 的代数式表示)
② 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是(用图中a、b、c、d表示),理由是;
③在该温度下,反应的标准平衡常数 。(已知:分压=总压×该组分物质的量分数,对于反应 , ,其中 , 、 、 、 为各组分的平衡分压)。
方法Ⅱ:氨电解法制氢气
利用电解原理,将氮转化为高纯氢气,其装置如图所示。
 (4)、电解过程中 的移动方向为(填“从左往右”或“从右往左”);(5)、阳极的电极反应式为。
(4)、电解过程中 的移动方向为(填“从左往右”或“从右往左”);(5)、阳极的电极反应式为。KOH溶液KOH溶液
10. CO2/ HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。 (1)、CO2催化加氢。在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO- , 其离子方程式为;其他条件不变,HCO3-转化为HCOO-的转化率随温度的变化如图-1所示。反应温度在40℃~80℃范围内,HCO3-催化加氢的转化率迅速上升,其主要原因是。(2)、HCOOH燃料电池。研究 HCOOH燃料电池性能的装置如图-2所示,两电极区间用允许K+、H+通过的半透膜隔开。
(1)、CO2催化加氢。在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO- , 其离子方程式为;其他条件不变,HCO3-转化为HCOO-的转化率随温度的变化如图-1所示。反应温度在40℃~80℃范围内,HCO3-催化加氢的转化率迅速上升,其主要原因是。(2)、HCOOH燃料电池。研究 HCOOH燃料电池性能的装置如图-2所示,两电极区间用允许K+、H+通过的半透膜隔开。
①电池负极电极反应式为;放电过程中需补充的物质A为(填化学式)。
②图-2所示的 HCOOH燃料电池放电的本质是通过 HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为。
(3)、HCOOH催化释氢。在催化剂作用下, HCOOH分解生成CO2和H2可能的反应机理如图-3所示。
①HCOOD催化释氢反应除生成CO2外,还生成(填化学式)。
②研究发现:其他条件不变时,以 HCOOK溶液代替 HCOOH催化释氢的效果更佳,其具体优点是。
11. 天然气的主要成分为CH4 , 一般还含有C2H6等烃类,是重要的燃料和化工原料。(1)、乙烷在一定条件可发生如下反应:C2H6(g)= C2H4(g)+H2(g) ΔH , 相关物质的燃烧热数据如下表所示:物质
C2H6(g)
C2H4(g)
H2(g)
燃烧热ΔH/( kJ·mol−1)
-1560
-1411
-286
①ΔH=kJ·mol−1。
②提高该反应平衡转化率的方法有、。
③容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)、高温下,甲烷生成乙烷的反应如下:2CH4 C2H6+H2。反应在初期阶段的速率方程为:r=k× ,其中k为反应速率常数。①设反应开始时的反应速率为r1 , 甲烷的转化率为α时的反应速率为r2 , 则r2= r1。
②对于处于初期阶段的该反应,下列说法正确的是。
A.增加甲烷浓度,r增大 B.增加H2浓度,r增大
C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小
(3)、CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
①阴极上的反应式为。
②若生成的乙烯和乙烷的体积比为2∶1,则消耗的CH4和CO2体积比为。