高考化学真题重组卷 7+4专题冲刺 专题9 难溶电解质的沉淀溶解平衡
试卷更新日期:2023-02-21 类型:三轮冲刺
一、单选题
-
1. 已知相同温度下, 。某温度下,饱和溶液中 、 、与 的关系如图所示。

下列说法正确的是( )
A、曲线①代表 的沉淀溶解曲线 B、该温度下 的 值为 C、加适量 固体可使溶液由a点变到b点 D、 时两溶液中2. 向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是( )A、c(CO32﹣) B、c(Mg2+) C、c(H+) D、Ksp(MgCO3)3. 绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( ) A、图中a和b分别为T1、T2温度下CdS在水中的溶解度 B、图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q) C、向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动 D、温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动4. 在温热气候条件下,浅海地区有厚层的石灰石沉积,而深海地区却很少。下列解析错误的是( )A、与深海地区相比,浅海地区水温较高,有利于游离的CO2增多、石灰石沉积 B、与浅海地区相比,深海地区压强大,石灰石岩层易被CO2溶解,沉积少 C、深海地区石灰石岩层的溶解反应为:CaCO3(s)+H2O(l)+CO2(aq)=Ca(HCO3)2(aq) D、 海水呈弱酸性,大气中CO2浓度增加,会导致海水中CO
A、图中a和b分别为T1、T2温度下CdS在水中的溶解度 B、图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q) C、向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动 D、温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动4. 在温热气候条件下,浅海地区有厚层的石灰石沉积,而深海地区却很少。下列解析错误的是( )A、与深海地区相比,浅海地区水温较高,有利于游离的CO2增多、石灰石沉积 B、与浅海地区相比,深海地区压强大,石灰石岩层易被CO2溶解,沉积少 C、深海地区石灰石岩层的溶解反应为:CaCO3(s)+H2O(l)+CO2(aq)=Ca(HCO3)2(aq) D、 海水呈弱酸性,大气中CO2浓度增加,会导致海水中CO 浓度增大
5. 某温度下向含AgCl固体的AgCl饱和溶液中加少量稀盐酸,下列说法正确的是( )
浓度增大
5. 某温度下向含AgCl固体的AgCl饱和溶液中加少量稀盐酸,下列说法正确的是( )
A、AgCl的溶解度、Ksp均减小 B、AgCl的溶解度、Ksp均不变 C、AgCl的溶解度减小、Ksp不变 D、AgCl的溶解度不变、Ksp减小6.在湿法炼锌的电解循环溶液中,较高浓度的Cl﹣会腐蚀阳极板而增大电解能耗.可向溶液中同时加入Cu和CuSO4 , 生成CuCl沉淀从而除去Cl﹣ . 根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )
 A、Ksp(CuCl)的数量级为10﹣7 B、除Cl﹣反应为Cu+Cu2++2Cl﹣=2CuCl C、加入Cu越多,Cu+浓度越高,除Cl﹣ . 效果越好 D、2Cu+=Cu2++Cu平衡常数很大,反应趋于完全7. 根据下列实验操作和现象所得出的结论正确的是( )
A、Ksp(CuCl)的数量级为10﹣7 B、除Cl﹣反应为Cu+Cu2++2Cl﹣=2CuCl C、加入Cu越多,Cu+浓度越高,除Cl﹣ . 效果越好 D、2Cu+=Cu2++Cu平衡常数很大,反应趋于完全7. 根据下列实验操作和现象所得出的结论正确的是( )选项
实验操作和现象
结论
A
向苯酚浊液中滴加Na2CO3溶液,浊液变清
苯酚的酸性强于H2CO3的酸性
B
向碘水中加入等体积CCl4 , 振荡后静置,上层接近无色,下层显紫红色
I2在CCl4中的溶解度大于在水中的溶解度
C
向CuSO4溶液中加入铁粉,有红色固体析出
Fe2+的氧化性强于Cu2+的氧化性
D
向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成
Ksp(AgCl) >Ksp(AgI)
A、A B、B C、C D、D二、综合题
-
8. 从钒铬锰矿渣(主要成分为 、 、 )中提铬的一种工艺流程如下:

已知:pH较大时,二价锰[ ](在空气中易被氧化.回答下列问题:
(1)、Cr元素位于元素周期表第周期族。(2)、用 溶液制备 胶体的化学方程式为。(3)、常温下,各种形态五价钒粒子总浓度的对数[ ]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中 ,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为(填化学式)。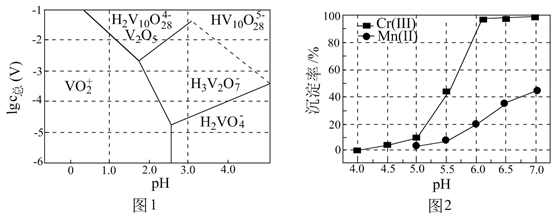 (4)、某温度下, 、 的沉淀率与pH关系如图2。“沉铬”过程最佳pH为;在该条件下滤液B中 ( 近似为 , 的 近似为 )。(5)、“转化”过程中生成 的离子方程式为。(6)、“提纯”过程中 的作用为。9. 用软锰矿(主要成分为MnO2 , 含少量Fe3O4、Al2O3)和BaS制备高纯MnCO3的工艺流程如下:
(4)、某温度下, 、 的沉淀率与pH关系如图2。“沉铬”过程最佳pH为;在该条件下滤液B中 ( 近似为 , 的 近似为 )。(5)、“转化”过程中生成 的离子方程式为。(6)、“提纯”过程中 的作用为。9. 用软锰矿(主要成分为MnO2 , 含少量Fe3O4、Al2O3)和BaS制备高纯MnCO3的工艺流程如下: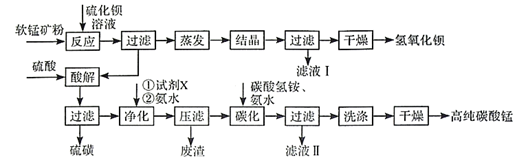
已知:MnO2是一种两性氧化物;25℃时相关物质的Ksp见下表。
物质
Fe(OH)2
Fe(OH)3
Al(OH)3
Mn(OH)2
Ksp
回答下列问题
(1)、软锰矿预先粉碎的目的是 , MnO2与BaS溶液反应转化为MnO的化学方程式为。(2)、保持BaS投料量不变,随MnO2与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是。(3)、滤液I可循环使用,应当将其导入到操作中(填操作单元的名称)。(4)、净化时需先加入的试剂X为(填化学式)。再使用氨水调溶液的pH,则pH的理论最小值为(当溶液中某离子浓度 时,可认为该离子沉淀完全)。(5)、碳化过程中发生反应的离子方程式为。三、实验探究题
-
10. 硫代硫酸钠在纺织业等领域有广泛应用。某兴趣小组用下图装置制备 。

合成反应:
滴定反应:
已知: 易溶于水,难溶于乙醇, 开始失结晶水。
实验步骤:
Ⅰ. 制备:装置A制备的 经过单向阀通入装置C中的混合溶液,加热、搅拌,至溶液 约为7时,停止通入 气体,得产品混合溶液。
Ⅱ.产品分离提纯:产品混合溶液经蒸发浓缩、冷却结晶、过滤洗涤、干燥,得到 产品。
Ⅲ.产品纯度测定:以淀粉作指示剂,用 产品配制的溶液滴定碘标准溶液至滴定终点,计算 含量。
请回答:
(1)、步骤Ⅰ:单向阀的作用是;装置C中的反应混合溶液 过高或过低将导致产率降低,原因是。(2)、步骤Ⅱ:下列说法正确的是。A 快速蒸发溶液中水分,可得较大晶体颗粒
B 蒸发浓缩至溶液表面出现品晶膜时,停止加热
C 冷却结晶后的固液混合物中加入乙醇可提高产率
D 可选用冷的 溶液作洗涤剂
(3)、步骤Ⅲ①滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):
检漏→蒸馏水洗涤→()→()→()→()→()→开始滴定。
A 烘干 B 装入滴定液至零刻度以上 C 调整滴定液液面至零刻度或零刻度以下D 用洗耳球吹出润洗液 E 排除气泡 F 用滴定液润洗2至3次 G 记录起始读数
②装标准碘溶液的碘量瓶(带瓶塞的锥形瓶)在滴定前应盖上瓶塞,目的是。
③滴定法测得产品中 含量为 ,则 产品中可能混有的物质是。
11. 实验室由炼钢污泥(简称铁泥,主要成分为铁的氧化物)制备软磁性材料α-Fe2O3。其主要实验流程如下:
 (1)、酸浸:用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有___________(填序号)。A、适当升高酸浸温度 B、适当加快搅拌速度 C、适当缩短酸浸时间(2)、还原:向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+。“还原”过程中除生成Fe2+外,还会生成(填化学式);检验Fe3+是否还原完全的实验操作是。(3)、除杂:向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低、将会导致CaF2沉淀不完全,其原因是[ , ]。(4)、沉铁:将提纯后的FeSO4溶液与氨水-NH4HCO3混合溶液反应,生成FeCO3沉淀。
(1)、酸浸:用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有___________(填序号)。A、适当升高酸浸温度 B、适当加快搅拌速度 C、适当缩短酸浸时间(2)、还原:向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+。“还原”过程中除生成Fe2+外,还会生成(填化学式);检验Fe3+是否还原完全的实验操作是。(3)、除杂:向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低、将会导致CaF2沉淀不完全,其原因是[ , ]。(4)、沉铁:将提纯后的FeSO4溶液与氨水-NH4HCO3混合溶液反应,生成FeCO3沉淀。①生成FeCO3沉淀的离子方程式为。
②设计以FeSO4溶液、氨水- NH4HCO3混合溶液为原料,制备FeCO3的实验方案:。
(FeCO3沉淀需“洗涤完全”,Fe(OH)2开始沉淀的pH=6.5)。