高考化学真题重组卷 7+4专题冲刺 专题8 盐的水解及应用
试卷更新日期:2023-02-21 类型:三轮冲刺
一、单选题
-
1. 水溶液呈酸性的盐是( )A、NH4Cl B、BaCl2 C、H2SO4 D、Ca(OH)22. 下列说法不正确的是( )A、纯碱可用于去除物品表面的油污 B、二氧化碳可用作镁燃烧的灭火剂 C、植物秸秆可用于制造酒精 D、氢氧化铁胶体可用作净水剂3. 某同学在两个相同的特制容器中分别加入20mL0.4mol·L-1Na2CO3溶液和40mL0.2mol·L-1NaHCO3溶液,再分别用0.4mol·L-1盐酸滴定,利用pH计和压力传感器检测,得到如图曲线:

下列说法正确的的是( )
A、图中甲、丁线表示向NaHCO3溶液中滴加盐酸,乙、丙线表示向Na2CO3溶液中滴加盐酸 B、当滴加盐酸的体积为V1mL时(a点、b点),所发生的反应用离子方程式表示为:HCO+H+=CO2↑+H2O C、根据pH—V(HCl)图,滴定分析时,c点可用酚酞、d点可用甲基橙作指示剂指示滴定终点 D、Na2CO3和NaHCO3溶液中均满足:c(H2CO3)-c(CO)=c(OH-)-c(H+)4. 常温下,下列有关电解质溶液的叙述正确的是( )A、在 溶液中 B、在 溶液中 C、在 溶液中 D、氨水和NH4Cl溶液混合,形成pH=9的溶液中5. 用 盐酸滴定 溶液,溶液中 、 、 的分布分数 随pH变化曲线及滴定曲线如图。下列说法正确的是(如 分布分数: )( ) A、 的 为 B、c点: C、第一次突变,可选酚酞作指示剂 D、6. 下列实验中,均产生白色沉淀。
A、 的 为 B、c点: C、第一次突变,可选酚酞作指示剂 D、6. 下列实验中,均产生白色沉淀。 下列分析错误的是( )A、Na2CO3与NaHCO3溶液中所含微粒种类相同 B、CaCl2能促进Na2CO3、NaHCO3水解 C、Al2(SO4)3能促进Na2CO3、NaHCO3水解 D、4个实验中,溶液滴入后,试管中溶液pH均降低7. 鸟嘌呤( )是一种有机弱碱,可与盐酸反应生成盐酸盐(用 表示)。已知 水溶液呈酸性,下列叙述正确的是( )A、 水溶液的 B、 水溶液加水稀释, 升高 C、 在水中的电离方程式为: D、 水溶液中:
下列分析错误的是( )A、Na2CO3与NaHCO3溶液中所含微粒种类相同 B、CaCl2能促进Na2CO3、NaHCO3水解 C、Al2(SO4)3能促进Na2CO3、NaHCO3水解 D、4个实验中,溶液滴入后,试管中溶液pH均降低7. 鸟嘌呤( )是一种有机弱碱,可与盐酸反应生成盐酸盐(用 表示)。已知 水溶液呈酸性,下列叙述正确的是( )A、 水溶液的 B、 水溶液加水稀释, 升高 C、 在水中的电离方程式为: D、 水溶液中:二、综合题
-
8. 可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以 形式存在,还含有 、 、 、 等物质。以独居石为原料制备 的工艺流程如下:
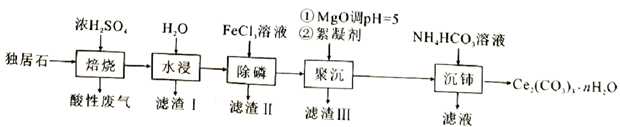
回答下列问题:
(1)、铈的某种核素含有58个质子和80个中子,该核素的符号为;(2)、为提高“水浸”效率,可采取的措施有(至少写两条);(3)、滤渣Ⅲ的主要成分是(填化学式);(4)、加入絮凝剂的目的是;(5)、“沉铈”过程中,生成 的离子方程式为 , 常温下加入的 溶液呈(填“酸性”“碱性”或“中性”)(已知: 的 , 的 , );(6)、滤渣Ⅱ的主要成分为 ,在高温条件下, 、葡萄糖( )和 可制备电极材料 ,同时生成 和 ,该反应的化学方程式为三、实验探究题
-
9. 胆矾( )易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的 (杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:(1)、制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有(填标号)。
A.烧杯 B.容量瓶 C.蒸发皿 D.移液管
(2)、将 加入到适量的稀硫酸中,加热,其主要反应的化学方程式为 , 与直接用废铜和浓硫酸反应相比,该方法的优点是。(3)、待 完全反应后停止加热,边搅拌边加入适量 ,冷却后用 调 为3.5~4,再煮沸 ,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、、乙醇洗涤、 , 得到胆矾。其中,控制溶液 为3.5~4的目的是 , 煮沸 的作用是。(4)、结晶水测定:称量干燥坩埚的质量为 ,加入胆矾后总质量为 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为 。根据实验数据,胆矾分子中结晶水的个数为(写表达式)。(5)、下列操作中,会导致结晶水数目测定值偏高的是(填标号)。①胆矾未充分干燥 ②坩埚未置于干燥器中冷却 ③加热时有少胆矾迸溅出来
10. 某兴趣小组在定量分析了镁渣[含有MgCO3、Mg(OH)2、CaCO3、Al2O3、Fe2O3和SiO2]中Mg含量的基础上,按如下流程制备六水合氯化镁(MgCl2·6H2O)。
相关信息如下:
①700℃只发生MgCO3和Mg(OH)2的分解反应。
②NH4Cl溶液仅与体系中的MgO反应,且反应程度不大。
③“蒸氨”是将氨从固液混合物中蒸出来,且须控制合适的蒸出量。
请回答:
(1)、下列说法正确的是________。A、步骤Ⅰ,煅烧样品的容器可以用坩埚,不能用烧杯和锥形瓶 B、步骤Ⅲ,蒸氨促进平衡正向移动,提高MgO的溶解量 C、步骤Ⅲ,可以将固液混合物C先过滤,再蒸氨 D、步骤Ⅳ,固液分离操作可采用常压过滤,也可采用减压过滤(2)、步骤Ⅲ,需要搭建合适的装置,实现蒸氨、吸收和指示于一体(用硫酸溶液吸收氨气)。①选择必须的仪器,并按连接顺序排列(填写代表仪器的字母,不考虑夹持和橡皮管连接):热源→。

②为了指示蒸氨操作完成,在一定量硫酸溶液中加指示剂。请给出并说明蒸氨可以停止时的现象。
(3)、溶液F经盐酸酸化、蒸发、结晶、过滤、洗涤和低温干燥得到产品。取少量产品溶于水后发现溶液呈碱性。①含有的杂质是。
②从操作上分析引入杂质的原因是。
(4)、有同学采用盐酸代替步骤Ⅱ中的NH4Cl溶液处理固体B,然后除杂,制备MgCl2溶液。已知金属离子形成氢氧化物沉淀的pH范围:金属离子
pH
开始沉淀
完全沉淀
Al3+
3.0
4.7
Fe3+
1.1
2.8
Ca2+
11.3
-
Mg2+
8.4
10.9
请给出合理的操作排序(从下列操作中选取,按先后次序列出字母,操作可重复使用):固体B→a→()→()→()→()→()→()→MgCl2溶液→产品。
a.用盐酸溶解 b.调pH=3.0 c.调pH=5.0 d.调pH=8.5
e.调pH=11.0 f.过滤 g.洗涤
11.氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空:

已知: H2SO3 Ki1=1.54×10-2 Ki2=1.02×10-7
HClO Ki1=2.95×10-8
H2CO3 Ki1=4.3×10-7 Ki2=5.6×10-11
(1)、写出电解饱和食盐水的离子方程式。(2)、离子交换膜的作用为: 、 。(3)、精制饱和食盐水从图中 位置补充,氢氧化钠溶液从图中 位置流出。(选填“a”、“b”、“c”或“d”)(4)、KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2 , 还生成CO2和KHSO4等物质。写出该反应的化学方程式
(5)、室温下,0.1 mol/L NaClO溶液的pH 0.1 mol/L Na2SO3溶液的pH。(选填“大于”、“小于”或“等于”)。浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32–、CO32–、HSO3–、HCO3– 浓度从大到小的顺序为 。
-