高考化学真题重组卷 7+4专题冲刺 专题6 化学反应速率和化学平衡
试卷更新日期:2023-02-21 类型:三轮冲刺
一、单选题
-
1. 同位素示踪是研究反应机理的重要手段之一、已知醛与在酸催化下存在如下平衡:。据此推测,对羟基苯甲醛与10倍量的在少量酸催化下反应,达到平衡后,下列化合物中含量最高的是( )A、
 B、
B、 C、
C、 D、
D、 2. 捕获和转化可减少排放并实现资源利用,原理如图1所示。反应①完成之后,以为载气,以恒定组成的混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到 , 在催化剂上有积碳。
2. 捕获和转化可减少排放并实现资源利用,原理如图1所示。反应①完成之后,以为载气,以恒定组成的混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到 , 在催化剂上有积碳。
下列说法错误的是( )
A、反应①为;反应②为 B、 , 比多,且生成速率不变,可能有副反应 C、时刻,副反应生成的速率大于反应②生成速率 D、之后,生成的速率为0,是因为反应②不再发生3. 某多孔材料孔径大小和形状恰好将“固定”,能高选择性吸附。废气中的被吸附后,经处理能全部转化为。原理示意图如下。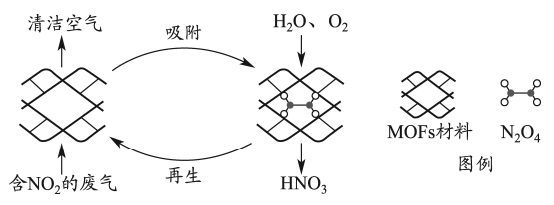
已知:
下列说法错误的是( )
A、温度升高时不利于吸附 B、多孔材料“固定” , 促进平衡正向移动 C、转化为的反应是 D、每获得时,转移电子的数目为4. 恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:, 测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确的是( )
 A、实验①, , B、实验②,时处于平衡状态, C、相同条件下,增加氨气的浓度,反应速率增大 D、相同条件下,增加催化剂的表面积,反应速率增大5. 铝电解厂烟气净化的一种简单流程如下:
A、实验①, , B、实验②,时处于平衡状态, C、相同条件下,增加氨气的浓度,反应速率增大 D、相同条件下,增加催化剂的表面积,反应速率增大5. 铝电解厂烟气净化的一种简单流程如下: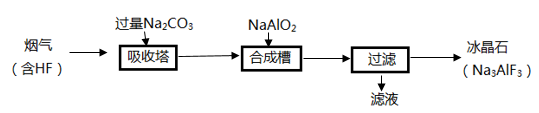
下列说法错误的是( )
A、不宜用陶瓷作吸收塔内衬材料 B、采用溶液喷淋法可提高吸收塔内烟气吸收效率 C、合成槽中产物主要有 和 D、滤液可回收进入吸收塔循环利用6. AB型强电解质在水中的溶解(可视作特殊的化学反应)表示为AB(s)=An+(aq)+Bn-(aq),其焓变和熵变分别为ΔH和ΔS。对于不同组成的AB型强电解质,下列说法正确的是( )A、ΔH和ΔS均大于零 B、ΔH和ΔS均小于零 C、ΔH可能大于零或小于零,ΔS大于零 D、ΔH和ΔS均可能大于零或小于零7. 某温度下,在恒容密闭容器中加入一定量X,发生反应 ,一段时间后达到平衡。下列说法错误的是( )A、升高温度,若 增大,则 B、加入一定量Z,达新平衡后 减小 C、加入等物质的量的Y和Z,达新平衡后 增大 D、加入一定量氩气,平衡不移动二、综合题
-
8. 工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为:。回答下列问题:(1)、合成氨反应在常温下(填“能”或“不能”)自发。(2)、温(填“高”或“低”,下同)有利于提高反应速率,温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用。
针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
(3)、方案一:双温-双控-双催化剂。使用双催化剂,通过光辐射产生温差(如体系温度为时,的温度为 , 而的温度为)。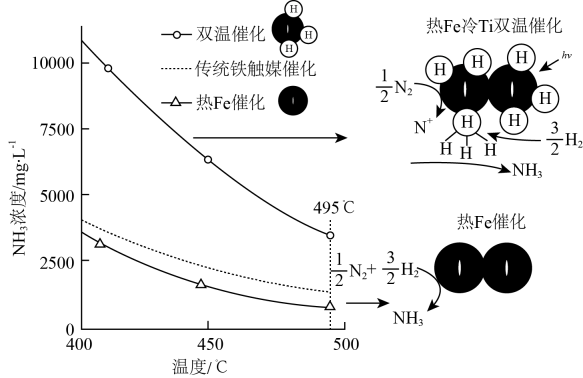
下列说法正确的是。
a.氨气在“冷Ti”表面生成,有利于提高氨的平衡产率
b.在“热Fe”表面断裂,有利于提高合成氨反应速率
c.“热Fe”高于体系温度,有利于提高氨的平衡产率
d.“冷Ti”低于体系温度,有利于提高合成氨反应速率
(4)、方案二:复合催化剂。
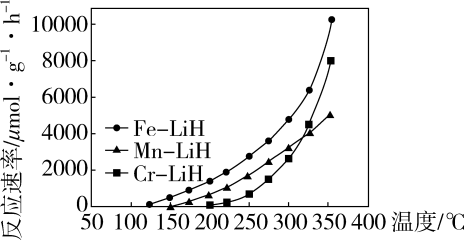
下列说法正确的是。
a.时,复合催化剂比单一催化剂效率更高
b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
(5)、某合成氨速率方程为: , 根据表中数据,;实验
1
m
n
p
q
2
2m
n
p
2q
3
m
n
0.1p
10q
4
m
2n
p
2.828q
在合成氨过程中,需要不断分离出氨的原因为。
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
(6)、某种新型储氢材料的晶胞如图,八面体中心为M金属离子,顶点均为配体;四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为 , 则M元素为(填元素符号);在该化合物中,M离子的价电子排布式为。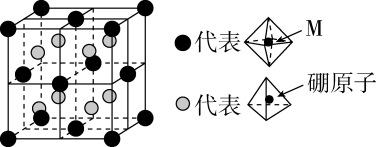 9. 氨基钠()是重要的化学试剂,实验室可用下图装置(夹持、搅拌、尾气处理装置已省略)制备。
9. 氨基钠()是重要的化学试剂,实验室可用下图装置(夹持、搅拌、尾气处理装置已省略)制备。
简要步骤如下:
Ⅰ.在瓶A中加入液氨和 , 通入氨气排尽密闭体系中空气,搅拌。
Ⅱ.加入钠粒,反应,得粒状沉积物。
Ⅲ.除去液氨,得产品。
已知:几乎不溶于液氨,易与水、氧气等反应。
请回答:
(1)、的作用是;装置B的作用是。(2)、步骤Ⅰ,为判断密闭体系中空气是否排尽,请设计方案。(3)、步骤Ⅱ,反应速率应保持在液氨微沸为宜。为防止速率偏大,可采取的措施有。(4)、下列说法不正确的是____。A、步骤Ⅰ中,搅拌的目的是使均匀地分散在液氨中 B、步骤Ⅱ中,为判断反应是否已完成,可在N处点火,如无火焰,则反应已完成 C、步骤Ⅲ中,为避免污染,应在通风橱内抽滤除去液氨,得到产品 D、产品应密封保存于充满干燥氮气的瓶中(5)、产品分析:假设是产品的唯一杂质,可采用如下方法测定产品纯度。从下列选项中选择最佳操作并排序。准确称取产品→→→→计算
a.准确加入过量的水
b.准确加入过量的标准溶液
c.准确加入过量的标准溶液
d.滴加甲基红指示剂(变色的范围4.4~6.2)
e.滴加石蕊指示剂(变色的范围4.5~8.3)
f.滴加酚酞指示剂(变色的范围8.2~10.0)
g.用标准溶液滴定
h.用标准溶液滴定
i.用标准溶液滴定
10. 丙烯是一种重要的化工原料,可以在催化剂作用下,由丙烷直接脱氢或氧化脱氢制备。反应Ⅰ(直接脱氢):C3H8(g)=C3H6(g)+H2(g)△H1=+125kJ·mol-1
反应Ⅱ(氧化脱氢):C3H8(g)+ O2(g)=C3H6(g)+H2O(g)△H2=-118kJ·mol-1
(1)、已知键能:E(C—H)=416kJ·mol-1 , E(H—H)=436kJ·mol-1 , 由此计算生成1mol碳碳π键放出的能量为kJ。(2)、对于反应Ⅰ,总压恒定为100kPa,在密闭容器中通入C3H8和N2的混合气体(N2不参与反应),从平衡移动的角度判断,达到平衡后“通入N2”的作用是。在温度为T1时,C3H8的平衡转化率与通入气体中C3H8的物质的量分数的关系如图a所示,计算T1时反应Ⅰ的平衡常数Kp=kPa(以分压表示,分压=总压×物质的量分数,保留一位小数)。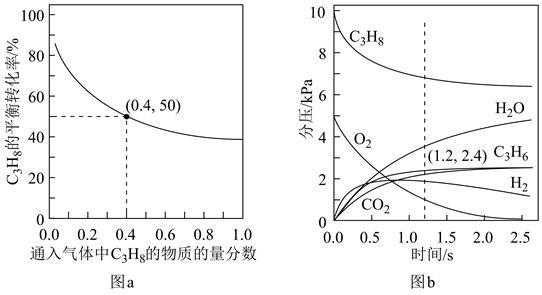 (3)、在温度为T2时,通入气体分压比为p(C3H8):p(O2):p(N2)=10:5:85的混合气体,各组分气体的分压随时间的变化关系如图b所示。0~1.2s生成C3H6的平均速率为kPa·s-1;;在反应一段时间后,C3H8和O2的消耗速率比小于2∶1的原因为。(4)、恒温刚性密闭容器中通入气体分压比为p(C3H8):p(O2):p(N2)=2:13:85的混合气体,已知某反应条件下只发生如下反应(k,k′为速率常数):
(3)、在温度为T2时,通入气体分压比为p(C3H8):p(O2):p(N2)=10:5:85的混合气体,各组分气体的分压随时间的变化关系如图b所示。0~1.2s生成C3H6的平均速率为kPa·s-1;;在反应一段时间后,C3H8和O2的消耗速率比小于2∶1的原因为。(4)、恒温刚性密闭容器中通入气体分压比为p(C3H8):p(O2):p(N2)=2:13:85的混合气体,已知某反应条件下只发生如下反应(k,k′为速率常数):反应Ⅱ:2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) k
反应Ⅲ:2C3H6(g)+9O2(g)=6CO2(g)+6H2O(g) k′
实验测得丙烯的净生成速率方程为v(C3H6)=kp(C3H8)-k′p(C3H6),可推测丙烯的浓度随时间的变化趋势为 , 其理由是。
11. CS2是一种重要的化工原料。工业上可以利用硫(S8)与CH4为原料制备CS2 , S8受热分解成气态S2 , 发生反应 ,回答下列问题:(1)、CH4的电子式为 , CS2分子的立体构型为。(2)、某温度下,若S8完全分解成气态S2。在恒温密闭容器中,S2与CH4物质的量比为2∶1时开始反应。①当CS2的体积分数为10%时,CH4的转化率为。
②当以下数值不变时,能说明该反应达到平衡的是(填序号)。
a.气体密度b.气体总压c.CH4与S2体积比d.CS2的体积分数
(3)、一定条件下,CH4与S2反应中CH4的平衡转化率、S8分解产生S2的体积分数随温度的变化曲线如图所示。据图分析,生成CS2的反应为(填“放热”或“吸热”)反应。工业上通常采用在600~650℃的条件下进行此反应,不采用低于600℃的原因是。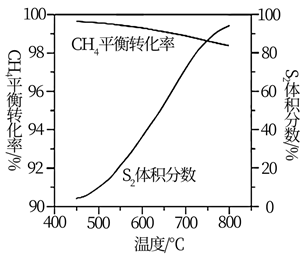 (4)、用燃煤废气(含N2、O2、SO2、CO2、H2O、NOx等)使尾气中的H2S转化为单后硫S,可实现废物利用,保护环境,写出其中一个反应的化学方程式。
(4)、用燃煤废气(含N2、O2、SO2、CO2、H2O、NOx等)使尾气中的H2S转化为单后硫S,可实现废物利用,保护环境,写出其中一个反应的化学方程式。