高考化学真题重组卷 7+4专题冲刺 专题5 化学反应与能量
试卷更新日期:2023-02-21 类型:三轮冲刺
一、单选题
-
1. 标准状态下,下列物质气态时的相对能量如下表:
物质(g)
O
H
能量/
249
218
39
10
0
0
可根据计算出中氧氧单键的键能为。下列说法不正确的是( )
A、的键能为 B、的键能大于中氧氧单键的键能的两倍 C、解离氧氧单键所需能量: D、2. 相关有机物分别与氢气发生加成反应生成1mol环己烷( )的能量变化如图所示:
)的能量变化如图所示:
下列推理不正确的是( )
A、2ΔH1≈ΔH2 , 说明碳碳双键加氢放出的热量与分子内碳碳双键数目成正比 B、ΔH2<ΔH3 , 说明单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定 C、3ΔH1<ΔH4 , 说明苯分子中不存在三个完全独立的碳碳双键 D、ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子具有特殊稳定性3. “天问一号”着陆火星,“嫦娥五号”采回月壤。腾飞中国离不开化学,长征系列运载火箭使用的燃料有液氢和煤油等化学品。下列有关说法正确的是( )A、煤油是可再生能源 B、 燃烧过程中热能转化为化学能 C、火星陨石中的 质量数为20 D、月壤中的 与地球上的 互为同位素4. 已知共价键的键能与热化学方程式信息如下表:共价键
H- H
H-O
键能/(kJ·mol-1)
436
463
热化学方程式
2H2(g) + O2 (g)=2H2O(g) ΔH= -482kJ·mol-1
则2O(g)=O2(g)的ΔH为( )
A、428 kJ·mol-1 B、-428 kJ·mol-1 C、498 kJ·mol-1 D、-498 kJ·mol-15. 关于下列 的判断正确的是( )A、 B、 C、 D、6. 理论研究表明,在101kPa和298K下, 异构化反应过程的能量变化如图所示。下列说法错误的是( ) A、HCN比HNC稳定 B、该异构化反应的 C、正反应的活化能大于逆反应的活化能 D、使用催化剂,可以改变反应的反应热7. MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
A、HCN比HNC稳定 B、该异构化反应的 C、正反应的活化能大于逆反应的活化能 D、使用催化剂,可以改变反应的反应热7. MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):M2+(g)+CO32-(g)
 M2+(g)+O2−(g)+CO2(g)
M2+(g)+O2−(g)+CO2(g)


已知:离子电荷相同时,半径越小,离子键越强。下列说法错误的是( )
A、ΔH1(MgCO3)>ΔH1(CaCO3)>0 B、ΔH2(MgCO3)=ΔH2(CaCO3)>0 C、ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO) D、对于MgCO3和CaCO3 , ΔH1+ΔH2>ΔH3二、综合题
-
8. 金属钛()在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石转化为 , 再进一步还原得到钛。回答下列问题:(1)、转化为有直接氯化法和碳氯化法.在时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化:
(ⅱ)碳氯化:①反应的为 , 。
②碳氯化的反应趋势远大于直接氯化,其原因是。
③对于碳氯化反应:增大压强,平衡移动(填“向左”“向右”或“不”);温度升高,平衡转化率(填“变大”“变小”或“不变”)。
(2)、在 , 将、C、以物质的量比1∶2.2∶2进行反应.体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。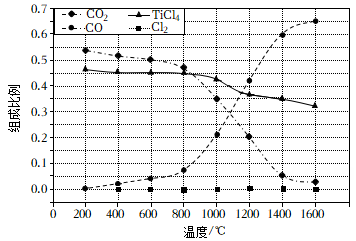
①反应的平衡常数。
②图中显示,在平衡时几乎完全转化为 , 但实际生产中反应温度却远高于此温度,其原因是。
(3)、碳氯化是一个“气—固—固”反应,有利于“固—固”接触的措施是。9. 工业上,以煤炭为原料,通入一定比例的空气和水蒸气,经过系列反应可以得到满足不同需求的原料气。请回答:(1)、在C和O2的反应体系中:反应1:C(s)+O2(g)=CO2(g) ΔH1=-394kJ·mol-1
反应2:2CO(g)+O2(g)=2CO2(g) ΔH2=-566kJ·mol-1
反应3:2C(s)+O2(g)=2CO(g) ΔH3。
① 设y=ΔH-TΔS,反应1、2和3的y随温度的变化关系如图1所示。图中对应于反应3的线条是。
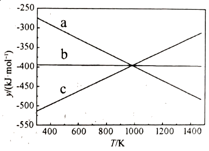
②一定压强下,随着温度的升高,气体中CO与CO2的物质的量之比。
A.不变 B.增大 C.减小 D.无法判断
(2)、水煤气反应:C(s)+H2O(g)=CO(g)+H2(g) ΔH=131kJ·mol-1。工业生产水煤气时,通常交替通入合适量的空气和水蒸气与煤炭反应,其理由是。(3)、一氧化碳变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41kJ·mol-1。①一定温度下,反应后测得各组分的平衡压强(即组分的物质的量分数×总压):p(CO)=0.25MPa、p(H2O)=0.25MPa、p(CO2)=0.75MPa和p(H2)=0.75MPa,则反应的平衡常数K的数值为。
②维持与题①相同的温度和总压,提高水蒸气的比例,使CO的平衡转化率提高到90%,则原料气中水蒸气和CO的物质的量之比为。
③生产过程中,为了提高变换反应的速率,下列措施中合适的是。
A.反应温度愈高愈好 B.适当提高反应物压强
C.选择合适的催化剂 D.通入一定量的氮气
④以固体催化剂M催化变换反应,若水蒸气分子首先被催化剂的活性表面吸附而解离,能量-反应过程如图2所示。
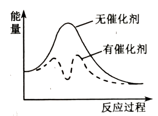
用两个化学方程式表示该催化反应历程(反应机理):步骤Ⅰ:;步骤Ⅱ:。
10. 碳及其化合物间的转化广泛存在于自然界及人类的生产和生活中。已知25℃, 时:① 葡萄糖 完全燃烧生成 和 ,放出 热量。
② 。
回答问题:
(1)、25℃时, 与 经光合作用生成葡萄糖 和 的热化学方程式为。(2)、25℃, 时,气态分子断开 化学键的焓变称为键焓。已知 、 键的键焓分别为 、 , 分子中碳氧键的键焓为 。(3)、溶于水的 只有部分转化为 ,大部分以水合 的形式存在,水合 可用 表示。已知25℃时, 的平衡常数 ,正反应的速率可表示为 ,逆反应的速率可表示为 ,则 (用含 的代数式表示)。(4)、25℃时,潮湿的石膏雕像表面会发生反应: ,其平衡常数 。[已知 , ](5)、溶洞景区限制参观的游客数量,主要原因之一是游客呼吸产生的气体对钟乳石有破坏作用,从化学平衡的角度说明其原因。三、实验探究题
-
11. 钛( )及其合金是理想的高强度、低密度结构材料。以钛渣(主要成分为 ,含少量V、 和 的氧化物杂质)为原料,制备金属钛的工艺流程如下:

已知“降温收尘”后,粗 中含有的几种物质的沸点:
物质
沸点/
136
127
57
180
回答下列问题:
(1)、已知 , 的值只决定于反应体系的始态和终态,忽略 、 随温度的变化。若 ,则该反应可以自发进行。根据下图判断: 时,下列反应不能自发进行的是______________。 A、 B、 C、 D、(2)、 与C、 在 的沸腾炉中充分反应后,混合气体中各组分的分压如下表:
A、 B、 C、 D、(2)、 与C、 在 的沸腾炉中充分反应后,混合气体中各组分的分压如下表:物质
分压/
①该温度下, 与C、 反应的总化学方程式为;
②随着温度升高,尾气中 的含量升高,原因是。
(3)、“除钒”过程中的化学方程式为;“除硅、铝”过程中,分离 中含 、 杂质的方法是。(4)、“除钒”和“除硅、铝”的顺序(填“能”或“不能”)交换,理由是。(5)、下列金属冶炼方法与本工艺流程中加入 冶炼 的方法相似的是______________。A、高炉炼铁 B、电解熔融氯化钠制钠 C、铝热反应制锰 D、氧化汞分解制汞