高考化学真题重组卷 7+4专题冲刺 专题3 氧化还原反应
试卷更新日期:2023-02-21 类型:三轮冲刺
一、单选题
-
1. 镀锌铁钉放入棕色的碘水中,溶液褪色;取出铁钉后加入少量漂白粉,溶液恢复棕色;加入 , 振荡,静置,液体分层。下列说法正确的是( )A、褪色原因为被还原 B、液体分层后,上层呈紫红色 C、镀锌铁钉比镀锡铁钉更易生锈 D、溶液恢复棕色的原因为被氧化2. 下列物质混合后,因发生氧化还原反应使溶液减小的是( )A、向溶液中加入少量溶液,生成白色沉淀 B、向和的悬浊液中通入空气,生成红褐色沉淀 C、向溶液中加入少量溶液,生成蓝绿色沉淀 D、向溶液中通入氯气,生成黄色沉淀3. 古医典富载化学知识,下述之物见其氧化性者为( )A、金(Au):“虽被火亦未熟" B、石灰(CaO):“以水沃之,即热蒸而解” C、石硫黄(S):“能化……银、铜、铁,奇物” D、石钟乳():“色黄,以苦酒(醋)洗刷则白”4. 在NO催化下,丙烷与氧气反应制备丙烯的部分反应机理如图所示。下列说法错误的是( )
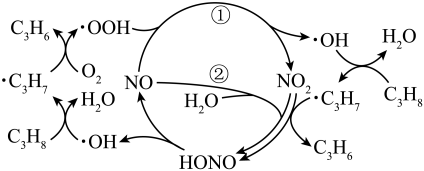 A、含N分子参与的反应一定有电子转移 B、由NO生成的反应历程有2种 C、增大NO的量,的平衡转化率不变 D、当主要发生包含②的历程时,最终生成的水减少5. 实验室制备过程为:①高温下在熔融强碱性介质中用氧化制备;②水溶后冷却,调溶液至弱碱性,歧化生成和;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得。下列说法正确的是( )A、①中用瓷坩埚作反应器 B、①中用作强碱性介质 C、②中只体现氧化性 D、转化为的理论转化率约为66.7%6. 关于反应 , 下列说法正确的是( )A、发生还原反应 B、既是氧化剂又是还原剂 C、氧化产物与还原产物的物质的量之比为2∶1 D、发生反应,转移电子7. 关于反应 所涉及的物质,下列说法错误的是( )A、H2SO4在该反应中为氧化剂 B、Na2SO3容易被空气中的O2氧化变质 C、Na2SO4是含有共价键的离子化合物 D、SO2是导致酸雨的主要有害污染物
A、含N分子参与的反应一定有电子转移 B、由NO生成的反应历程有2种 C、增大NO的量,的平衡转化率不变 D、当主要发生包含②的历程时,最终生成的水减少5. 实验室制备过程为:①高温下在熔融强碱性介质中用氧化制备;②水溶后冷却,调溶液至弱碱性,歧化生成和;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得。下列说法正确的是( )A、①中用瓷坩埚作反应器 B、①中用作强碱性介质 C、②中只体现氧化性 D、转化为的理论转化率约为66.7%6. 关于反应 , 下列说法正确的是( )A、发生还原反应 B、既是氧化剂又是还原剂 C、氧化产物与还原产物的物质的量之比为2∶1 D、发生反应,转移电子7. 关于反应 所涉及的物质,下列说法错误的是( )A、H2SO4在该反应中为氧化剂 B、Na2SO3容易被空气中的O2氧化变质 C、Na2SO4是含有共价键的离子化合物 D、SO2是导致酸雨的主要有害污染物二、实验探究题
-
8. 某小组同学探究不同条件下氯气与二价锰化合物的反应。
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、(绿色)、(紫色)。
ii.浓碱条件下,可被OH-还原为。
iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)

序号
物质a
C中实验现象
通入Cl2前
通入Cl2后
I
水
得到无色溶液
产生棕黑色沉淀,且放置后不发生变化
II
5%NaOH溶液
产生白色沉淀,在空气中缓慢变成棕黑色沉淀
棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
III
40%NaOH 溶液
产生白色沉淀,在空气中缓慢变成棕黑色沉淀
棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
(1)、B中试剂是。(2)、通入Cl2前,II、III中沉淀由白色变为黑色的化学方程式为。(3)、对比实验I、II通入Cl2后的实验现象,对于二价锰化合物还原性的认识是。(4)、根据资料ii,III中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将氧化为。
①化学方程式表示可能导致溶液碱性减弱的原因 , 但通过实验测定溶液的碱性变化很小。
②取III中放置后的1 mL悬浊液,加入4 mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为 , 溶液绿色缓慢加深,原因是MnO2被(填“化学式”)氧化,可证明III的悬浊液中氧化剂过量;
③取II中放置后的1 mL悬浊液,加入4 mL水,溶液紫色缓慢加深,发生的反应是。
④从反应速率的角度,分析实验III未得到绿色溶液的可能原因。
9. 煤中硫的存在形态分为有机硫和无机硫(、硫化物及微量单质硫等)。库仑滴定法是常用的快捷检测煤中全硫含量的方法。其主要过程如下图所示。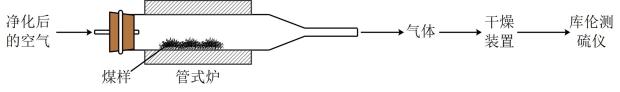
已知:在催化剂作用下,煤在管式炉中燃烧,出口气体主要含。
(1)、煤样需研磨成细小粉末,其目的是。(2)、高温下,煤中完全转化为 , 该反应的化学方程式为。(3)、通过干燥装置后,待测气体进入库仑测硫仪进行测定。已知:库仑测硫仪中电解原理示意图如下。检测前,电解质溶液中保持定值时,电解池不工作。待测气体进入电解池后,溶解并将还原,测硫仪便立即自动进行电解到又回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。

①在电解池中发生反应的离子方程式为。
②测硫仪工作时电解池的阳极反应式为。
(4)、煤样为 , 电解消耗的电量为x库仑,煤样中硫的质量分数为。已知:电解中转移电子所消耗的电量为96500库仑。
(5)、条件控制和误差分析。①测定过程中,需控制电解质溶液 , 当时,非电解生成的使得测得的全硫含量偏小,生成的离子方程式为。
②测定过程中,管式炉内壁上有残留,测得全硫量结果为。(填“偏大”或“偏小”)
10. 胆矾()是一种重要化工原料,某研究小组以生锈的铜屑为原料[主要成分是Cu,含有少量的油污、CuO、、]制备胆矾。流程如下。
回答问题:
(1)、步骤①的目的是。(2)、步骤②中,若仅用浓溶解固体B,将生成(填化学式)污染环境。(3)、步骤②中,在存在下Cu溶于稀 , 反应的化学方程式为。(4)、经步骤④得到的胆矾,不能用水洗涤的主要原因是。(5)、实验证明,滤液D能将氧化为。ⅰ.甲同学认为不可能是步骤②中过量将氧化为 , 理由是。
ⅱ.乙同学通过实验证实,只能是将氧化为 , 写出乙同学的实验方案及结果(不要求写具体操作过程)。
11. 铁黄是一种重要的化工产品。由生产钛白粉废渣制备铁黄的过程如下。 资料:
资料:i.钛白粉废渣成分:主要为FeSO4·H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O⇌TiO2·xH2O↓+H2SO4
iii.0.1 mol/L Fe2+生成Fe(OH)2 , 开始沉淀时pH=6.3,完全沉淀时pH=8.3;
0.1 mol/L Fe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
(1)、纯化①加入过量铁粉的目的是。
②充分反应后,分离混合物的方法是。
(2)、制备晶种为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如图)。

①产生白色沉淀的离子方程式是。
②产生白色沉淀后的pH低于资料iii中的6.3。原因是:沉淀生成后c(Fe2+)0.1mol/L(填“>”“=”或“<”)。
③0-t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因:。
④pH≈4时制得铁黄晶种。若继续通入空气,t3后pH几乎不变,此时溶液中c(Fe2+)仍降低,但c(Fe3+)增加,且(Fe2+)降低量大于c(Fe3+)增加量。结合总方程式说明原因:。
(3)、产品纯度测定铁黄纯度可以通过产品的耗酸量确定。
wg铁黄 溶液b 溶液c 滴定
资料:Fe3++3 =Fe(C2O4) ,Fe(C2O4) 不与稀碱液反应
Na2C2O4过量,会使测定结果(填“偏大”“偏小”或“不受影响”)