高考化学真题重组卷 7+4专题冲刺 专题2 离子反应
试卷更新日期:2023-02-21 类型:三轮冲刺
一、单选题
-
1. 下列各组离子在给定溶液中能大量共存的是( )A、在氨水中: B、在氯化钠溶液中: C、在醋酸溶液中: D、在硝酸银溶液中:2. 下列方程式与所给事实不相符的是( )A、加热固体,产生无色气体: B、过量铁粉与稀硝酸反应,产生无色气体: C、苯酚钠溶液中通入 , 出现白色浑浊:
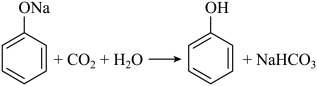 D、乙醇、乙酸和浓硫酸混合加热,产生有香味的油状液体:
3. 下列反应的离子方程式不正确的是( )A、盐酸中滴加溶液: B、溶液中通入过量: C、乙醇与酸性溶液反应: D、溴与冷的溶液反应:4. 下列关于 的化合物之间转化反应的离子方程式书写正确的是( )A、碱转化为酸式盐: B、碱转化为两种盐: C、过氧化物转化为碱: D、盐转化为另一种盐:5. 能正确表示下列反应的离子方程式为( )A、硫化钠溶液和硝酸混合: B、明矾溶液与过量氨水湿合: C、硅酸钠溶液中通入二氧化碳: D、将等物质的量浓度的和溶液以体积比1∶2混合:6. 对于下列实验,不能正确描述其反应的离子方程式是( )A、向氢氧化钡溶液中加入盐酸:H++OH-=H2O B、向硝酸银溶液中滴加少量碘化钾溶液:Ag++I-=AgI↓ C、向烧碱溶液中加入一小段铝片:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ D、向次氯酸钙溶液中通入少量二氧化碳气体:ClO-+CO2+H2O=HClO+HCO7. 常温下,下列各组离子在给定溶液中能大量共存的是( )A、pH=1的溶液:Fe2+、Mg2+、 、 B、pH=12的溶液:K+、Na+、 、 C、pH=7的溶液:Na+、Cu2+、S2-、Cl- D、pH=7的溶液:Al3+、K+、Cl-、
D、乙醇、乙酸和浓硫酸混合加热,产生有香味的油状液体:
3. 下列反应的离子方程式不正确的是( )A、盐酸中滴加溶液: B、溶液中通入过量: C、乙醇与酸性溶液反应: D、溴与冷的溶液反应:4. 下列关于 的化合物之间转化反应的离子方程式书写正确的是( )A、碱转化为酸式盐: B、碱转化为两种盐: C、过氧化物转化为碱: D、盐转化为另一种盐:5. 能正确表示下列反应的离子方程式为( )A、硫化钠溶液和硝酸混合: B、明矾溶液与过量氨水湿合: C、硅酸钠溶液中通入二氧化碳: D、将等物质的量浓度的和溶液以体积比1∶2混合:6. 对于下列实验,不能正确描述其反应的离子方程式是( )A、向氢氧化钡溶液中加入盐酸:H++OH-=H2O B、向硝酸银溶液中滴加少量碘化钾溶液:Ag++I-=AgI↓ C、向烧碱溶液中加入一小段铝片:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ D、向次氯酸钙溶液中通入少量二氧化碳气体:ClO-+CO2+H2O=HClO+HCO7. 常温下,下列各组离子在给定溶液中能大量共存的是( )A、pH=1的溶液:Fe2+、Mg2+、 、 B、pH=12的溶液:K+、Na+、 、 C、pH=7的溶液:Na+、Cu2+、S2-、Cl- D、pH=7的溶液:Al3+、K+、Cl-、二、综合题
-
8. 硫铁化合物(、等)应用广泛。(1)、纳米可去除水中微量六价铬。在的水溶液中,纳米颗粒表面带正电荷,主要以、、好形式存在,纳米去除水中主要经过“吸附→反应→沉淀”的过程。
已知: , ;电离常数分别为、。
①在弱碱性溶液中,与反应生成、和单质S,其离子方程式为。
②在弱酸性溶液中,反应的平衡常数K的数值为。
③在溶液中,pH越大,去除水中的速率越慢,原因是。
(2)、具有良好半导体性能。的一种晶体与晶体的结构相似,该晶体的一个晶胞中的数目为 , 在晶体中,每个S原子与三个紧邻,且间距相等,如图给出了晶胞中的和位于晶胞体心的(中的键位于晶胞体对角线上,晶胞中的其他已省略)。如图中用“-”将其中一个S原子与紧邻的连接起来。 (3)、、在空气中易被氧化,将在空气中氧化,测得氧化过程中剩余固体的质量与起始的质量的比值随温度变化的曲线如图所示。时,氧化成含有两种元素的固体产物为(填化学式,写出计算过程)。
(3)、、在空气中易被氧化,将在空气中氧化,测得氧化过程中剩余固体的质量与起始的质量的比值随温度变化的曲线如图所示。时,氧化成含有两种元素的固体产物为(填化学式,写出计算过程)。 9. 工业上以氟磷灰石[ , 含等杂质]为原料生产磷酸和石膏,工艺流程如下:
9. 工业上以氟磷灰石[ , 含等杂质]为原料生产磷酸和石膏,工艺流程如下:
回答下列问题:
(1)、酸解时有产生。氢氟酸与反应生成二元强酸 , 离子方程式为。(2)、部分盐的溶度积常数见下表。精制Ⅰ中,按物质的量之比加入脱氟,充分反应后,;再分批加入一定量的 , 首先转化为沉淀的离子是。(3)、浓度(以计)在一定范围时,石膏存在形式与温度、浓度(以计)的关系如图甲所示。酸解后,在所得、为45的混合体系中,石膏存在形式为(填化学式);洗涤时使用一定浓度的硫酸溶液而不使用水,原因是 , 回收利用洗涤液X的操作单元是;一定温度下,石膏存在形式与溶液中和的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是(填标号)。
A.、、 B.、、
C.、、 D.、、
10. 废旧铅蓄电池的铅膏中主要含有、、和 , 还有少量、、的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。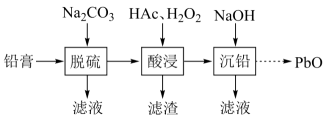
一些难溶电解质的溶度积常数如下表:
难溶电解质
一定条件下,一些金属氢氧化物沉淀时的如下表:
金属氢氧化物
开始沉淀的
2.3
6.8
3.5
7.2
完全沉淀的
3.2
8.3
4.6
9.1
回答下列问题:
(1)、在“脱硫”中转化反应的离子方程式为 , 用沉淀溶解平衡原理解释选择的原因。(2)、在“脱硫”中,加入不能使铅膏中完全转化,原因是。(3)、在“酸浸”中,除加入醋酸(),还要加入。(ⅰ)能被氧化的离子是;
(ⅱ)促进了金属在醋酸中转化为 , 其化学方程式为;
(ⅲ)也能使转化为 , 的作用是。
(4)、“酸浸”后溶液的约为4.9,滤渣的主要成分是。(5)、“沉铅”的滤液中,金属离子有。11. 对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝( )、钼( )、镍( )等元素的氧化物,一种回收利用工艺的部分流程如下: 已知:25℃时, 的 , ; ; ;该工艺中, 时,溶液中 元素以 的形态存在。(1)、“焙烧”中,有 生成,其中 元素的化合价为。(2)、“沉铝”中,生成的沉淀 为。(3)、“沉钼”中, 为7.0。
已知:25℃时, 的 , ; ; ;该工艺中, 时,溶液中 元素以 的形态存在。(1)、“焙烧”中,有 生成,其中 元素的化合价为。(2)、“沉铝”中,生成的沉淀 为。(3)、“沉钼”中, 为7.0。①生成 的离子方程式为。
②若条件控制不当, 也会沉淀。为避免 中混入 沉淀,溶液中 (列出算式)时,应停止加入 溶液。
(4)、①滤液Ⅲ中,主要存在的钠盐有 和 , 为。②往滤液Ⅲ中添加适量 固体后,通入足量(填化学式)气体,再通入足量 ,可析出 。
(5)、高纯 (砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止 刻蚀液与下层 (砷化镓)反应。
①该氧化物为。②已知: 和 同族, 和 同族。在 与上层 的反应中, 元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为。